Что такое микробиологическая лаборатория
Оснащение микробиологической лаборатории: от рабочего места «классического» микробиолога до новейших экспресс-систем детекции микроорганизмов
Применение лабораторных методов исследования является одним из ключевых аспектов идентификации микроорганизмов. В арсенале специалистов в настоящее время есть разнообразные методы лабораторной диагностики: как классические, так и новейшие, появившиеся в последние десятилетия и нашедшие широкое применение в практике.
Все большее внимание уделяется микробиологическим анализаторам, позволяющим использовать их для детекции патогенных и условно-патогенных микроорганизмов, проводить их видовую идентификацию, оценивать чувствительность к антимикробным препаратам. Такое оборудование позволяет автоматизировать и упростить работу микробиолога, сократить наиболее трудоемкие этапы исследования в лаборатории и оперативно получить результаты.
Всё более востребованными становятся, такие методы как масс-спектрометрия, полимеразная цепная реакция (ПЦР), секвенирование, фрагментация генома и анализ спектра фрагментов, гибридизация на микрочипах и т.п.
В настоящее время из молекулярно-генетических методов исследования наиболее широкое применение занимает ПЦР «в реальном времени», которая благодаря появлению доступных и удобных в использовании приборов (QuantStudio 5 Thermo FS) завоевала прочное место в повседневной работе лабораторий. В основе ПЦР лежит процесс многократного копирования (амплификации) специфической последовательности ДНК, осуществляемый in vitro, с детекцией продуктов амплификации. Анализаторы на основе ПЦР метода сокращают время анализа, обеспечивают высокую надежность регистрации результатов и упрощают организацию работы лаборатории, в целом. Благодаря очень высокой специфичности и чувствительности, метод ПЦР нашел широкое применение в медицине, биологии, ветеринарии, криминалистике, санитарных службах и других отраслях для детекции и идентификации микроорганизмов, вирусов, в том числе в продуктах питания и растительных материалах, для детекции ГМО.
В последнее десятилетие технология секвенирования внесла большой вклад в развитие современной микробиологии. Секвенирование используется для надежной идентификации любого микроорганизма, изучения факторов патогенности или адаптации на генном уровне, разработки методов генной инженерии, оценки биологического разнообразия микробного сообщества без культивирования. Метод секвенирования (Ion GeneStudio S5) в настоящее время нашел еще одно применение в решении прикладной задачи пищевой отрасли – определение видовой оценки качества сырья и готового продукта для подтверждением его происхождения.
Несмотря на появление новейших методов диагностики микроорганизмов, классические микробиологические методы исследований являются по-прежнему «золотым стандартом» практически в каждой бактериологической лаборатории.
Бактериологические лаборатории организуются при больницах, санитарно-эпидемиологических станциях, ветеринарных службах, на производственных предприятиях, в научных учреждениях, различных проверяющих организациях. Как правило, при бактериологической лаборатории имеются: средоварочная, моечная, препараторская, стерилизационная. Оборудование в бактериологических лабораториях должно быть приспособлено для выполнения исследований в чистых условиях, предупреждающих персонал от возможного заражения. Помимо общелабораторного оборудования, на каждом рабочем месте должны быть: спиртовая или газовая горелки, штативы для пробирок, чашек Петри, вата, ерши для мытья посуды, бактериальные петли, серологические пипетки, пипетки Пастера, пинцеты, ножницы, скальпель, предметные и покровные стекла. В бактериологической лаборатории должны находиться металлические ведра или пакеты для утилизации использованной посуды. Кроме обычной лабораторной посуды, бактериологические лаборатории дополнительно снабжаются специальными видами посуды: чашки Петри для выращивания бактерий на плотных средах, качалочные колбы и мешки. Необходимы также резиновые груши для забора в пипетки исследуемый образец. Бактериологическая посуда должна быть чисто вымыта, стерилизована термообработкой и закрыта стерильными целлюлозными пробками. Важнейшими для бактериологической лаборатории являются инструменты для посевов микроорганизмов: бактерильные петли, пастеровские пипетки, стеклянные и платиновые шпатели. Для проведения посевов в асептических условиях бактериологические лаборатории оснащаются специальными застекленными боксами, оборудованными ультрафиолетовыми лампами. Бактериологической лаборатории необходимы: холодильник для хранения бактериальных культур, сывороток и других биологических субстратов, микроскоп с осветителем, центрифуга, термостаты с нагревом или с охлаждением для выращивания бактерий, аппарат для встряхивания различных смесей, автоклав и сухожаровой стерилизатор (сушильный шкаф) для стерилизации питательных сред, посуды и электрические стерилизаторы.
Часть I. Общая микробиология
Микробиологические лаборатории организуются при больницах, поликлиниках и санитарно-эпидемиологических станциях (СЭС).
Материалом для микробиологических исследований служат чаще всего выделения человека (испражнения, моча, рвотные массы, мокрота, отделяемое ран), а также кровь, желчь, спинномозговая жидкость, промывные воды желудка, бронхов, трупный (секционный) материал и др.
Работа в микробиологической лаборатории с заразным материалом делает обязательным размещение ее в изолированном помещении. Для выполнения всех правил работы с заразным материалом и проведения микробиологических исследований лаборатория должна иметь несколько помещений:
Число лабораторных комнат определяется объемом работы лаборатории. В крупных лабораториях выделяют отдельные комнаты для работы с различными видами возбудителей.
Рабочий стол устанавливают у окна, чтобы свет падал сбоку или прямо. На столе размещают горелку, бактериологические петли, банки с дезинфицирующим раствором и ватой.
Внимание! Перед началом работы на столе размещают все необходимое для проведения исследования. Горелку устанавливают на расстоянии, равном предплечью работающего, т. е. в позиции, исключающей лишние движения во время работы. Размер пламени в горелке и правильное свечение регулируют до начала работы.
В термостате при проведении обычных исследований температура должна быть 37° С. В больших лабораториях может быть оборудована специальная термальная комната. Температуру ежедневно региструют.
В холодильнике держат некоторые питательные среды, диагностические препараты, кровь, желчь и пр.
Центрифугу используют для отделения плотных частиц от жидкости (например, эритроцитов от сыворотки).
В шкафах держат штативы, посуду, сухие питательные среды, реактивы и т. п.
Около раковины должны находиться сосуд с дезинфицирующим раствором для обработки рук и аптечка с набором предметов для оказания первой медицинской помощи.
Внимание! В боксе не разговаривают и избегают лишних движений.
Помещение для приготовления питательных сред должно находиться рядом с моечной и стерилизационной. В этой комнате должна быть раковина с подводкой горячей и холодной воды, дистиллятор, плита (газовая или электрическая), шкафы или стеллажи для хранения сухих питательных сред, химических реактивов, стерильной посуды.
В стерилизационной находятся приборы для стерилизации чистой посуды, питательных сред и обеззараживания отработанного материала: автоклавы, сушильный шкаф и др. (см. главу 5).
При наличии отдельной препараторской комнаты ее используют для подготовки, упаковки посуды и другой подсобной работы.
В регистратуре, или части помещения ее заменяющей, принимают и регистрируют материал, поступающий для исследования, и выдают заключения микробиологического исследования.
Правила поведения и работы в микробиологической лаборатории
1. К работе допускают сотрудников только после ознакомления с правилами поведения и режимом работы.
2. Все работники подвергаются профилактическим прививкам, главным образом против кишечных инфекций.
3. Каждый сотрудник имеет халат и шапочку; в лаборатории носят сменную обувь.
4. Каждый сотрудник обязан строго соблюдать личную гигиену, содержать в чистоте рабочее место.
5. Поступающий в лабораторию материал регистрируют в специальный журнал и маркируют.
6. Весь поступающий материал для исследования считают инфицированным (заразным). Его ставят на специальный поднос, а емкость с материалом протирают дезинфицирующим раствором снаружи.
7. Переливать исследуемый материал из одной емкости в другую следует над дезинфицирующим раствором. Жидкий материал отсасывают с помощью резинового баллона, надетого на пипетку.
8. При попадании исследуемого материала на руки, стол или другие предметы их обрабатывают дезинфицирующим раствором.
9. По окончании работы руки, инструменты, рабочее место обрабатывают дезинфицирующим раствором. Культуры обезвреживают или, при необходимости, сохраняют в холодильнике, который опечатывают. Материал, требующий продолжения исследования, ставят в термостат, который тоже опечатывают. При хранении патогенных культур в лаборатории их регистрируют в специальном журнале. Указывают количество культур, даты их поступления, пересева, уничтожения.
10. В лаборатории категорически запрещается принимать пищу и курить.
11. В лаборатории ежедневно проводят влажную уборку помещений с применением дезинфицирующих растворов. Еженедельно моют стены, полы, инвентарь горячей водой с мылом. Бокс убирают в конце рабочего дня, а перед работой облучают бактерицидными лампами.
Режим работы в лабораториях зависит от степени опасности заражения для лиц, работающих с болезнетворными микроорганизмами или материалом, их содержащим.
Микроорганизмы по степени опасности заражения ими разделены на четыре группы:
I. Возбудители чумы.
II. Возбудители высококонтагиозных эпидемических заболеваний (холера, бруцеллез, туляремия, сибирская язва, сап, мелиоидоз, лептоспироз).
III. Возбудители эпидемических бактериальных инфекций: кишечных (брюшной тиф, паратифы А и В, дизентерия), туберкулеза, дифтерии, коклюша, менингита, гонореи, листериоза, трахомы, лепры; патогенные анаэробы, спирохеты (возбудители эпидемического возвратного тифа и сифилиса) и др.
IV. Сальмонеллы, протей, эшерихии, клебсиеллы, гемоглобинофильные бактерии, стафилококки, стрептококки, возбудители газовой гангрены и др.
Большое значение для микробиологического исследования имеет техника взятия исследуемого материала и способ доставки его в лабораторию. Любой материал должен быть собран в стерильную посуду с соблюдением условий, предохраняющих его от загрязнения посторонней микрофлорой.
Испражнения берут специальной ректальной петлей, которую вводят в прямую кишку на 8-15 см. Петлю помещают в пробирку с консервантом (глицериновая смесь, фосфатно-буферная смесь и т. п.). Можно также использовать стерильные картонные тарелки или судно, обработанное дезинфицирующим раствором (10% хлорная известь) и тщательно промытое горячей водой для удаления следов хлорной извести.
Мочу берут стерильным катетером в стерильные флаконы или пробирки.
Гнойное отделяемое из раны, мазки из зева и носа берут стерильными ватными тампонами и помещают в стерильные пробирки. Рвотные массы собирают в стерильную широкогорлую банку, закрытую вощаной бумагой.
Трупный (секционный) материал следует брать в первые часы после смерти больного, так как микрофлора кишечника очень быстро распространяется по всему организму. Кровь из сердца берут стерильным шприцем, стерильными ножницами вырезают кусочки печени, селезенки и других органов. Все пробы для микробиологического исследования помещают в стерильные сосуды.
На пробирку, банку, флаконы с материалом для исследования наклеивают этикетку, на которой указаны фамилия, имя, отчество, возраст больного и дата взятия материала. В направлении повторяют сведения, приведенные на этикетке, и дополнительно сообщают: характер материала, учреждение, направившее материал, клинический диагноз, цель исследования и фамилию врача, направляющего материал.
Доставку исследуемого материала в лабораторию производят в кратчайший срок в специальных металлических биксах, контейнерах, пеналах. Материал, содержащий микроорганизмы, малоустойчивые во внешней среде, переносят в специальных сосудах, в которых поддерживается температура 37° С, при доставке вирусного материала используют термосы со льдом для создания низкой температуры.
Внимание! Правильный сбор и транспортировка исследуемого материала обеспечивают эффективность микробиологических исследований.
Методы микробиологического исследования
Микроскопический метод используется для изучения окрашенных мазков и мазков из нативного материала в микроскопе и позволяет характеризовать морфологию (форму) возбудителя, его отношение к различным красителям, подвижность. С помощью этого метода можно подтвердить клинический диагноз гонореи, дифтерии, возвратного тифа, сифилиса и некоторых других болезней.
Микробиологический метод применяют для выделения и изучения чистой культуры возбудителя, т. е. для установления этиологии заболевания. Лабораторная диагностика большинства инфекционных болезней (брюшной тиф, дизентерия, холера, коклюш и др.) основана на применении этого метода.
Контрольные вопросы
1. Каковы задачи микробиологической лаборатории?
2. Какие помещения имеет микробиологическая лаборатория?
3. Как следует вести себя при работе в микробиологической лаборатории?
4. Как собирают и пересылают в лабораторию материал для микробиологического исследования?
Что такое микробиологическая лаборатория
Актуальность вопроса
Микробиологическая, или бактериологическая лаборатория входит в состав клинико-диагностической лаборатории на базе научного или медицинского учреждения. Здесь проводят исследования, цель которых — выявить или опровергнуть наличие возбудителя в организме человека или в окружающей среде.
Поскольку сотрудники работают с патогенными микроорганизмами, микробиологическая лаборатория должна быть оснащена качественным, надёжным и функциональным оборудованием. Это гарантирует безопасность как персонала, так и окружающей среды.
Работа лаборатории регламентирована следующими документами: Приложением №9 «Стандарт оснащения клинико-диагностической лаборатории» к Приказу Министерства здравоохранения и социального развития РФ от 16 марта 2010 г. №151н «Об утверждении порядка оказания медицинской помощи больным дерматовенерологического профиля и больных лепрой» (редакция от 29 сентября 2011 г.); Приказом Министерства здравоохранения РФ от 25.12.1997 г. №380 «О состоянии и мерах по совершенствованию лабораторного обеспечения диагностики и лечения пациентов в учреждениях здравоохранения РФ».
Где открывать лабораторию
Бактериологическая лаборатория — это подразделение клинико-диагностической лаборатории (КДЛ). Работает на базе инфекционных больниц, стационаров (кожно-венерологических, туберкулёзных и пр.), больниц общего профиля.
Допускается организовать лабораторию либо в изолированной части учреждения, либо как автономный объект.
Общие требования к помещению
Вот ключевые требования, которые предъявляются к лаборатории.
Под неё отводят просторные, светлые помещения с выходящими на северную или северно-западную сторону окнами. Это объясняется тем, что лабораторные исследования лучше проводить при рассеянном свете.
Для покрытия пола подходит линолеум, стен — светлая масляная маска (красят стены на высоту 170 см).
Столы покрывают материалами, устойчивыми к дезинфицирующим средствам. Например, пластиком или стеклом.
В помещении обязательно проводят канализацию, горячее и холодное водоснабжение, отопление, вентиляцию и электричество. Также устанавливают раковины для мытья рук и посуды.
Также проводят сигнализацию, а на оконные проёмы ставят решётки.
Зонирование лаборатории
Помещение имеет две зоны. Первая — «чистая». Под неё выделяют несколько помещений:
Вторая зона — «заразная». Сотрудники работают с разными материалами, в том числе и заразными. Поэтому помещение, в котором ведутся такие работы, обязательно изолируют от остальных. Под эту зону выделяют такие помещения:
В лаборатории должно быть 2 входа для сотрудников.
Организация работы в асептических условиях
Чтобы гарантировать безопасность и исключить заражение и утечку патогенных микроорганизмов, в одном из помещений оборудуют застеклённый бокс. Здесь ставят лабораторный стол, табурет, бактерицидные лампы.
Бокс ограждают предбоксником, в котором устанавливают шкаф для хранения стерильных материалов.
Необходимое оборудование
Бактериологическую лабораторию оснащают таким оборудованием:
Данное оборудование позволит проводить полный комплекс исследований и предоставлять достоверные результаты.
Оснащение мебелью
Устанавливают специальную мебель, разработанную для лабораторий. Она отвечает потребностям сотрудников.
Предъявляются высокие требования к организации рабочего места лаборанта. Каждый сотрудник имеет персональное рабочее место. Столы ставят возле окна — это лучшее место для них. Причём нужно, чтобы свет падал слева или спереди. Недопустимо, чтобы свет падал из-за спины сотрудника. Столы должны быть освещены на 500 лк.
Площадь одного рабочего места — 150х60 см. Каждое из них оснащают инвентарём, который нужен сотрудникам ежедневно:
Также на рабочем месте ставят микроскопы и штативы.
Безопасность работников
Сотрудники исследуют очень опасные инфекции, поэтому так важно защитить их и окружающую среду. Для этого достаточно придерживаться ряда правил:
В зависимости от характера работы и возбудителей, подбирают костюмы и боксы определённого класса защиты.
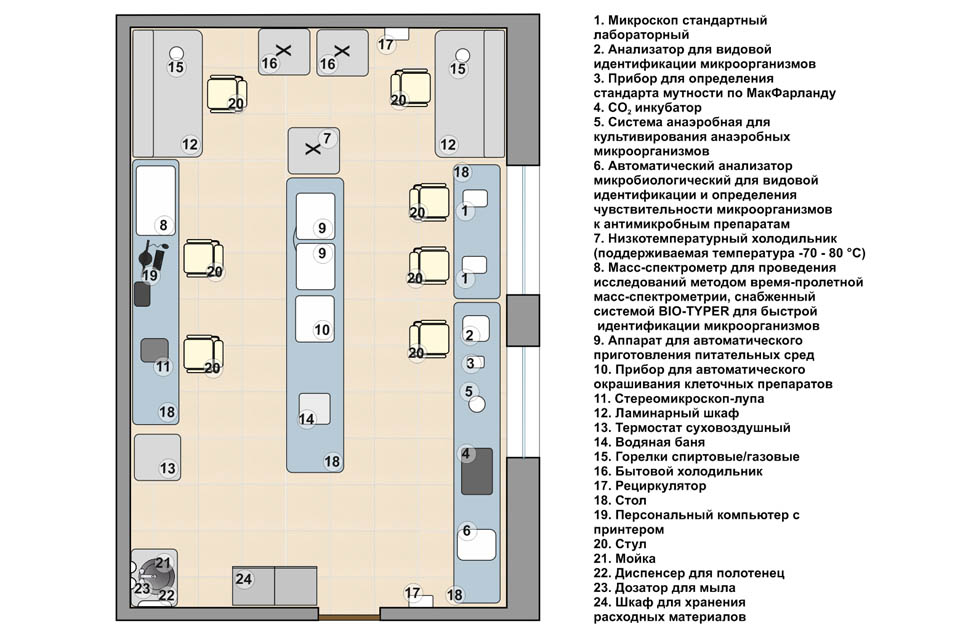
МИКРОБИОЛОГИЧЕСКИЕ ЛАБОРАТОРИИ И ИХ ОБОРУДОВАНИЕ



Введение
Все микробиологические, биохимические и моле-кулярно-биологические исследования микроорганизмов проводят в специальных лабораториях, структура и оборудование которых зависят от объектов исследования (бактерий, вирусов, грибов, простейших), а также от их целевой направленности (научные исследования, диагностика заболеваний). Изучение иммунного ответа и серодиагностика заболеваний человека и животных осуществляют в иммунологических и серологических (serum — сыворотка крови) лабораториях.
Бактериологические, вирусологические, микологические и серологические (иммунологические) лаборатории входят в состав санитарно-эпидемиологических станций (СЭС), диагностических центров и крупных больниц. В лабораториях СЭС выполняют бактериологические, вирусологические и серологические анализы материалов, полученных от больных и контактировавших с ними лиц, обследуют бактерионосителей и проводят санитарно-микробиологические исследования воды, воздуха, почвы, пищевых продуктов и т.д.
В бактериологических и серологических лабораториях больниц и диагностических центров проводят исследования с целью диагностики кишечных, гнойных, респираторных и других инфекционных заболеваний, осуществляют микробиологический контроль за стерилизацией и дезинфекцией.
Диагностику особо опасных инфекций (чума, туляремия, сибирская язва и др.) проводят в специальных режимных лабораториях, организация и порядок деятельности которых строго регламентированы.
В вирусологических лабораториях диагностируют заболевания, вызванные вирусами (грипп, гепатит, полиомиелит и др.), некоторыми бактериями — хламидиями (орнитоз и др.) и риккетсиями (сыпной тиф, Ку-лихорадка и др.). При организации и оборудовании вирусологических лабораторий учитывают специфику работы с вирусами, культурами клеток и куриными эмбрионами, требующую строжайшей асептики.
В микологических лабораториях проводят диагностику заболеваний, вызываемых патогенными грибами, возбудителями микозов.
Лаборатории обычно размещаются в нескольких помещениях, площадь которых определяется объемом работ и целевым назначением.
В каждой лаборатории предусмотрены:
а) боксы для работы с отдельными группами возбудителей;
б) помещения для серологических исследований;
в) помещения для мойки и стерилизации посуды, приготов
ления питательных сред;
г) виварий с боксами для здоровых и подопытных живот
ных;
д) регистратура для приема и выдачи анализов.
Наряду с этими помещениями в вирусологических лабораториях имеются боксы для специальной обработки исследуемого материала и работы с культурами клеток.
Оборудование микробиологических лабораторий
Лаборатории снабжены рядом обязательных приборов и аппаратов.
1. Приборы для микроскопии: биологический иммерсионный микроскоп с дополнительными приспособлениями (осветитель, фазово-контрастное устройство, темнопольный конденсор и др.), люминесцентный микроскоп.
2. Термостаты и холодильники.
3. Приборы для приготовления питательных сред, растворов и т.д.: аппарат для получения дистиллированной воды (дистиллятор), технические и аналитические весы, рН-метры, аппаратура для фильтрования, водяные бани, центрифуги.
4. Набор инструментов для манипуляций с микробами: бактериологические петли, шпатели, иглы, пинцеты и др.
5. Лабораторная посуда: пробирки, колбы, чашки Петри, матрацы, флаконы, ампулы, пастеровские и градуированные пипетки и др., аппарат для изготовления ватно-марлевых пробок.
Крупные диагностические комплексы имеют автоматические анализаторы и компьютеризированную систему оценки полученной информации.
В лаборатории выделено место для окраски микроскопических препаратов, где находятся растворы специальных красителей, спирт, кислоты, фильтровальная бумага и др. Каждое рабочее место снабжено газовой горелкой или спиртовкой и емкостью с дезинфицирующим раствором. Для повседневной работы лаборатория должна располагать необходимыми питательными средами, химическими реактивами, диагностическими препаратами и другими материалами.
В крупных лабораториях имеются термостатные комнаты для массового выращивания микроорганизмов, постановки серологических реакций. Для выращивания, хранения культур, стерилизации лабораторной посуды и других целей используют следующую аппаратуру.
1. Термостат. Аппарат, в котором поддерживается постоянная температура. Оптимальная температура для размножения большинства патогенных микроорганизмов 37 «С. Термостаты бывают воздушными и водяными.
2. Микроанаэростат. Аппарат для выращивания микроорганизмов в анаэробных условиях.
4. Холодильники. Используют в микробиологических лабораториях для хранения культур микроорганизмов, питательных сред, крови, вакцин, сывороток и прочих биологически активных препаратов при температуре около 4 °С. Для хранения препаратов при температуре ниже О °С применяют низкотемпературные холодильники, в которых поддерживается температура —20 °С или —75 «С.
5. Центрифуги. Применяют для осаждения микроорганизмов, эритроцитов и других клеток, для разделения неоднородных жидкостей (эмульсии, суспензии). В лабораториях используют центрифуги с различными режимами работы.
6. Сушилъно-стерилизационный шкаф (печь Пастера). Предназначен для суховоздушной стерилизации стеклянной лабораторной посуды и других жаростойких материалов.
7. Стерилизатор паровой (автоклав). Предназначен для стерилизации перегретым водяным паром (под давлением). В микробиологических лабораториях используют автоклавы разных моделей (вертикальные, горизонтальные, стационарные, переносные).
БАКТЕРИОЛОГИЧЕСКИЕ, ВИРУСОЛОГИЧЕСКИЕ, МИКОЛОГИЧЕСКИЕ, ИММУНОЛОГИЧЕСКИЕ ЛАБОРАТОРИИ И ИХ ОБОРУДОВАНИЕ. УСТРОЙСТВО СОВРЕМЕННЫХ МИКРОСКОПОВ. МЕТОДЫ МИКРОСКОПИИ. МЕТОДЫ ИЗУЧЕНИЯ МОРФОЛОГИИ МИКРООРГАНИЗМОВ
1. Правила работы и организация микробиологических (бактериологических, вирусологических, микологических) лабораторий.
2. Основные приборы и оборудование микробиологической лаборатории.
3. Микроскопы и микроскопическая техника. Правила работы с иммерсионным микроскопом (объективами).
Демонстрация
1. Устройство и применение основных приборов и оборудования, используемого в микробиологических лабораториях: термостата, центрифуг, автоклава, сушильного шкафа, инструментария и посуды.
2. Устройство биологического микроскопа. Различные методы микроскопии: темнопольная, фазово-контрастная, люминесцентная, электронная.
3. Препараты микробов (дрожжей и бактерий) при различных методах микроскопии.
1. Микроскопировать и зарисовать препараты дрожже-подобных грибов рода Candida, используя различные виды микроскопии.
Методические указания
Правила работы в микробиологических лабораториях.
Работу в микробиологической лаборатории медицинского учреждения проводят с возбудителями инфекционных заболеваний — патогенными микроорганизмами.
Поэтому для предохранения от заражения персонал обязан строго соблюдать правила внутреннего распорядка:
1. Все сотрудники должны работать в медицинских халатах, шапочках и сменной обуви. Вход в лабораторию без халата категорически воспрещен. В необходимых случаях работающие надевают на лицо маску из марли. Работа с особо опасными микробами регламентируется специальной инструкцией и проводится в режимных лабораториях.
2. В лаборатории запрещается курить и принимать пищу.
3. Рабочее место должно содержаться в образцовом порядке. Личные вещи сотрудников следует хранить в специально отведенном месте.
4. При случайном попадании инфицированного материала на стол, пол и другие поверхности это место необходимо тщательно обработать дезинфицирующим раствором.
5. Хранение, наблюдение за культурами микробов и их уничтожение должны производиться согласно специальной инструкции. Культуры патогенных микробов регистрируют в специальном журнале.
6. По окончании работы руки следует тщательно вымыть, а при необходимости обработать дезинфицирующим раствором.
Микроскопы и методы микроскопии
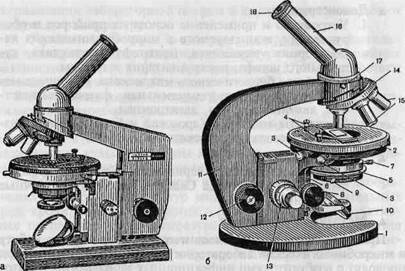
а — общий вид микроскопа «Биолам»; б — микроскоп МБР-1: 1 — основание микроскопа; 2 — предметный столик; 3 — винты для перемещения предметного столика; 4 — клеммы, прижимающие препарат; 5 — конденсор; 6 — кронштейн конденсора; 7 — винт, укрепляющий конденсор в гильзе; 8 — рукоятка перемещения конденсора; 9 — рукоятка ирисовой диафрагмы конденсора; 10 — зеркало; 11 — тубусодержатель; 12 — рукоятка макрометричес-кого винта; 13 — рукоятка микрометрического винта; 14 — револьвер объективов; 15 — объективы; 16 — наклонный тубус; 17 — винт для крепления тубуса; 18 — окуляр.
Для микробиологических исследований используют несколько типов микроскопов (биологический, люминесцентный, электронный) и специальные методы микроскопии (фа-зово-контрастный, темнопольный).
В микробиологической практике применяют микроскопы отечественных марок: МБР-1, МБИ-2, МБИ-3, МБИ-6, «Биолам» Р-1 и др. (рис. 1.1). Они предназначены для изучения формы, структуры, размеров и других признаков различных микробов, величина которых не менее 0,2—0,3 мкм.
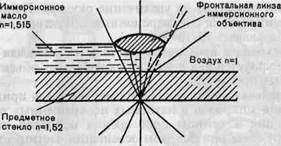
Иммерсионная микроскопия
Применяется для увеличения разрешающей способности метода световой микроскопии. Разрешающая способность системы светооптической микроскопии определяется длиной волны видимого света и числовой апертурой системы. Числовая апертура показывает величину угла максимального конуса света, попадающего в объектив, и зависит от оптических свойств (преломляющей способности) среды между объектом и линзой объектива. Погружение объектива в среду (минеральное масло, вода), имеющую высокий коэффициент преломления, близкий к таковому стекла, препятствует рассеянию света от объекта.
Рис. 1.2. Ход лучей в иммерсионной системе, п — показатель преломления.
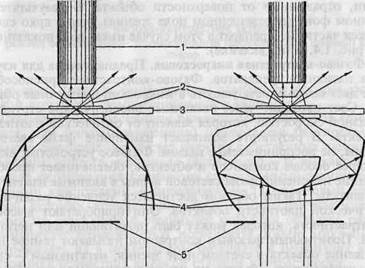
Рис. 1.3. Ход лучей в темнопольных конденсорах, а — параболоид-конденсор; б — кардиоид-конденсор; 1 — объектив; 2 — иммерсионное масло; 3 — препарат; 4 — зеркальная поверхность; 5 — диафрагма.
Таким образом достигается увеличение числовой апертуры и соответственно разрешающей способности. Для иммерсионной микроскопии применяют специальные иммерсионные объективы, снабженные меткой (МИ — масляная иммерсия, ВИ — водная иммерсия). Предельная разрешающая способность иммерсионного микроскопа не превышает 0,2 мкм. Ход лучей в иммерсионной системе показан на рис. 1.2.
Общее увеличение микроскопа определяется произведением увеличения объектива на увеличение окуляра. Например, увеличение микроскопа с иммерсионным объективом 90 и окуляром 10 составляет: 90 x 10 = 900.
Микроскопия в проходящем свете (светлопольная микроскопия) используется для изучения окрашенных объектов в фиксированных препаратах.
Темнопольная микроскопия. Применяется для прижизненного изучения микробов в нативных неокрашенных препаратах. Микроскопия в темном поле зрения основана на явлении дифракции света при боковом освещении частиц, взвешенных в жидкости (эффект Тиндаля). Эффект достигается с помощью параболоид- или кардиоид-конденсора, которые заменяют обычный конденсор в биологическом микроскопе (рис. 1.3). При этом способе освещения в объектив попадают только лучи, отраженные от поверхности объекта. В результате на темном фоне (неосвещенном поле зрения) видны ярко светящиеся частицы. Препарат в этом случае имеет вид, показанный на рис. 1.4, б (на вклейке).
Фазово-контрастная микроскопия. Предназначена для изучения нативных препаратов. Фазово-контрастное приспособление дает возможность увидеть в микроскоп прозрачные объекты. Свет проходит через различные биологические структуры с разной скоростью, которая зависит от оптической плотности объекта. В результате возникает изменение фазы световой волны, не воспринимаемое глазом. Фазовое устройство, включающее особые конденсор и объектив, обеспечивает преобразование изменений фазы световой волны в видимые изменения амплитуды. Таким образом достигается усиление различия в оптической плотности объектов. Они приобретают высокую контрастность, которая может быть позитивной или негативной. Позитивным фазовым контрастом называют темное изображение объекта в светлом поле зрения, негативным — светлое изображение объекта на темном фоне (см. рис. 1.4; на вклейке).
Для фазово-контрастной микроскопии используют обычный микроскоп и дополнительное фазово-контрастное устройство КФ-1 или КФ-4 (рис. 1.5), а также специальные осветители.
Люминесцентная (или флюоресцентная) микроскопия. Основана на явлении фотолюминесценции.
Люминесценция — свечение веществ, возникающее под воздействием внешнего излучения: светового, ультрафиолетового, ионизирующего и др. Фотолюминесценция — люминесценция объекта под влиянием света. Если освещать люминес-цирующий объект синим светом, то он испускает лучи красного, оранжевого, желтого или зеленого цвета. В результате возникает цветное изображение объекта.
Рис. 1.5. Фазово-контрастное устройство, а — фазовые объективы; б — вспомогательный микроскоп; в — фазовый конденсор.
Длина волны излучаемого света (цвет люминесценции) зависит от физико-химической структуры люминесцирующего вещества.
Первичная люминесценция биологических объектов (собственная, или биолюминесценция) наблюдается без предварительного окрашивания за счет наличия собственных люминес-цирующих веществ, вторичная (наведенная) — возникает в результате окрашивания препаратов специальными люминесци-рующими красителями — флюорохромами (акридиновый оранжевый, ауромин, корифосфин и др.). Люминесцентная микроскопия по сравнению с обычными методами обладает рядом преимуществ: возможностью исследовать живые микробы и обнаруживать их в исследуемом материале в небольших концентрациях вследствие высокой степени контрастности.
В лабораторной практике люминесцентную микроскопию широко применяют для выявления и изучения многих микробов.
Электронная микроскопия. Позволяет наблюдать объекты, размеры которых лежат за пределами разрешающей способности светового микроскопа (0,2 мкм). Электронный микроскоп применяют для изучения вирусов, тонкого строения различных микроорганизмов, макромолекулярных структур и других субмикроскопических объектов. Световые лучи в таких микроскопах заменяет поток электронов, имеющий при определенных ускорениях длину волны около 0,005 нм, т.е. почти в 100 000 раз меньше длины волны видимого света. Высокая разрешающая способность электронного микроскопа, достигающая 0,1-0,2 нм, позволяет получить общее полезное увеличение до 1 000 000.
Наряду с приборами «просвечивающего» типа используют сканирующие электронные микроскопы, обеспечивающие рельефное изображение поверхности объекта. Разрешающая способность этих приборов значительно ниже, чем у электронных микроскопов «просвечивающего» типа.
Правила работы с микроскопом
Работа с любым световым микроскопом включает установку правильного освещения поля зрения и препарата и его микроскопию различными объективами. Освещение может быть естественным (дневным) или искусственным, для чего используют специальные источники света — осветители разных марок.
При микроскопии препаратов с иммерсионным объективом следует строго придерживаться определенного порядка:
1) на приготовленный на предметном стекле и окрашенный мазок нанести каплю иммерсионного масла и поместить его на предметный столик, укрепив зажимами;
2) повернуть револьвер до отметки иммерсионного объектива 90х или 10Ох;
3) осторожно опустить тубус микроскопа до погружения объектива в каплю масла;
4) установить ориентировочный фокус при помощи макрометрического винта;
5) провести окончательную фокусировку препарата микро метрическим винтом, вращая его в пределах только одного оборота. Нельзя допускать соприкосновения объектива с пре
паратом, так как это может повлечь поломку покровного стекла или фронтальной линзы объектива (свободное расстояние иммерсионного объектива 0,1—1 мм).
По окончании работы микроскопа необходимо удалить масло с иммерсионного объектива и перевести револьвер на малый объектив 8х.
Для темнопольной и фазово-контрастной микроскопии используют нативные препараты («раздавленная» капля и др., см. тему 2.1); микроскопируют с объективом 40х или специальным иммерсионным объективом с ирис-диафрагмой, позволяющей регулировать численную апертуру от 1,25 до 0,85. Толщина предметных стекол не должна превышать 1 — 1,5 мм, покровных — 0,15—0,2 мм.