Что такое матрикс кожи
Внеклеточный матрикс и его компоненты.
Внеклеточный матрикс (ВМК, англ. extracellular matrix, ECM) — внеклеточные структуры ткани (интерстициальный матрикс и базальные мембраны). Многокомпонентная субстанция, в которую погружены все клетки нашего организма. В последнее десятилетие интерес к внеклеточному матриксу значительно возрос. Это связано с установлением его роли в старении, клеточной дифференцировке, успешной терапии рака и лечении некоторых наследственных заболеваний.
Компоненты ВКМ синтезируют специализированные клетки. В соединительной ткани наиболее распространены фибробласты, но формировать ВКМ умеют и другие клетки: в хрящах, это хондроциты, а в костях — остеобласты. Компоненты матрикса могут синтезировать и клетки прилегающих органов: например, клетки эпителия сосудов производят компоненты рыхлой соединительной ткани.
Разрушители ВКМ. Порядок в ВКМ наводят белки — разрушители его компонентов. Наиболее важные из них, металлопротеиназы, «расчищают путь» клеткам, которые движутся в ВКМ, и уничтожают старые и «сломанные» компоненты матрикса.
Основное вещество ВКМ. Основу матрикса формируют гиалуроновая кислота и особые белки: гликопротеины и протеогликаны. В состав ВКМ входит и множество других белков со специфической функциональной нагрузкой.
В гликопротеинах доля углеводов не превышает 20%, углеводные цепи короткие, имеют нерегулярное строение и не содержат уроновых кислот. Это структурные белки, как коллаген и эластин. За счет самого распространенного структурного белка в организме — коллагена — ВКМ приобретает прочность, а за счет эластина — гибкость и эластичность.
Протеогликаны — сложные белки с высокой степенью гликозилирования, часто имеющие в своем составе уроновые кислоты. 90–95% массы такой молекулы составляют длинные углеводные цепи регулярного строения, а на белки приходится лишь 5–10%. Такое строение обуславливает высокую молекулярную массу протеогликанов. Протеогликаны запасают воду и полезные вещества. Выполняют функцию наполнителя (основного вещества). Благодаря полярной природе и сильному отрицательному заряду, они связывают катионы и основную часть воды. Играют роль межтканевых прослоек и смазочного материала в суставах.
Интегрины — трансмембранные клеточные рецепторы, которые взаимодействуют с матриксом и участвуют в межклеточной коммуникации. Благодаря этим контактам в клетках активируются сигнальные каскады, регулирующие экспрессию генов, отвечающие за пролиферацию и дифференцировку клеток, их выживание или апоптоз.
Межклеточный матрикс выполняет разнообразные функции:
Межклеточный матрикс имеет различные составные вариации и выполняет множество функций.
Базальная мембрана разделяет клетку и соединительную ткань (матрикс). Значит, практически все клетки вступают в контакт с матриксом напрямую. Базальная мембрана сформирована ламинином (светлая пластинка) и коллагеном 4 типа (темная пластинка), они объединены белком нидогеном (энтактином), из этих компонентов создана пространственная структура, обеспечены механическая поддержка и защита клеток.
Фибронектин – белок клеточной адгезии, гликопротеин, также отвечающий за структуру ткани, может формировать мультимерные цепочки. Участвует в адгезии, то есть сцеплении клеток. Они помогают клеткам закрепляться на поверхностях и отвечают за их рост и перемещение в ВКМ.
Также в базальной мембране содержатся молекулы протеина перлекана, занимающегося поддержкой физиологического (эндотелиального) барьера между кровеносной системой и центральной нервной системой. Участвует в нейромышечном соединении, отвечая за доставку нервных импульсов к мышечным клеткам. Обеспечивает защиту нервной ткани от находящихся в крови микроорганизмов, токсинов, клеточных и гуморальных факторов иммунной системы, которые воспринимают нервную ткань как чужеродную.
Далее располагается межклеточный матрикс или соединительная ткань. Его составляющие:
Эластин формирует трехмерную сеть белковых волокон. Она обеспечивает механическую прочность ткани, обеспечивает контакты между клетками, формирует пути миграции клеток, вдоль которых они могут перемещаться, изолирует разные клетки и ткани друг от друга.
Гиалуроновая кислота (ГК) синтезируется встроенными в мембрану белками и затем «выдавливается» через нее в межклеточное пространство. ГК помогает интегринам проводить сигналы в клетку, регулирует клеточный ответ на эти сигналы и дает клеткам возможность закрепляться на различных поверхностях. Она участвует в регенерации ткани. Содержится во многих биологических жидкостях, в том числе синовиальной, отвечает за вязкость соединительной ткани. В связке с аггреканом формирует устойчивость к компрессии. Это основной компонент биологической смазки и суставного хряща, в котором присутствует в виде оболочки каждой клетки (хондроцита).
Телефоны Учебного центра «Олта»: 8-812-248-99-34, 8-812-248-99-38, 8-812-243-91-63, 8-929-105-68-44
Что такое матрикс кожи
Анатомия и физиология кожи
Кожа – наш самый большой орган, составляющий 15% от общей массы тела. Она выполняет множество функций, прежде всего защищает организм от воздействия внешних факторов физической, химической и биологической природы, от потери воды, участвует в терморегуляции. Последние научные данные подтверждают, что кожа не только обладает собственной иммунной системой, но и сама является периферическим иммунном органом.
Структура кожи
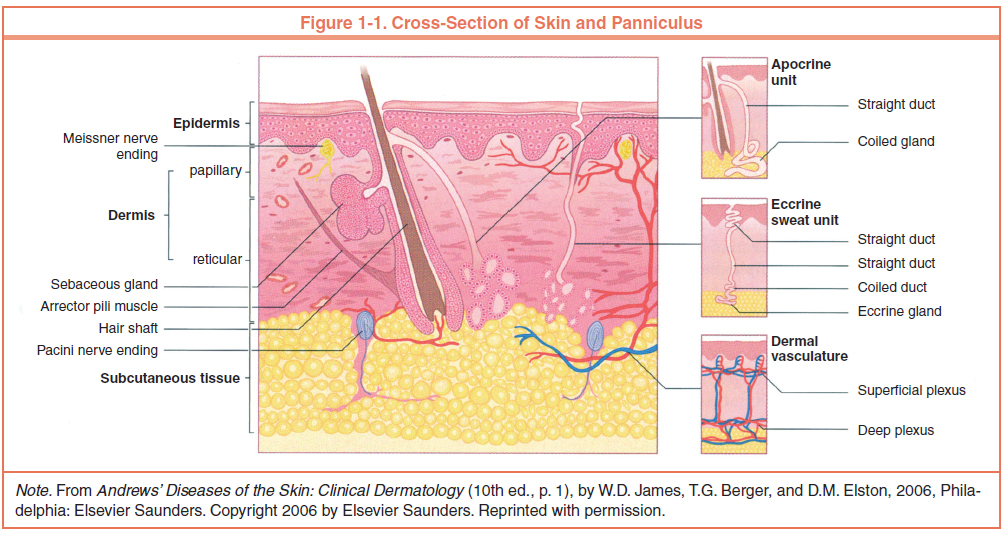
Кожа состоит из 3 слоев: эпидермиса, дермы и подкожной жировой клетчатки (ПЖК) (рис. 1). Эпидермис – самый тонкий из них, представляет собой многослойный ороговевающий эпителий. Дерма – средний слой кожи. Главным образом состоит из фибрилл структурного белка коллагена. ПЖК содержит жировые клетки – адипоциты. Толщина этих слоев может значительно варьировать в зависимости от анатомического места расположения.
Эпидермис
Кератинизация. По мере дифференцировки кератиноцитов и продвижения от базального слоя до рогового происходит их кератинизация (ороговевание) – процесс, начинающийся с фазы синтеза кератина кератиноцитами и заканчивающийся их клеточной деградацией. Кератин служит строительным блоком для промежуточных филаментов. Пучки из этих филаментов, достигая цитоплазматический мембраны, формируют десмосомы, необходимые для образования прочных контактов между соседними клетками. Далее, по мере процесса эпителиальной дифференцировки, клетки эпидермиса вступают в фазу деградации. Ядра и цитоплазматические органеллы разрушаются и исчезают, обмен веществ прекращается, и наступаетапоптозклетки, когда она полностью кератинизируется (превращается в роговую чешуйку).
Базальный слой эпидермиса состоит из одного ряда митотически активных кератиноцитов, которые делятся в среднем каждые 24 часа и дают начало новым клеткам новым клеткам вышележащих эпидермальных слоев. Они активируются только в особых случаях, например при возникновении раны. Далее новая клетка, кератиноцит, выталкивается в шиповатый слой, в котором она проводит до 2 недель, постепенно приближаясь к гранулярному слою. Движение клетки до рогового слоя занимает еще 14 дней. Таким образом, время жизни кератиноцита составляет около 28 дней.
Надо заметить, что не все клетки базального слоя делятся с такой скоростью, как кератиноциты. Эпидермальные стволовые клетки в нормальных условиях образуют долгоживущую популяцию с медленным циклом пролиферации.
Шиповатый слой эпидермиса состоит из 5-10 слоев кератиноцитов, различающихся формой, структурой и внутриклеточным содержимым, что определяется положением клетки. Так, ближе к базальному слою, клетки имеют полиэдрическую форму и круглое ядро, но по мере приближения клеток к гранулярному слою они становятся крупнее, приобретают более плоскую форму, в них появляются ламеллярные гранулы, в избытке содержащие различные гидролитические ферменты. Клетки интенсивно синтезируют кератиновые нити, которые, собираясь в промежуточные филаменты, остаются не связанными со стороны ядра, но участвуют в образовании множественных десмосом со стороны мембраны, формируя связи с соседними клетками. Присутствие большого количества десмосом придает этому слою колючий вид, за что он и получил название «шиповатый».
Зернистый слой эпидермиса составляют еще живые кератиноциты, отличающиеся своей уплощенной формой и большим количеством кератогиалиновых гранул. Последние отвечают за синтез и модификацию белков, участвующих в кератинизации. Гранулярный слой является самым кератогенным слоем эпидермиса. Кроме кератогиалиновых гранул кератиноциты этого слоя содержат в большом количестве лизосомальные гранулы. Их ферменты расщепляют клеточные органеллы в процессе перехода кератиноцита в фазу терминальной дифференцировки и последующего апоптоза. Толщина гранулярного слоя может варьировать, ее величина, пропорциональная толщине вышележащего рогового слоя, максимальна в коже ладоней и подошв стоп.
Блестящий слой эпидермиса (назван так за особый блеск при просмотре препаратов кожи на световом микроскопе) тонкий, состоит из плоских кератиноцитов, в которых полностью разрушены ядра и органеллы. Клетки наполнены элейдином – промежуточной формой кератина. Хорошо развит лишь на некоторых участках тела – на ладонях и подошвах.
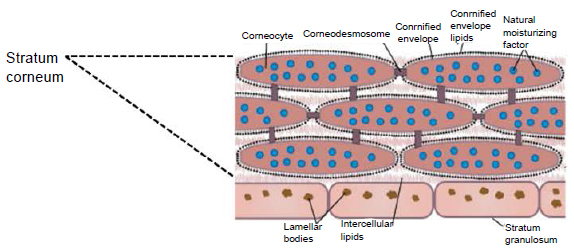
Роговой слой эпидермиса представлен корнеоцитами (мертвыми, терминально-дифференцированными кератиноцитами) с высоким содержанием белка. Клетки окружены водонепроницаемым липидным матриксом, компоненты которого содержат соединения, необходимые для отшелушивания рогового слоя (рис. 3). Физические и биохимические свойства клеток в роговом слое различаются в зависимости от положения клетки внутри слоя, направляя процесс отшелушивания наружу. Например, клетки в средних слоях рогового слоя обладают более сильными водосвязывающими свойствами за счет высокой концентрации свободных аминокислот в их цитоплазме.
Дерма
Дерма представляет собой сложноорганизованную рыхлую соединительную ткань, состоящую из отдельных волокон, клеток, сети сосудов и нервных окончаний, а также эпидермальных выростов, окружающих волосяные фолликулы и сальные железы. Клеточные элементы дермы представлены фибробластами, макрофагами и тучными клетками. Лимфоциты, лейкоциты и другие клетки способны мигрировать в дерму в ответ на различные стимулы.
Дерма, составляя основной объем кожи, выполняет преимущественно трофическую и опорную функции, обеспечивая коже такие механические свойства, как пластичность, эластичность и прочность, необходимые ей для защиты внутренних органов тела от механических повреждений. Также дерма удерживает воду, участвует в терморегуляции и содержит механорецепторы. И, наконец, ее взаимодействие с эпидермисом поддерживает нормальное функционирование этих слоев кожи.
В дерме нет такого направленного и структурированного процесса клеточной дифференцировки, как в эпидермисе, тем не менее в ней также прослеживается четкая структурная организация элементов в зависимости от глубины их залегания. И клетки, и внеклеточный матрикс дермы также подвергаются постоянному обновлению и ремоделированию.
Коллаген – один из главных компонентов ВКМ дермы. Синтезируется фибробластами. Процесс его биосинтеза сложный и многоступенчатый, в результате которого фибробласт секретирует в экстрацеллюлярное пространство проколлаген, состоящий из трех полипептидных α-цепей, свернутых в одну тройную спираль. Затем мономеры проколлагена ферментивным путем собираются в протяженные фибриллярные структуры различного типа. Всего в коже не менее 15 типов коллагена, в дерме больше всего I, III и V типов этого белка: 88, 10 и 2% соответственно. Коллаген IV типа локализуется в зоне базальной мембраны, а коллаген VII типа, секретируемый кератиноцитами, играет роль адаптерного белка для закрепления фибрилл ВКМ на базальной мембране (рис. 4). Волокна структурных коллагенов I, III и V типов служат каркасом, к которому присоединяются другие белки ВКМ, в частности коллагены XII и XIV типов. Считается, что эти минорные коллагены, а также небольшие протеогликаны (декорин, фибромодулин и люмикан) регулируют формирование структурных коллагеновых волокон, их диаметр и плотность образуемой сети. Взаимодействие олигомерных и полимерных комплексов коллагена с другими белками, полисахаридами ВКМ, разнообразными факторами роста и цитокинами приводит к образованию особой сети, обладающей определенной биологической активностью, стабильностью и биофизическими характеристиками, важными для нормального функционирования кожи. В папиллярном слое дермы волокна коллагена располагаются рыхло и более свободно, тогда как ее ретикулярный слой содержит более крупные тяжи коллагеновых волокон.
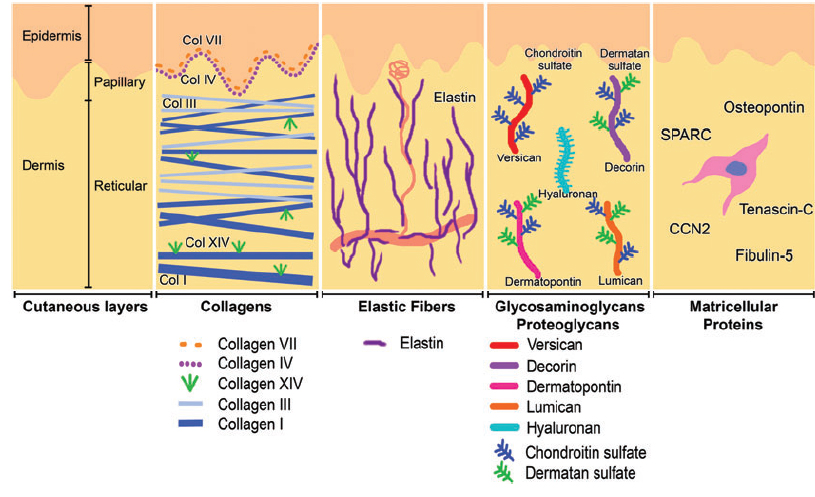
Коллаген постоянно обновляется, деградируя под действием протеолитических ферментов коллагеназ и замещаясь вновь синтезированными волокнами. Этот белок составляет 70% сухого веса кожи. Именно коллагеновые волокна «держат удар» при механическом воздействии на нее.
Эластин формирует еще одну сеть волокон в дерме, наделяя кожу такими качествами, как упругость и эластичность. По сравнению с коллагеном эластиновые волокна менее жесткие, они скручиваются вокруг коллагеновых волокон. Именно с эластиновыми волокнами связываются такие белки, как фибулины и фибриллины, с которыми, в свою очередь, связывается латентный TGF-β-связывающий белок (LTBP). Диссоциация этого комплекса приводит к высвобождению и к активации TGF-β, самого мощного из всех факторов роста. Он контролирует экспрессию, отложение и распределение коллагенов и других матриксных белков кожи. Таким образом, интактная сеть из волокон эластина служит депо для TGF-β.
ГК с легкостью образует вторичные водородные связи и внутри одной молекулы, и между соседними молекулами. В первом случае они обеспечивают формирование относительно жестких спиральных структур. Во втором – происходит ассоциация с другими молекулами ГК и неспецифическое взаимодействие с клеточными мембранами, что приводит к образованию сети из полимеров полисахаридов с включенными в нее фибробластами. На длинную молекулу ГК, как на нить, «усаживаются» более короткие молекулы протеогликанов (версикана, люмикана, декорина и др.), формируя агрегаты огромных размеров. Протяженные во всех направлениях, они создают каркас, внося вклад в стабилизацию белковой сети ВКМ и фиксируя фибробласты в определенном окружении матрикса. В совокупности все эти свойства ГК наделяют матрикс определенными химическими характеристиками – вязкостью, плотностью «ячеек» и стабильностью. Однако сеть ВКМ является динамической структурой, зависящей от состояния организма. Например, в условиях воспаления агрегаты ГК с протеогликанами диссоциируют, а образование новых агрегатов между вновь синтезированными молекулами ГК (обновляющимися каждые 3 дня) и протеогликанами блокируется. Это приводит к изменению пространственной структуры матрикса: увеличивается размер его ячеек, меняется распределение всех волокон, структура становится более рыхлой, клетки меняют свою форму и функциональную активность. Все это сказывается на состоянии кожи, приводя к снижению ее тонуса.
Помимо регуляции водного баланса и стабилизации ВКМ, ГК выполняет важную регуляторную роль в поддержании эпидермального и дермального гомеостаза. ГК активно регулирует динамические процессы в эпидермисе, включая пролиферацию и дифференцировку кератиноцитов, окислительный стресс и воспалительный ответ, поддержание эпидермального барьера и заживление раны. В дерме ГК также регулирует активность фибробластов и синтез коллагена. Ремоделируя матрикс, ГК управляет функционированием клеток в матриксе, влияя на их доступность для различных факторов роста и изменяя их функциональную активности. От действия ГК зависит миграция клеток и иммунный ответ в ткани. Таким образом, изменения в распределении, организации, молекулярном весе и метаболизме ГК имеют значимые физиологические последствия.
Фибробласты представляют собой основной тип клеточных элементов дермы. Именно эти клетки отвечают за продукцию ГК, коллагена, эластина, фибронектина и многих других белков межклеточного матрикса, необходимых для формирования соединительной ткани. Фибробласты в различных слоях дермы различаются и морфологически, и функционально. От глубины их залегания в дерме зависит не только количество синтезируемого ими коллагена, но и соотношение типов этого коллагена, например I и III типов, а также синтез коллагеназы: фибробласты более глубоких слоев дермы производят меньшее ее количество. Вообще, фибробласты – очень пластичные клетки, способные менять свои функции и физиологический ответ и даже дифференцироваться в другой тип клеток в зависимости от полученного стимула. В роли последнего могут выступать и сигнальные молекулы, синтезированные соседними клетками, и перестройка окружающего ВКМ.
Подкожно-жировая клетчатка
Программа омоложения и лифтинга кожи путем обновления экстрацеллюлярного матрикса
Татьяна Троценко, врач-дерматовенеролог, косметолог, ведущий эксперт-методист компании «Астрея» (Москва)
«Запечатывающий» ретиноловый крем-пилинг
В состав ретинолового крема-пилинга Retinol 5nRRT Sealing Set входят 5%-ный ретинол, ретинилпальмитат, глицирризин, пептидный комплекс, экстракт цветка кувшинки, витамин Е. Препарат обновляет состав межклеточного матрикса, сокращает количество атипичных клеток, восстанавливает гидролипидный баланс кожи, активизирует синтез эпидермальных липидов.
• Нанесите крем-пилинг на кожу и равномерно распределите его по лицу и шее. Оставьте на 6–8 часов.
Постпроцедурный уход с использованием концентрата GF Global Renewal (в течение 7–10 дней) помогает «повернуть» аутохтонные процессы воспаления и ранозаживления от аварийной стадии к физиологичной, не провоцируя при этом патологического рубцевания, инициировать собственные резервы тканевой репарации.
На этом этапе также важно применять солнцезащитный гель Heliocare SPF-90 с фотоиммунопротекторным действием и БАД Heliocare Pure White (Cantabria Labs, Испания) для регулирования окислительно-восстановительных реакций в клетках и опосредованного ингибирования меланогенеза.
Интенсивный курс: 4–6 процедур, проводимых 1 раз в 10–14 дней.
Поддерживающий курс: 2–4 процедуры, проводимые 1 раз в 1,5–2 месяца.
Грамотное проведение программы позволяет добиться видимых позитивных изменений – минимизации морщин, пятен и других признаков старения. Черты лица становятся более мягкими, а контур – более упругим и подтянутым.
Значительно повышаются эластичность и тургор кожи, выравниваются ее цвет и текстура, разглаживаются морщины. Кожа обновляется, выглядит более молодой и здоровой.
Что такое внеклеточный матрикс и почему его все изучают
Внеклеточный матрикс — неотъемлемая часть любой ткани.
Автор
Редакторы
Внеклеточный матрикс (ВКМ) — многокомпонентная субстанция, в которую погружены все клетки нашего организма. В последнее десятилетие интерес к внеклеточному матриксу значительно возрос. Это связано с установлением его роли в старении, клеточной дифференцировке, успешной терапии рака и лечении некоторых наследственных заболеваний. Мы подготовили цикл статей, в котором расскажем об организации внеклеточного матрикса, болезнях, связанных с его патологиями, роли ВКМ в старении и подходах к корректировке возрастных изменений.
В первой статье цикла мы рассказываем о компонентах и функциях внеклеточного матрикса, разбираемся, какую практическую пользу может принести его изучение, а также вкратце освещаем самые важные открытия в этой области, совершенные за последний год.
Редакция благодарит Татьяну Голубеву за экспертные консультации и комментарии при подготовке статьи.
Что такое внеклеточный матрикс?
Внеклеточный матрикс (ВКМ, extracellular matrix, ECM) объединяет разрозненные клетки в единый многоклеточный организм. ВКМ похож на государство, в котором живут граждане-клетки: он отвечает за благополучие клеток и управляет всеми аспектами их жизни — от питания и размножения до смерти. Для клеток ВКМ — это и квартира, и магазин, и интернет, и общественный транспорт.
ВКМ: основные игроки
Создатели ВКМ. Компоненты ВКМ синтезируют специализированные клетки. В соединительной ткани наиболее распространены фибробласты, однако создавать ВКМ умеют и другие клетки: в хрящах, например, это хондроциты, а в костях — остеобласты. Компоненты матрикса могут синтезировать и клетки прилегающих органов: например, клетки эпителия сосудов производят компоненты рыхлой соединительной ткани.
Разрушители ВКМ. Порядок в ВКМ наводят белки — разрушители его компонентов. Наиболее важные из них, металлопротеиназы, «расчищают путь» клеткам, которые движутся в ВКМ, и уничтожают старые и «сломанные» компоненты матрикса.
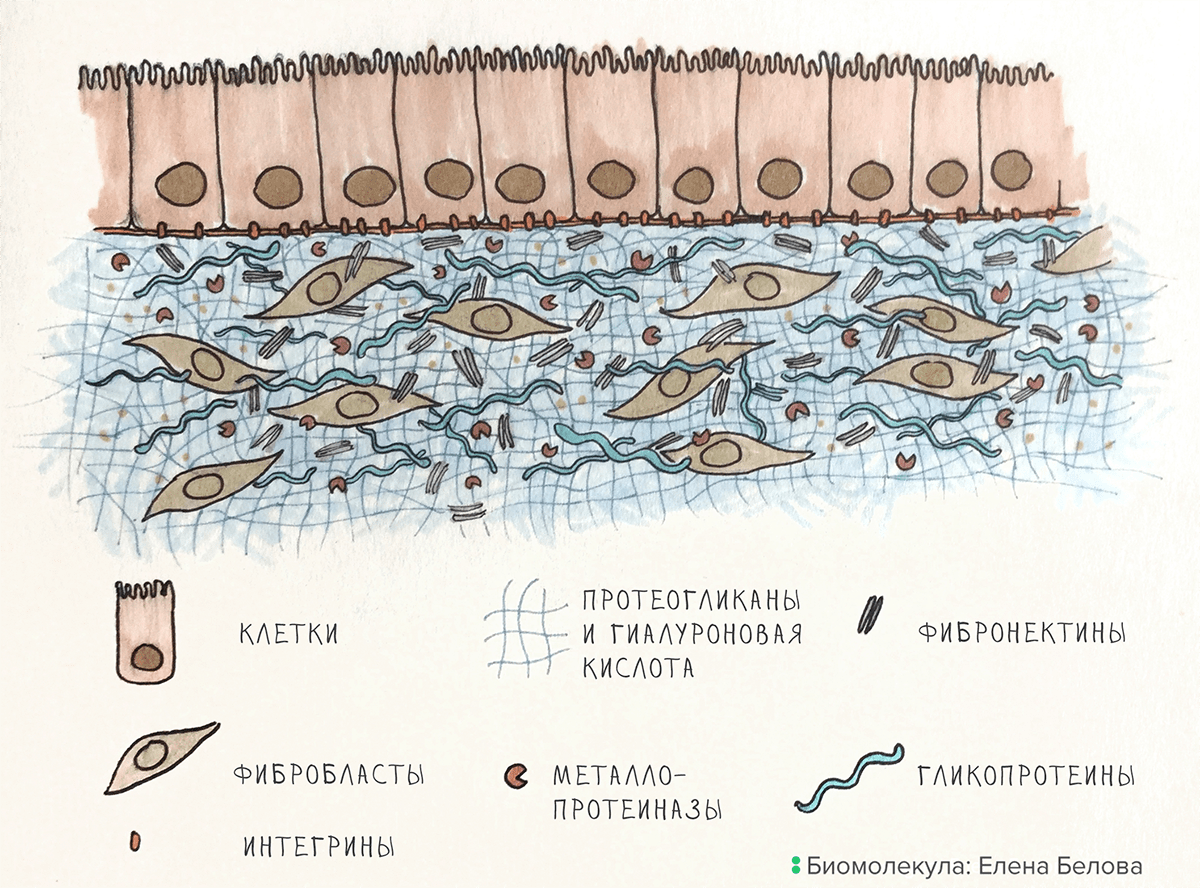
Основное вещество ВКМ. Основу матрикса формируют гиалуроновая кислота и особые белки: гликопротеины и протеогликаны (рис. 1). В состав ВКМ входит и множество других белков со специфической функциональной нагрузкой — интегрины, фибронектины, эластин, — о них мы поговорим в следующем разделе.
Тем, кто хочет узнать больше о построении и разрушении ВКМ, советуем почитать замечательный обзор на эту тему — «Кто рубит коллагеновый лес» [1].
Рисунок 1. Организация ВКМ на примере кожи. Фибробласты создают ВКМ, металлопротеиназы его разрушают. Клетки эпидермиса связаны с ВКМ при помощи интегринов.
Компоненты ВКМ
Выделяют два подкласса белков, содержащих углеводы, — протеогликаны и гликопротеины. Оба подкласса входят в состав ВКМ, однако между ними есть существенные различия.
В гликопротеинах доля углеводов не превышает 20%, углеводные цепи короткие, имеют нерегулярное строение и не содержат уроновых кислот.
К гликопротеинам относятся такие важные структурные белки, как коллаген и эластин. За счет самого распространенного структурного белка в организме — коллагена — ВКМ приобретает прочность, а за счет эластина — гибкость и эластичность.
Протеогликаны — сложные белки с высокой степенью гликозилирования, часто имеющие в своем составе уроновые кислоты. В отличие от гликопротеинов, около 90–95% массы такой молекулы составляют длинные углеводные цепи регулярного строения, а на белки приходится лишь 5–10%. Такое строение обуславливает высокую молекулярную массу протеогликанов. Например, у аггрекана, белка хрящевой ткани, она может достигать 5 МДа [2]! Протеогликаны запасают воду и полезные вещества, то есть работают как «магазин», из которого клетки получают необходимые «продукты». Например, они могут фиксировать ионы кальция в очагах оссификации. Кроме того, они играют роль межтканевых прослоек и смазочного материала в суставах.
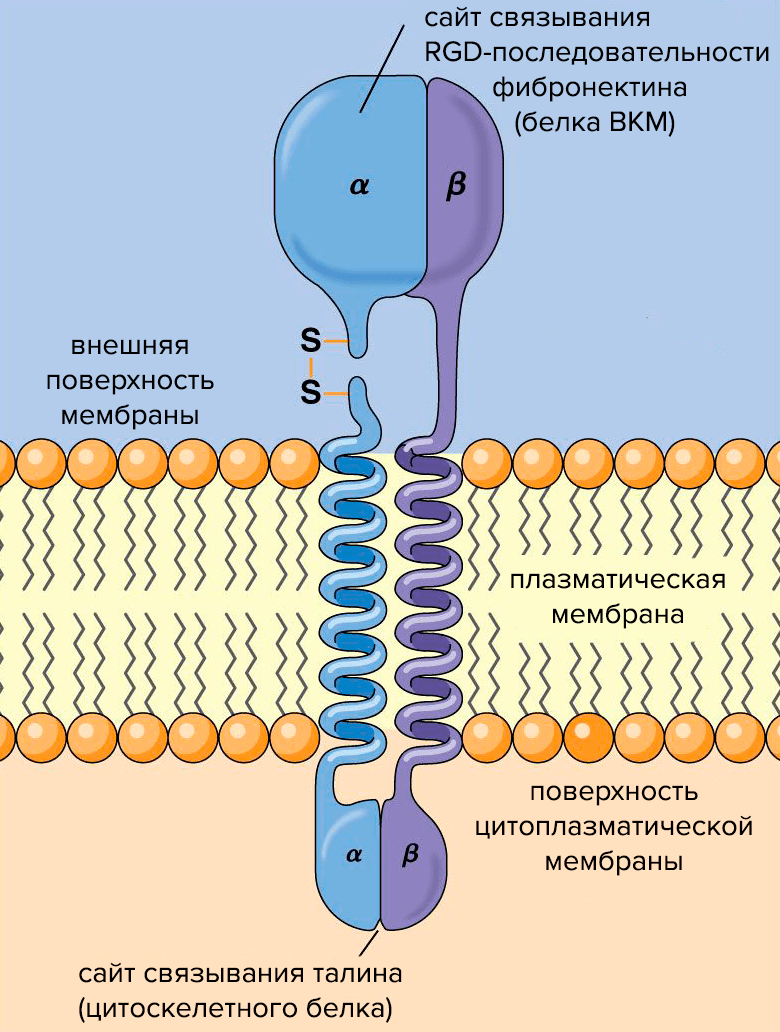
Рисунок 2. Схема строения молекулы интегрина. Субъединицы интегрина (α и β) пронизывают плазматическую мембрану, связывая клетку с внешней средой.
Интегрины — трансмембранные клеточные рецепторы, которые взаимодействуют с ВКМ и участвуют в межклеточной коммуникации. В результате этих взаимодействий в клетках активируются сигнальные каскады, регулирующие экспрессию генов, отвечающие за пролиферацию и дифференцировку клеток, их выживание или апоптоз. То есть система интегрины—ВКМ — нечто среднее между «интернетом» и «рабочим чатом».
Структурно интегрины представляют собой облигатные гетеродимеры: каждый состоит из одной α- и одной β-субъединицы (рис. 2). Альфа-субъединицы определяют специфичность интегрина к лиганду — молекуле, способной образовывать комплекс с интегрином и таким образом воздействовать на клетку. Бета-субъединицы связаны с компонентами цитоскелета и обеспечивают передачу сигнала в клетке. О работе интегринов подробно рассказано в статье «Клетки под давлением» [3].
Интегрины улавливают химические и физические сигналы из внеклеточного матрикса и проводят их в клетку. Сигнал от интегринов передается в ядро через белки цитоскелета и сигнальные белки — так ВКМ управляет экспрессией генов и регулирует клеточную пролиферацию. При посредничестве белков цитоскелета ВКМ также управляет формой и движениями клеток.
Фибронектины — это белки клеточной адгезии. Растворимые предшественники фибронектинов синтезируюся внутри клеток и затем попадают в ВКМ. Интегрины превращают фибронектины в нерастворимые нити — компоненты внеклеточного матрикса [4]. Они помогают клеткам закрепляться на поверхностях и отвечают за их рост и перемещение в ВКМ [5].
Гиалуроновая кислота (ГК) синтезируется встроенными в мембрану белками и затем «выдавливается» через нее в межклеточное пространство. По составу ГК похожа на углеводную часть протеогликана и представляет собой полимер из остатков D-глюкуроновой кислоты и D-N-ацетилглюкозамина. ГК помогает интегринам проводить сигналы в клетку, регулирует клеточный ответ на эти сигналы и, подобно фибронектину, дает клеткам возможность закрепляться на различных поверхностях [6]. Образно говоря, ГК выполняет задачи «интернет-провайдера» и «билета на общественный транспорт».
Почему так важно изучать внеклеточный матрикс?
Внеклеточный матрикс присутствует во всех тканях организма, поэтому сбои в его функционировании ведут к развитию болезней соединительной ткани, преждевременному старению и гибели клеток. Самый очевидный стимул для изучения ВКМ — необходимость лечения заболеваний, связанных с нарушениями структуры соединительной ткани. Таких болезней много, они могут протекать тяжело и значительно ухудшать качество жизни пациентов. Вот несколько примеров.
Мутации в генах, отвечающих за синтез структурных белков ВКМ, приводят к врожденным патологиям [7]. Поскольку соединительная ткань — основа всех систем организма, пострадать от генетических нарушений может любой орган. Такие нарушения приводят:
Преждевременное разрушение ВКМ — еще одна серьезная проблема. Здоровый внеклеточный матрикс постоянно обновляется и реструктурируется. За это отвечает семейство металлопротеиназ, белков — разрушителей ВКМ.
Металлопротеиназы — ферменты, в каталитический центр которых входят ионы металлов, в основном цинка. Отсюда и название с приставкой «металло-». Помимо каталитического центра, который отвечает за разрушение ВКМ, у металлопротеиназ есть регуляторный продомен, оберегающий фермент от преждевременной активации и ложного срабатывания.
Как именно металлопротеиназы разрушают коллаген и «отцепляют» клетки от волокон внеклеточного матрикса, рассказано в статье «Кто рубит коллагеновый лес» [1]. Сейчас же нам важно понять, что если металлопротеиназы «выходят из-под контроля», то они начинают буквально сметать всё на своем пути. Бесконтрольное разрушение ВКМ приводит к фиброзу и может вызвать рак [8] — например, рак предстательной железы [9].
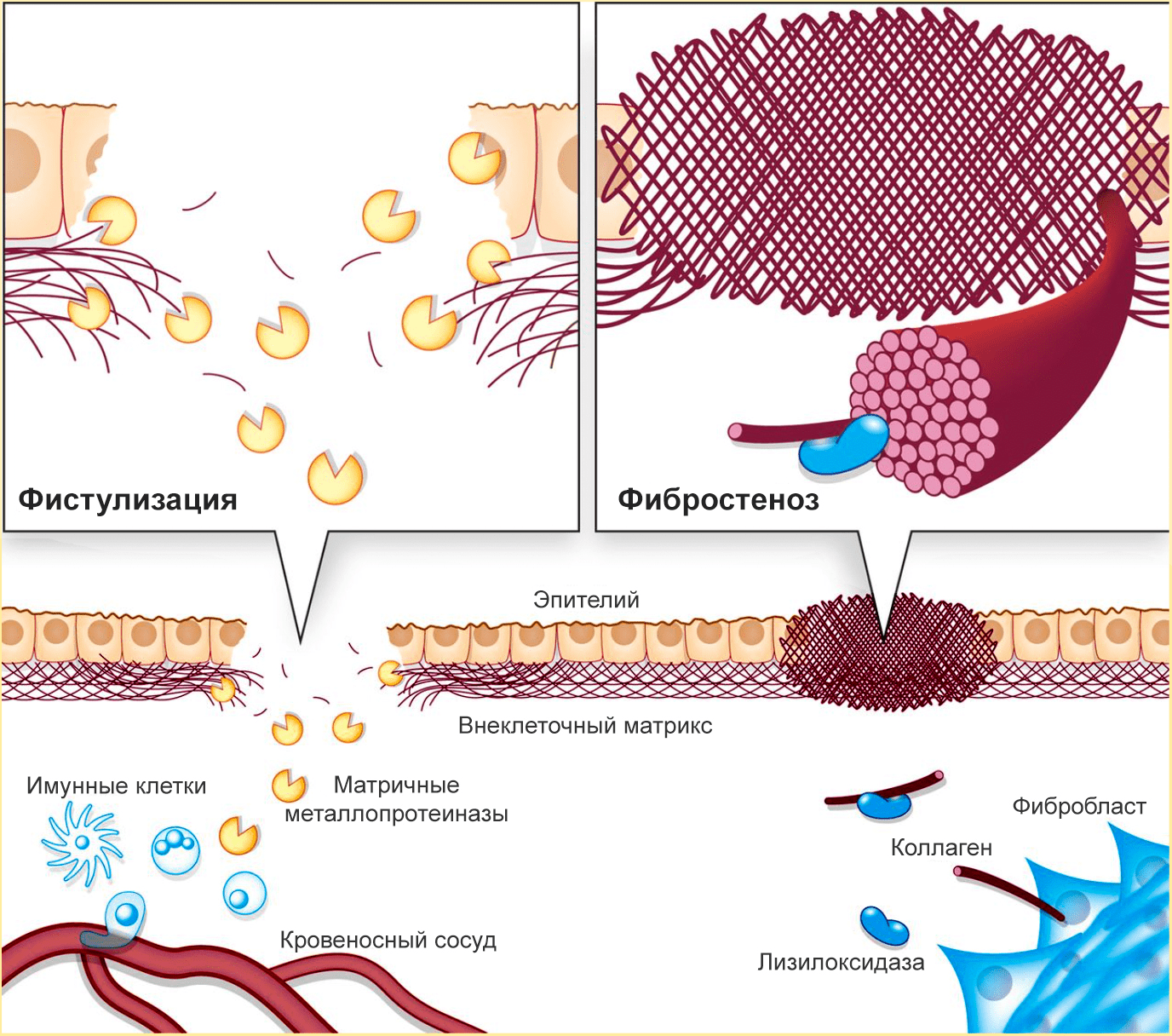
Еще одна патология, вызываемая нарушениями в процессах разрушения и формирования ВКМ, — болезнь Крона (хроническое воспаление кишечника) [10]. По мере ее развития возникает фистулизация и фибростеноз кишечника (рис. 3).
Рисунок 3. При болезни Крона происходит фистулизация и фибростеноз кишечника. Из-за избыточного разрушения ВКМ в кишечной стенке образуются отверстия, а из-за избыточного синтеза коллагена сужается просвет кишечника.
Фистулизация — образование отверстий в кишечной стенке. Этот процесс связан с неконтролируемой активностью металлопротеиназ, разрушающих коллаген слизистой оболочки кишечника. Так как целостность слизистой нарушается, иммунные клетки из кровеносных сосудов проникают в кишечную стенку — так развивается воспаление, а через некоторое время появляется отверстие в стенке кишечника.
Фибростеноз — сужение кишечника. Реагируя на повреждения, фибробласты интенсивно производят коллаген. Затем активируется лизилоксидаза — внеклеточный медьсодержащий фермент, катализирующий образование сложных поперечный связей в коллагене и эластине. Лизиолоксидаза необходима для формирования зрелых коллагеновых волокон, но при ее избытке начинаются проблемы. Этот фермент создает прочную коллагеновую сеть, «запечатывающую» поврежденные кишечные стенки, но из-за избыточной жесткости коллагеновых «печатей» фиброз только усиливается. В результате возникают воспаление и (иногда) непроходимость кишечника. Фистулизация усиливает фибростеноз: неуправляемое разрушение коллагена стимулирует его столь же неуправляемый синтез.
Избыточный синтез ВКМ часто говорит о том, что у человека рак и у этого рака плохой прогноз [11]. Кроме того, сам ВКМ может способствовать росту опухоли и распространению метастазов — это доказано для опухоли головного мозга. Особенно неприятно, что существующие методы лечения — например, лучевая терапия — способны заставить ВКМ послать клеткам сигнал, который может привести к рецидиву опухоли мозга [12].
Состав ВКМ головного мозга уникален: в нём очень много гиалуроновой кислоты и при этом гораздо меньше коллагена, фибронектина и других компонентов, характерных для ВКМ всех остальных тканей. Несмотря на важность ГК для нормальной работы тканей, в некоторых случаях она помогает проводить в клетки опухоли сигналы, делающие их более агрессивными. О том, как именно ГК «дразнит» раковые клетки, мы поговорим в разделе «Что нового мы узнали о внеклеточном матриксе за последний год?»
Лучевая терапия стимулирует работу мембранных белков HAS2, которые отвечают за синтез ГК. В результате они синтезируют больше гиалуроновой кислоты, а чем больше ГК, тем агрессивнее становятся опухолевые клетки. Получается, что лучевая терапия может стимулировать метастазирование опухоли. Таким образом, из-за особенностей ВКМ лучевая терапия помогает только на время: опухоль часто возвращается, становясь еще более опасной. Отчасти по этой причине некоторые виды опухолей мозга так плохо поддаются лечению.
Проблемы с ВКМ — важная причина старения
Первые признаки старения, которые сразу бросаются в глаза, — слабость, хрупкость костей, появление морщин и старческих пятен. Многие из этих проблем связаны с необратимыми изменениями во внеклеточном матриксе.
Одна из причин старения кожи — нарушение работы фибробластов (клеток, синтезирующих компоненты внеклеточного матрикса). При этом благополучие фибробластов зависит от состояния внеклеточного матрикса — получается замкнутый круг.
Рисунок 4. Микрофотография коллагеновых нитей в коже. а — «Целый» коллаген в молодой коже. б — Фрагментированный коллаген в стареющей коже. Стрелки указывают на старые, «разорванные» на кусочки нити коллагена.
Чтобы фибробласты хорошо себя чувствовали, им нужно цепляться за интактные, целые коллагеновые нити. Но со временем эти нити фрагментируются, и фибробластам становится не к чему крепиться, чтобы создать новый, целый коллаген (рис. 4) [13]. Если бы мы научились разрывать этот замкнутый круг, то нам, вполне возможно, больше никогда не понадобились бы антивозрастные услуги косметологов и пластических хирургов.
Старение костной ткани чаще всего связано с нарушением работы остеобластов. Эти клетки создают костный ВКМ, синтезируя коллаген и особые гликопротеины, которые участвуют в первом этапе минерализации коллагена. На втором этапе коллаген превращается в прочный внеклеточный матрикс — основу кости [14].
С течением лет старые остеобласты погибают, а новые делятся хуже и хуже. Оставшимся в живых стареющим клеткам становится всё сложнее справляться с созданием внеклеточного матрикса. Из-за этого кости у пожилых людей становятся очень хрупкими и плохо заживают после переломов.
Если бы мы могли заставить остеобласты делиться или хотя бы выяснили, как помочь им эффективнее минерализовать соединительную ткань, у пожилых людей появилась бы возмножность быстрее восстанавливаться после переломов. Такие работы уже ведутся!
В одной из подобных работ исследователи взяли коллагеновый гель, добавили к нему два неколлагеновых белка, ответственных за минерализацию коллагена (остеокальцин и остеопонтин), и создали на их основе искусственный внеклеточный матрикс. Этот исусственный ВКМ исследователи «предложили» остеобластам, полученным из стволовых клеток костного мозга. В результате активизировалось деление остеобластов, и эти остеобласты начали производить больше компонентов внеклеточного матрикса — правда, пока только в лабораторных условиях [14]. Чтобы искусственный ВКМ появился в кабинете травматолога и оказал содействие в восстановлении костей реальных пациентов, потребуется провести еще много исследований.
Что нового мы узнали о внеклеточном матриксе за последний год?
Над изучением ВКМ работают сотни исследовательских групп по всему миру, и каждый день появляется множество публикаций по этой теме. Давайте рассмотрим несколько свежих работ, чтобы получить представление о ключевых направлениях современных исследований. Вот что мы узнали о компонентах ВКМ в 2018 году.
Металлопротеиназы
Когда металлопротеиназы преждевременно разрушают эластин и коллаген легких, возникает соединительнотканное заболевание легких — эмфизема. Ученые давно стремились узнать, какой генетический компонент влияет на чрезмерную активность металлопротеиназ при этом заболевании.
Исследователи из немецкого Общества имени Макса Планка [15] связали чрезмерную активность металлопротеиназ в легких со снижением активности гена Myh10. Если этот ген «отключали» в мышиных легких, их внеклеточный матрикс формировался неправильно, разрушались межальвеолярные перегородки, с укрупнением альвеол сокращалась суммарная площадь их поверхности, а значит, должен был страдать газообмен. То есть события развивались по сценарию, типичному для человеческой эмфиземы лёгких. Кроме того, авторы работы выявили снижение экспрессии гена MYH10 в легких людей, страдающих эмфиземой.
Не исключено, что в будущем мы научимся управлять процессами, которые протекают в матриксе, используя редактирование генома и генную терапию.
Гликопротеины и металлопротеиназы
Яркий пример коварства металлопротеиназ — образование аневризм. Так, при аневризме брюшной аорты матриксные металлопротеиназы разрушают компоненты, из которых строится ВКМ этого крупного сосуда. Вскоре эта область воспаляется благодаря деятельности иммунных клеток — макрофагов. Механизмы, заставляющие металлопротеиназу разрушать аорту, долгое время оставались неизвестными.
Американским исследователям удалось выяснить, что макрофаги синтезируют нетрин-1 — белок, активирующий клетки гладких мышц сосудов [16]. Под воздействием нетрина-1 гладкомышечные клетки активируют свободные металлопротеиназы, разрушающие соединительную ткань сосуда.
Возможно, когда-нибудь мы научимся использовать иммунные клетки, чтобы управлять разрушением внеклеточного матрикса.
Интегрины и фибронектины
Южноафриканские исследователи обнаружили, что на синтез и деградацию фибронектина влияет внутриклеточный белок теплового шока Hsp90. Этот белок воздействует на фибронектин посредством рецептора LRP1 [4]. Если заблокировать этот рецептор, количество фибронектина, который накапливается во внеклеточном матриксе, уменьшается. И это очень хорошо — ведь из-за избыточного накопления фибронектина развиваются многие патологии ВКМ.
Не исключено, что если мы обнаружим подобные рецепторы в клетках разных тканей и научимся на них воздействовать, то сможем предотвращать болезни, связанные с накоплением ВКМ — например, фиброз легких.
Гиалуроновая кислота
Как компонент внеклеточного матрикса гиалуроновая кислота участвует в передаче сигнала от ВКМ в клетку и даже может превратить здоровую клетку в злокачественную [17]. Гиалуроновая кислота воздействует на клетки через рецептор CD44.
Удалось выяснить, что интенсивность сигнала, запускающего злокачественный процесс в клетке и определяющего, насколько опасна будет получившаяся раковая клетка, зависит от концентрации гиалуроновой кислоты и от ее молекулярной массы.
Гиалуроновая кислота управляет раковыми клетками, связываясь с трансмембранным белком — интегрином CD44. Активация рецептора CD44 подавляет апоптоз, из-за чего клетка становится «бессмертной», то есть раковой. Чем больше гиалуроновой кислоты, тем больше активируется рецепторов CD44 и тем, соответственно, опаснее и агрессивнее будут раковые клетки.
Если мы научимся управлять гиалуронидазами — ферментами, которые отвечают за модификацию и деградацию гиалуроновой кислоты, — мы сможем предотвращать развитие рака и появление метастазов.
Как создавать ВКМ
Когда мы усовершенствуем технологии создания искусственного ВКМ, мы сможем производить полноценные ткани и использовать их в регенеративной медицине. Работы в этом направлении ведутся уже давно, и в прошлом году удалось сделать несколько важных шагов на пути к технологии искусственного ВКМ.
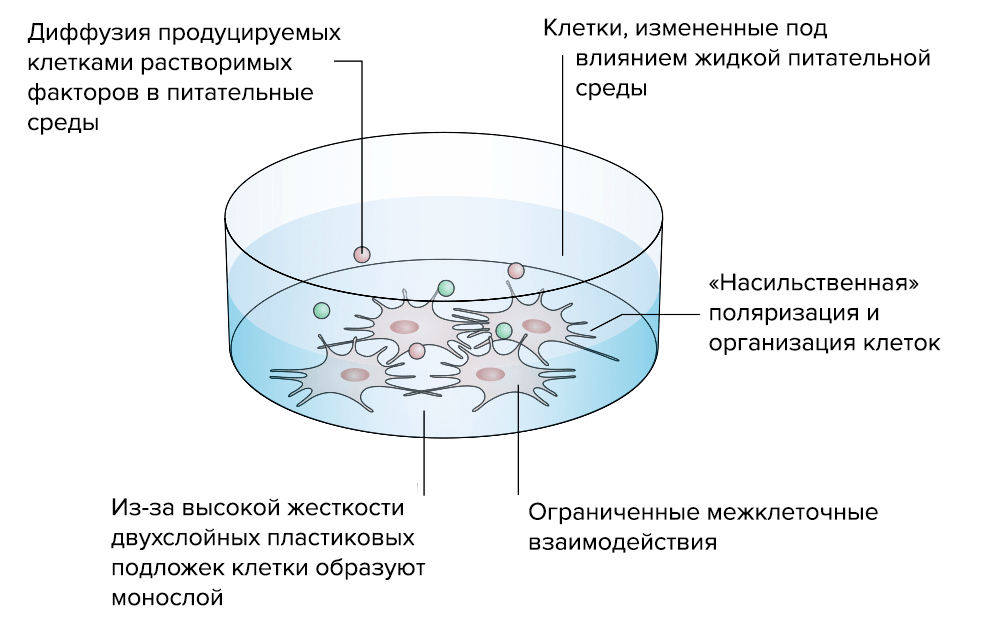
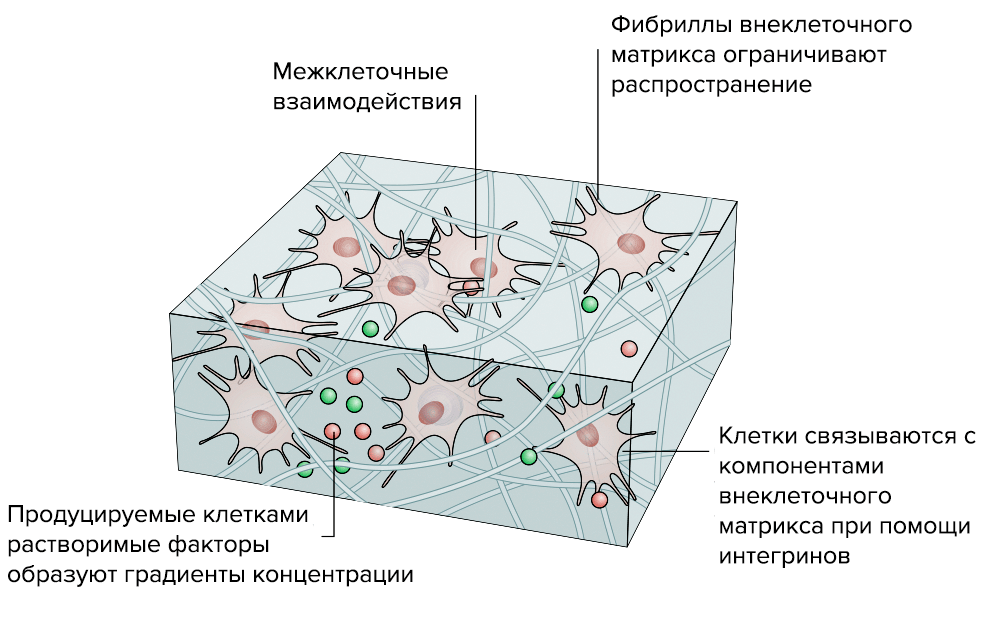
Исследователи уже научились создавать рабочие 3D-модели ВКМ (рис. 5). В отличие от традиционных 2D-моделей, которые, по сути, представляли собой клеточную культуру в чашке Петри, 3D-модели позволяют создать работающий объемный «макет» нужной нам ткани [18].
Рисунок 5а. Преимущества «объемной» 3D-модели соединительной ткани перед стандартной «плоской» 2D-моделью. 2D-модель. Клетки, выращенные на двумерной пластиковой подложке, ведут себя неестественно: нарастают в один слой, из-за чего нарушается межклеточное взаимодействие.
Рисунок 5б. Преимущества «объемной» 3D-модели соединительной ткани перед стандартной «плоской» 2D-моделью. 3D-модель. «Живой макет» ведет себя почти так же, как функциональная ткань: клетки растут и располагаются так, как им «нравится», поэтому у них сохраняется способность к полноценному межклеточному взаимодействию.
3D-модели можно модифицировать и дорабатывать. Уже созданы первые гидрогели — биосовместимые синтетические полимеры, способные удерживать воду. С появлением гидрогелей появилась и теоретическая возможность печатать внутренние органы.
Перед тем как первые напечатанные в лаборатории 3D-органы поступят в больницу, ученым придется решить еще множество проблем. Например, исследователям только предстоит разобраться с тем, как «подвести» к искусственным органам кровеносные сосуды. В этом тоже может помочь понимание биологии ВКМ — ведь мы уже знаем, что внеклеточный матрикс управляет в том числе и ростом сосудов [19].
Заключение
Внеклеточный матрикс — огромная тема, которую очень сложно охватить в одной статье. Ясно одно: если мы сумеем разобраться, как ВКМ функционирует и влияет на клетки, медицина сделает огромный шаг вперед.
Новые открытия в области изучения ВКМ помогут нам:
Судя по всему, ждать прорыва в изучении ВКМ осталось недолго.