Что такое лучевой некроз
Что такое лучевой некроз
Важно понимать, что радиационные повреждения необратимы. Если какая-либо область тела облучается в дозе, полностью уничтожающей опухолевые клетки, то повреждаются и нормальные ткани этой зоны, которые восстановятся потом только частично.
Опухолевая ткань исчезает, а нормальные окружающие ее ткани остаются, поэтому остаточные лучевые повреждения должны учитываться при лечении другого заболевания с локализацией в этой области. Радиобиологи считают, что восстанавливается только 5—20 % повреждений нормальных тканей.
В случае возникновения вторичной злокачественной опухоли в той же зоне много лет спустя повторное облучение тумороцидной дозой часто невозможно из-за остаточныхлучевых повреждений. Помимо этого, любые оперативные вмешательства в пределах ранее облученных полей имеют высокий риск плохого заживления, образования свищей и т. п.
Радиационный некроз мягких тканей — тяжелое осложнение. Обычно он возникает вследствие прогрессирования облитерирующего эндартериита, ведущего к снижению скорости кровотока и возникновению гипоксии в тканях, что способствует усилению фиброза, вялому заживлению и хроническому изъязвлению. Местное консервативное лечение, например промывание перекисью водорода, терапия эстрогенами, часто дают хорошие результаты.
У некоторых больных с некрозом тканей, который, как правило, сопровождается болевым синдромом, образуются свищи. Гипербарическая оксигенация ускоряет заживление таких радиационных повреждений. При ее проведении больную помещают в специальную камеру, где она дышит 100%-м кислородом при повышенном атмосферном давлении, что увеличивает концентрацию кислорода во всем теле в 20 раз выше нормы. Такой вид лечения проводят ежедневно в течение 6—8 нед.; побочные эффекты включают тошноту, клаустрофобию, болезненное давление в ушах — явления, сходные с ощущениями при перепаде давления в самолете. Могут развиться более тяжелые осложнения: интоксикация кислородом и пневмоторакс.
Постоянные лучевые изменения мочеполовой системы и ЖКТ могут вызывать снижение емкости мочевого пузыря, гематурию, стриктуру мочеточника или мочеиспускательного канала, кровь в стуле, кишечную непроходимость, хроническую диарею, тенезмы, недержание кала и образование свища.
Гинекологические изменения включают укорочение влагалища и сухость в нем, боль во время полового акта и ослабление оргазма. Онкологи должны помнить о всех этих отдаленных побочных эффектах и предпринимать все возможные меры для сохранения высокого качества жизни больных.
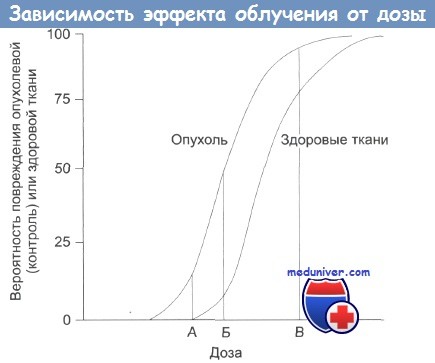
А — нижняя безопасная доза; Б — увеличение дозы: растет поражение здоровых тканей;
В — наивысшая вероятность успешного лечения, но и высокая вероятность поражения здоровых тканей, многочисленные побочные эффекты, некоторые из которых могут проявиться в отдаленном будущем.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Радиационный (постлучевой) некроз
Радиационный некроз твердых тканей зубов возникает после воздействия ионизирующего излучения в связи с лечением злокачественных новообразований, заболеваний крови,скелета и других органов и систем, а также от действия профессиональных факторов.
Патогенез (что происходит?) во время Радиационного (постлучевого) некроза:
До настоящего времени нет единого мнения о механизме и характере изменений в тканях зуба и полости рта в результате радиационного излучения. Одни исследователи склонны относить лучевые нарушения тканей зубов к некариозным поражениям. Другие считают, что после радиационного облучения активно развивается кариес зубов наряду с некариозными поражениями.
Патогенез лучевого поражения зубов до сих пор окончательно не выяснен. Обсуждаются данные о сосудистых, морфологических и дегенеративных нарушениях в пульпе. Предполагают влияние на зубы ксеросто-мии, развивающейся после лучевого воздействия. Не исключается иммунодепрессивное действие ионизирующего излучения. Некоторые исследователи полагают, что в облученном организме происходит специфическое подавление металлосодержаших ферментных систем (в первую очередь железосодержащих), участвующих в процессе тканевого дыхания в аэробной фазе. Нарушение аэробной фазы тканевого дыхания влечет за собой накопление в тканях организма, в том числе в пульпе зуба, недоокисленных продуктов метаболизма, а также стойкое нарушение их дальнейшего окисления.
Симптомы Радиационного (постлучевого) некроза:
Без радикальных лечебных мероприятий через 1-2 года пораженными оказываются более 96 % зубов.
Интенсивность лучевого поражения зубов в известной степени зависит от зоны и дозы облучения. Эти поражения, напоминающие кариес, безболезненны даже при зондировании, показатель электроодонтометрии понижен до 15-25 мкА.
Образовавшиеся в зубах полости имеют неровные изъеденные края, которые в пределах эмали прозрачные и хрупкие. Располагаются полости на атипичных для кариеса поверхностях зубов. Кариозная полость обычно заполнена серой массой, удаление ее малоболезненно или безболезненно. Ранее и вновь поставленные пломбы выпадают.
Анамнез позволяет дифференцировать указанные поражения, наметить меры лечения и профилактики.
Лечение Радиационного (постлучевого) некроза:
При поражении твердых тканей коронки зуба лечение прово дят в несколько этапов. Вначале осто рожно удаляют некротические массы из дефектов зубов вручную экскава тором, чтобы не внедриться в полость зуба, а затем вводят кальцифицирующую пасту, состоящую из равных час тей порошка глицерофосфата кальция, оксида цинка и глицерина. Пасту накладывают тонким слоем на дно и стенки образовавшейся полости и закрывают временным пломбировоч ным материалом.
Следующий этап отсроченного лечения зубов проводят через 1-1,5 мес. Он состоит в удале нии нежизнеспособных, некротизированных тканей зуба при помощи бора до минерализованного участка дентина или эмали, после чего вновь накладывают кальцифицирующую пасту и пломбируют зубы стеклоиономерными цементами.
При более глубоких поражениях устраняют имеющиеся некротические дефекты стеклоиономерными цементами и через 3-4 мес, если этого требует косметическая реставрация передних зубов, часть стеклоиономера удаляют, а сверху накладывают композитный пломбировочный материал.
Профилактика Радиационного (постлучевого) некроза:
Для уменьшения прямого действия радиации на зубы изготавливают индивидуальную свинцовую каппу, которую больной надевает непосредственно перед каждой процедурой лучевой терапии. Необходимо также уменьшить опосредованное действие проникающей радиации путем предварительного (перед облучением) проведения месячного курса общей и местной реминерализующей терапии в сочетании с комплексом антиоксидантов.
Если профилактические мероприятия перед облучением не проводили, то после лучевой терапии необходимо провести весь курс комплексного лечения в течение 5-6 мес, сочетая его со стоматологическими вмешательствами.
Обычно через 3-4 нед комплексной реминерализующей и антиоксидантной терапии появляется гиперестезия дентина. Это хороший признак, свидетельствующий о восстановлении жизнеспособности пульпы зуба.
К каким докторам следует обращаться если у Вас Радиационный (постлучевой) некроз:
Некроз челюсти: причины и методы лечения
Некроз челюсти – это тяжелое воспалительное заболевание, при котором обнажаются и отмирают кости лицевого скелета.
Отмирание клеток провоцирует:
Причины разрушения костей челюсти
Болезнь развивается при сочетании нескольких факторов. При прочих одинаковых условиях, в группу риска попадают пациенты:
Симптомы и течение
К сожалению, долгое время болезнь может протекать вообще без симптомов. Пациент не испытывает боли, поэтому к врачу обращается, уже когда инфекция проникла глубоко в кость.
Признаки некроза челюсти:
Основной признак остеонекроза челюсти – обнажение кости.
Классификация
Течение заболевание, спровоцированного инфекцией может иметь острый, хронический и подострый характер.
По месту расположения выделяют:
По типу инфицирования:
Американская ассоциация стоматологов определяет следующие стадии развития заболевания:
0 стадия – зубная боль, которая отдается в височно-нижнечелюстной сустав или пазуху носа. Подвижность зубов, при сохранном пародонте. Появление свищей,кист, флюсов.
1 стадия – обнажение участка кости без сильных болей
2 стадия – обнажение участка кости, сопровождающееся болью и воспалением
3 стадия – обнажение участка кости, которое выходит за пределы альвеолярной (той, в которой находится зуб) кости. При некрозе нижней челюсти поражается челюсть вплоть до нижнего края. Происходит атрофия костной ткани. Это стадия патологических переломов. При некрозе верхней челюсти затрагивается скуловая дуга и верхнечелюстная пазуха. Образуются многочисленные свищи.
Диагностика
Симптомы остеонекроза челюсти сходны с другими заболеваниями: опухолями, туберкулезом костей, актиномикозом. Поэтому обследование проводят комплексно:
Если пациент перенес остеомиелит, принимает большие дозы бисфосфонатов, проходил лучевую терапию или у него была травма челюсти, то врач проведет дополнительное обследование. Оно подтвердит или опровергнет наличие некроза.
Если кость обнажилась, то диагноз поставить легче, но, если болезнь находится на нулевой стадии, нужны дополнительные данные.
Положительные пробы на с-реактивный белок, лейкоцитоз, высокий СОЭ – причины заподозрить некротический процесс. Также проверяют мочу на наличие белка, клеток крови. В некоторых случаях, делают анализ гнойных выделений, чтобы определить патоген перед назначением бактериальной терапии.
Рентген, а лучше КТ (компьютерная томография) помогает определить площадь патологического процесса, степень поражения, наличие переломов, секвестров (отмерших фрагментов кости, свободно лежащих между здоровых тканей).
Лечение
Задача стоматолога – остановить разрушение костной ткани, предотвратить сепсис, облегчить симптоматику.
Для этого применяют терапевтические и хирургические методы, такие, как:
Назначают антибиотики широкого спектра действия, антигистаминные препараты, асептические растворы для полоскания рта. При болях выписывают анальгетики.
Врач проводит кюретаж карманов или лунок удаленных зубов. Убирает секвестры, вскрывает и обеспечивает дренаж гнойных очагов, шинирует подвижные зубы.
В зависимости от стадии заболевания, показана операция, при которой пораженная кость удаляется полностью, остается только ее здоровая часть.
Во многих случаях, приходится прибегать к восстановительной хирургии, чтобы восполнить дефект или исправить деформацию. Это может быть пересадка костной ткани или восстановление челюсти.
Профилактика
Своевременная стоматологическая помощь способна предотвратить развитие гнойных процессов, распространение инфекции на костные ткани. Важно проводить санацию полости рта не откладывая, чтобы вовремя уничтожать все очаги инфекции.
Врачи рекомендуют устранить все стоматологические проблемы до начала лечения бисфосфонатами. Если лечение проводится во время БФ терапии – обязательно предупредите врача. Он примет дополнительные меры по антисептической обработке, ушьет лунки, назначит антибактериальную терапию.
Здоровый образ жизни, сбалансированное питание укрепляют иммунитет, не дают инфекциям распространятся. Это предупреждает развитие воспалительных процессов и их осложнений в виде некроза челюсти.
Говорина Е.В., Щербенко О.И.. Российский научный центр рентгенорадиологии МЗ России (г. Москва).
Анализ мировой литературы показывает, что лучевая терапия остается обязательным компонентом лечебного комплекса при большинстве опухолей ЦНС, поскольку она позволяет девитализировать остатки опухоли после нерадикальной операции, и может быть самостоятельным методом при неоперабельных новообразованиях. В то же время, отсутствие значимых различий в радиочувствительности большинства новообразований ЦНС и самой ткани мозга, которая неизбежно подвергается облучению, при подведении канцероцидных доз радиации создает реальную угрозу развития лучевых повреждений.
Целью настоящего анализа литературы было изучение информации касающейся патогенеза и риска развития лучевых повреждений ткани головного мозга, факторов влияющих на развитие таких повреждений, методов дифференциальной диагностики повреждений от возобновления роста опухоли и вариантов лечения таких осложнений.
Наибольшее число публикаций посвящено изменениям нейро-физиологических параметров у больных получавших облучение головного мозга.
В работах многих авторов (1,2,3,4,5,6,7,8,9,10,11,12,13), сравнивавших состояние интеллекта у детей больных опухолями мозга получавших ЛТ и не получавших ее, отмечено, что после облучения как у детей так и взрослых с высокой частотой снижались показатели интеллектуальных возможностей в виде ухудшения долговременной памяти, внимания и зрительно-пространственного восприятия, нарушения процессов узнавания визуальных образов, быстрой утомляемости и истощаемости при эмоциональных и умственных нагрузках. Наблюдалось также учащение проявлений депрессии и жалоб на слабость. Отмечено также, что при облучении левого полушария чаще страдает память, а правого – распознавание образов (5). Эти изменения были более выраженными у больных получавших лучевую терапию в возрасте до 7 лет (2) и старше 50 лет (9). По данным авторов работы (11), из 25 больных облучавшихся по поводу глиомы мозга, у 40% показатели интеллекта сохранялись в норме, у 28% имелись умеренные нарушения и у 32% нарушения были тяжелыми.
Хотя, по мнению авторов публикации (14), вклад облучения в нарушение функции мозга невелик и эти нарушения в большей мере связаны с влиянием опухоли и хирургического вмешательства, морфологические изменениями, выявляемые у больных получавших облучение головного мозга значительны. Так в работах (15,16) у больных, подвергавшихся лучевой терапии по поводу опухоли мозга, признаки атрофии мозга выявлялись как при компьютерной томографии, так и при оценке объема спинно-мозговой жидкости как критерия атрофии ткани мозга. При этом указанные признаки начинали проявляться уже через 2-3 месяца после облучения. Роль облучения в развитии атрофии мозга показана в работе (16), в которой сравнивалась частота выявления атрофии у 23 больных глиомой получавших лучевую терапию и у 17 не получавших. В первой группе атрофия мозга выявлена в 61% случаев, а во второй только у 6%. Вероятность развития атрофии мозга возрастает после проведения повторного облучения. Так в работе (17) описано 6 случаев подострой атрофии, которая выражалась расстройством сознания и непроизвольными движениями, а на компьютерных томограммах констатировалось расширение желудочков и борозд, а также повышение интенсивности сигнала.
Распространенность и глубина морфологических изменений мозга после облучения зависит не только от возраста, но и от условий лучевой терапии – размеров зоны облучения, величины фракций и суммарной дозы облучения. Чем больше размеры зоны облучения и больше разовая и суммарная доза, тем чаще
наблюдаются симптомы лучевых повреждений мозга (28,29). Особенно высока вероятность повреждений при облучении опухоли дозой 60 Гр в условиях использования разовых фракций 1,8-2 Гр. Увеличение ежедневной дозы облучения или применение варианта ускоренного фракционирования приводит к возрастанию риска повреждения (30,31), в то время как дробление дневной дозы на две фракции по 1-1,1 Гр уменьшает риск лучевого повреждения мозга даже после облучения в больших дозах. Так в публикации (29) облучение больных 70 опухолью носоглотки в режиме мультифракционирования (по 1,2 Гр х 2 раза в день) до суммарной дозы 80 Гр не привело к развитию некроза височных долей мозга ни у одного из больных, в то время как облучение в режиме ускоренного фракционирования (по 1,6 Гр х 2 раза в день до суммарной дозы 68,4-76,4 Гр привело к развитию такого осложнения у трех из 11 больных (27%).
Вероятность развития лучевых повреждений мозга возрастает и при сочетании лучевой терапии с химиотерапией. Авторы работы (33)сообщили, что из 148 больных глиомой получивших химиолучевое лечение (сочетание лучевой терапии и химиотерапии карбоплатином ) при последующем динамическом наблюдении у 20 выявлен некроз ткани мозга, у 16 сочетание некроза с рецидивом опухоли, у двоих некроз черепно-мозговых нервов. Описан даже случай развития тяжелой миэлопатии у 5-летнего ребенка после краниоспинального облучения в дозе 24 Гр в сочетании с интратекальной химотерапия метотрексатом и цитарабином (31). Особенно токсично для ткани мозга сочетание внутриартериальной химиотерапии и облучения (32).
Сроки развития некроза мозга зависят от величины суммарной дозы. Так в работе (34), авторы которой проследили судьбу 106 больных при суммарной дозе эквивалентной 70 единиц ВДФ некроз развивается через 40-60 месяцев, а при дозе 100 ед. – через 10-20 месяцев.
Клинические проявления лучевого повреждения головного мозга обычно симулируют продолженный рост опухоли и дифференциальная диагностика в таких случаях чрезвычайно важна, поскольку необоснованное назначение повторной цитотоксической терапии только усугубляет тяжесть нарушений. В этих условиях на первый план выступают инструментальные методы диагностики – компьютерная, магнитно-резонансная и позитронно-эмиссионная томография, радиоизотопные исследования. Возможности компьютерной томографии для дифференциальной диагностики ограничены в связи с сопутствующим зоне некроза перифокальным отеком, часто в сочетании с остатком опухоли. Тем не менее, на КТ без контрастного усиления выявляется зона сниженной плотности ткани не накапливающая контраст и без масс-эффекта (25,35,36,37).
Возможности магнитно-резонансной томографии (МРТ) в дифференциальной диагностике продолженного роста опухоли от лучевых повреждений несколько шире, чем КТ. При этом зона патологических изменений на МРТ обычно больше, чем на КТ. В режиме Т 2 изменения на МРТ выглядят как зона усиления сигнала (38). При трактовке данных МРТ и КТ необходимо учитывать время развития симптоматики и локализацию выявленных изменений. Если продолженный рост опухоли возникает обычно через 4-8 месяцев после окончания лучевой терапии, то лучевой некроз, как правило, развивается в более поздние сроки.
Имеются отдельные сообщения об эффективности использования для дифференциальной диагностики магнитно-резонансной спектроскопии (41) и однофотонной сцинтиграфиии с меченым технецием-99м гексаметилпропилен амином (42).
Подводя итог данному обзору, можно сделать некоторые выводы:
1. Отсутствие значимой разницы в радиочувствительности наиболее часто встречающихся опухолей мозга и окружающих тканей делает опасность лучевых повреждений при подведении радикальных доз радиации вполне реальной и их тяжесть может быть сопоставима с симптомами самой опухоли. Риск развития повреждений возрастает с увеличением разовых и суммарных доз облучения, облучаемого объема, при применении режимов облучения с ускоренным фракционированием, при сочетании лучевой и химиотерапии.
2. В дифференциальной диагностике лучевых повреждений от продолженного роста опухоли необходимо учитывать сроки возобновления симптомов поражения мозга, локализацию определяемого очага, результаты КТ, МРТ и ПЭТ. Однако ни один из перечисленных методов не позволяет с полной уверенностью проводить дифференциальную диагностику.
4. Прецизионное планирование лучевой терапии с максимальным щажением здоровых тканей позволит уменьшить риск лучевых повреждений мозга.
Список литературы:
Improved neuropsychological outcome in children with brain tumors diagnosed during infancy and treated without cranial irradiation.
Cognitive deficits in long-term survivors of childhood medulloblastoma and other noncortical tumors: age-dependent effects of whole brain radiation.
4. Merchant T.E., Kiehna E.N., Miles M.A., et al.
Acute effects of irradiation on cognition: changes in attention on a computerized continuous performance test during radiotherapy in pediatric patients with localized primary brain tumors.
Radiotherapeutic effects on brain function: double dissociation of memory systems.
6. Abayomi O., Chun M.S., Kelly K.,et al.
J Nat. Med Assoc,- 1990.-v.82.-N12,-p.833-836.
7.Klein M., Heimans J.J., Aaronson N.K., et al.
Effect of radiotherapy and other treatment-related factors on mid-term to long-term cognitive sequelae in low-grade gliomas : a comparative study.
8.Taphoorn M.J., Schiphorst A.K., Snoek F.J., et al.
Cognitive functions and quality of life in patients with low-grade gliomas : the impact of radiotherapy.
9. Surma-aho O., Niemela M., Vilkki J.,et al.
Adverse long-term effects of brain radiotherapy in adult low-grade glioma patients.
Neurology,- 2001.-v. 22;56.-N10,-p.1285-1290.
10.Sichez N., Chatellier G., Poisson M.,et al.
Supratentorial gliomas : neuropsychological study of long-term survivors.
Rev Neurol (Paris),- 1996.-v.152.-N4,-p.261-266.
11. Takeda N., Tanaka R., Ibuchi Y., et al.
Progressive mental deterioration after radiotherapy in adult patients with brain tumors.
Gan No Rinsho,-1989.-v.35.-N11,-p.1330-1338.
Cognitive dysfunction following surgery for intracerebral glioma : influence of histopathology, lesion location, and treatment.
13. Armstrong C.L., Hunter J.V., Ledakis G.E.,et al.
Late cognitive and radiographic changes related to radiotherapy: initial prospective findings.
14. Postma T.J, Klein M., Verstappen C.C., et al.
15.Asai A., Matsutani M., Takakura K.,et al.
Subacute brain atrophy induced by radiation therapy of malignant brain tumors.
16. Asai A., Matsutani M., Kohno T., et al.
Subacute brain atrophy after radiation therapy for malignant brain tumor
17. Burger P.C., Mahley M.S. Jr., Dudka L.,et al.
The morphologic effects of radiation administered therapeutically for intracranial gliomas : a postmortem study of 25 cases.
18. Satran R., Lapham L.W., Kido D.R.,et al.
Late cerebral radionecrosis after conventional irradiation of cerebral tumors.
19. Yoshii Y., Takano S., Tsurushima H., Hyodo A.,et al.
Normal brain damage after radiotherapy of brain tumours
20. Oi S., Kokunai T., Ijichi A., Matsumoto S., et al.
Radiation-induced brain damage in children—histological analysis of sequential tissue changes in 34 autopsy cases.
21.Mitomo M., Kawai R., Miura T., et al.
22. Llena J.F., Cespedes G., Hirano A., et al.
Vascular alterations in delayed radiation necrosis of the brain. An electron microscopical study.
23.Matsumura H., Ross E.R.,et al.
Delayed cerebral radionecrosis following treatment of carcinoma of the scalp: clinicopathologic and ultrastructural study.
24. Martins A.N., Johnston J.S., Henry J.M.,et al.
Delayed radiation necrosis of the brain.
Reversible oedema and necrosis after irradiation of the brain. Diagnostic procedures and clinical manifestations.
26. Sakai N., Nakatani K., Shirakami S., et al.
Delayed effects of radiation of patients with germ-cell tumor, with special to cerebral blood flow.
Intracranial atherosclerosis following radiotherapy.
Radiation injury of the normal brain tissue after external radiotherapy of brain tumor.
29. Safdari H., Fuentes J.M., Dubois J.B., et al.
Radiation necrosis of the brain: time of onset and incidence related to total dose and fractionation of radiation.
30. Brada M., Sharpe G., Rajan B.,et al.
Modifying radical radiotherapy in high grade gliomas ; shortening the treatment time through acceleration.
Int J Radiat Oncol Biol Phys,-1999.-v.15.-N2,-p.287-292.
31. Jen Y.M., Hsu W.L., Chen C.Y. et al.
Different risks of symptomatic brain necrosis in NPS patients treated with different altered fractionated radiotherapy techniques.
32. Di Chiro G., Oldfield E., Wright D.C.,et al.
Cerebral necrosis after radiotherapy and/or intraarterial chemotherapy for brain tumors: PET and neuropathologic studies.
33. Kumar A.J., Leeds N.E., Fuller G.H. et al.
Malignant gliomas : MR imaging spectrum of radiation therapy and chemotherapy-induced necrosis of the brain after treatment.
Radiology, 2000, Vol.217, N2, p.377-384.
34. Watne K., Hager B., Heier M.,et al.
Reversible oedema and necrosis after irradiation of the brain. Diagnostic procedures and clinical manifestations.
35.Ebner F., Hormann M., Golles M., et al.
Radiation necrosis of the brain: correlation between patterns on computed tomography and dose of radiation.
37.Shibata S., Jinnouchi T., Mori K.,et al.
Delayed cerebral radionecrosis associated with brain edema.
38.Packer R.J., Zimmerman R.A., Bilaniuk L.T.,et al.
Magnetic resonance imaging in the evaluation of treatment-related central nervous system damage.
39.Ogawa T., Uemura K., Kanno I., et al.
Delayed radiation necrosis of brain evaluated positron emission tomography.
Tohoku J Exp Med,- 1988.-v.155.-N3,-p.247-260
40. Thompson T.P., Lunsford L.D., Kondziolka D.
Distinquishing recurrent tumor and radiation necrosis with positron emission tomography versus stereotactic biopsy.
41. Schlemmer H.P., Bachert P., Henze M.,et al.
Differentiation of radiation necrosis from tumor progression using
proton magnetic resonance spectroscopy.
42. Dadparvar S., Hussian R., Koffler J.P. et al.
Cancer, 2000, Vol. 6, N6, p.381-387.
43.Fujii T., Misumi S., Shibasaki T., Tamura M., et al.
Treatment of delayed brain injury after pituitary irradiation.
44. Ciaudo-Lacroix C., Lapresle J.
Pseudo- tumoral form of delayed radionecrosis of the brain.
45. Hulshof M.C., Stark N.M., van der Kleij A.,et al.
Hyperbaric oxygen therapy for cognitive disorders after irradiation of the brain.
46.Feldmeier J.J., Hampson N.B.,et al.
A systematic review of the literature reporting the application of
hyperbaric oxygen prevention and treatment of delayed radiation
injuries: an evidence based approach.
Undersea Hyperb Med,-2002.-v.29.-N1,-p.24-30.
