Что такое лимфоидные фолликулы желудка
Что такое лимфоидные фолликулы желудка
Имеется вариабельность в строении лимфатических узлов из различных анатомических областей. Для лимфатических узлов шеи характерна типичная структура фолликулов, паракортикальной зоны, мозгового вещества и синусов. Подмышечные лимфатические узлы в состоянии покоя имеют вид ободка лимфоидной ткани вокруг жировой ткани в центре.
При злокачественных лимфомах и других лимфопролиферативных состояниях эта жировая ткань заселяется опухолевыми клетками и может полностью исчезнуть. Брыжеечные лимфатические узлы имеют более широкие синусы и обычно менее заметные фолликулы и паракортикальную зону.
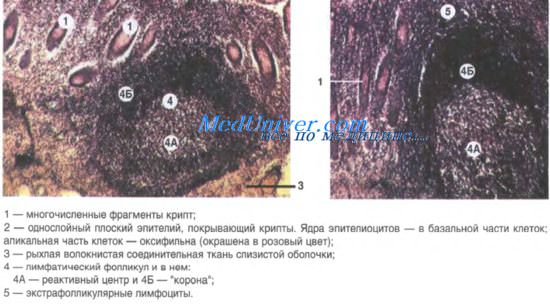
Лимфоидные фолликулы отвечают за Т-зависимое образование антител. Они являются местом образования различных антител и переключения изотипов. Первичные фолликулы построены из малых В-клеток, несущих на поверхности IgM и IgD, и фолликулярных дендритных клеток. Если рассечь вторичный фолликул в области полюса, не затрагивая центр размножения, он будет выглядеть как первичный фолликул.
Вторичные фолликулы имеют центр размножения, состоящий из бластных клеток (центробласты) и их потомства (центроциты). Эти клетки проявляют полярность, выражающуюся в формировании темной зоны из бластных клеток (из-за выраженной базофилии цитоплазмы при окрашивании по Гимза) и светлой зоны из центроцитов. В клетках темной зоны выявляются многочисленные митозы и высокая степень пролиферации; во многих клетках могут определяться признаки апоптоза.
Обычно полярность фолликулов лучше видна в лимфоидных фолликулах слизистых оболочек (таких как слизистая миндалины) и лимфатических узлах.
В-клетки центра размножения не экспрессируют BCL-2 и, таким образом, подвержены апоптозу. Допускается, что только В-клетки, обеспечивающие хорошую аффинность антител, реэкспрессируют BCL-2 и выживают. Апоптозу подвергается значительная доля В-клеток фолликулярных центров, которые захватываются макрофагами центра (макрофаги «окрашенных телец»).
Центр размножения окружен мантийной зоной, состоящей из малых В-лимфоцитов с фенотипом, похожим на таковой клеток, обнаруживаемых в первичных фолликулах. В-клетки маргинальной зоны со светлой цитоплазмой могут обнаруживаться кнаружи от мантийной зоны. Часто такие клетки обнаруживаются в брыжеечных узлах, но обычно не заметны в других местах. Лимфоидные фолликулы содержат сеть фолликулярных дендритных клеток (ФДК).
ФДК захватывают и удерживают иммунные комплексы на своей поверхности для презентации В- и Т-клеткам. ФДК имеют характерные ядра: часто они двуядерные или многоядерные. Рутинными методами окраски дендритные отростки не идентифицируются, но часто они хорошо визуализируются в срезах, окрашенных на IgM, маркирующий иммунные комплексы на поверхности отростков. Эти отростки также выявляются окрашиванием на CD21 и CD23.
Центры размножения с обратным развитием часто содержат интерстициальное эозино-фильное протеиногеннос вещество. Иногда в центрах роста реактивных лимфатических узлов обнаруживаются плазматические клетки. Лимфоидные фолликулы содержат различное число малых Т-клеток, многие из которых экспрессируют CD3, CD4 и CD57.
Лимфома желудка
Лимфома желудка – редкая, потенциально злокачественная или злокачественная опухоль, происходящая из лимфоидной ткани, расположенной в стенке желудка. Метастазирование наблюдается редко. Лимфома желудка проявляется преждевременным насыщением, болями в эпигастральной области, тошнотой, рвотой, нарушениями аппетита, снижением массы тела и повышением температуры. Диагностируется на основании истории болезни, клинических симптомов, данных осмотра, рентгенографии, КТ, МРТ, гастроскопии, биопсии, анализов крови на маркеры рака и других исследований. Лечение – антихеликобактерная терапия, резекция желудка или гастрэктомия, химиотерапия, диетотерапия.
Общие сведения
Лимфома желудка – злокачественное нелейкемическое новообразование, происходящее из лимфоидных клеток в стенке органа. Обычно отличается относительно благоприятным течением, медленным ростом и редким метастазированием, однако степень злокачественности опухоли может различаться. Чаще располагается в дистальной части желудка. Не связана с поражением периферических лимфоузлов и костного мозга. Лимфомы желудка составляют от 1 до 5% от общего количества неоплазий данного органа. Обычно развиваются в возрасте старше 50 лет. Мужчины страдают чаще женщин. На начальных стадиях прогноз благоприятный. Средняя пятилетняя выживаемость при лимфомах желудка всех стадий колеблется от 34 до 50%. Лечение проводят специалисты в области онкологии, гастроэнтерологии и абдоминальной хирургии.
Причины лимфомы желудка
Предшественницей данного новообразования является лимфоидная ткань, расположенная в слизистой оболочке в виде отдельных лимфоцитов и скоплений клеток. При определенных условиях (например, при хроническом гастрите, возникшем на фоне инфицирования Helicobacter pylori) такие скопления образуют лимфоидные фолликулы, в которых могут возникать участки атипии. С учетом того, что у 95% пациентов с лимфомой желудка при проведении обследования обнаруживаются различные штаммы Helicobacter pylori, эта инфекция рассматривается, как одна из основных причин возникновения данной патологии.
Наряду с Helicobacter pylori, развитие различных типов лимфом желудка может провоцироваться другими факторами, в том числе – контактом с канцерогенными веществами, длительным пребыванием в зонах с повышенным уровнем радиации, предшествующей лучевой терапией, приемом некоторых лекарственных препаратов, избытком ультрафиолетового излучения, неспецифическим снижением иммунитета, иммунными нарушениями при СПИДе, аутоиммунными заболеваниями и искусственным подавлением иммунитета после операций по трансплантации органов.
Классификация лимфом желудка
С учетом происхождения и особенностей клинического течения различают следующие виды лимфом желудка:
С учетом особенностей роста выделяют следующие разновидности лимфом желудка:
С учетом глубины поражения, определяемой при проведении эндоскопического УЗИ, различают следующие стадии лимфом желудка:
Наряду с приведенной выше классификацией для определения распространенности лимфомы желудка используют стандартную четырехстадийную классификацию онкологических заболеваний.
Симптомы лимфомы желудка
Специфические признаки отсутствуют, по своим клиническим проявлениям лимфома желудка может напоминать рак желудка, реже – язвенную болезнь желудка или хронический гастрит. Наиболее распространенным симптомом является боль в области эпигастрия, нередко усиливающаяся после приема пищи. Многие больные лимфомой желудка отмечают ощущение преждевременного насыщения. У некоторых пациентов развивается отвращение к определенным видам пищи. Характерно похудание, обусловленное чувством переполнения желудка и снижением аппетита. Возможно критическое снижение массы тела вплоть до кахексии.
При лимфоме желудка часто наблюдаются тошнота и рвота, особенно – на фоне употребления излишнего количества пищи, что еще больше способствует сокращению порций, отказу от еды и последующему снижению веса. При распространении онкологического процесса может развиваться стеноз желудка. В отдельных случаях у больных лимфомой желудка возникают кровотечения различной степени выраженности (в том числе – небольшие, с примесью крови в рвотных массах). Существует опасность развития тяжелых осложнений – перфорации стенки желудка при ее прорастании опухолью и профузного кровотечения при расположении лимфомы желудка вблизи крупного сосуда. Наряду с перечисленными симптомами отмечаются повышение температуры тела и обильное потоотделение, особенно в ночное время.
Диагностика лимфомы желудка
Диагноз устанавливается с учетом жалоб, истории заболевания, внешнего осмотра, пальпации живота, лабораторных и инструментальных исследований. Из-за неспецифичности симптоматики возможно позднее выявление лимфомы желудка, в литературе описаны случаи, когда временной период между появлением болей в эпигастрии и постановкой диагноза составлял около 3 лет. Основным способом инструментальной диагностики является гастроскопия, позволяющая определить расположение и тип роста опухоли. При проведении эндоскопического исследования лимфому желудка может быть трудно дифференцировать с раком, гастритом и немалигнизированной язвой.
Для уточнения диагноза эндоскопист осуществляет забор материала для последующего гистологического и цитологического исследования. Отличительной особенностью взятия эндоскопической биопсии при лимфомах желудка является необходимость забора ткани с нескольких участков (множественная или петлевая биопсия). Для определения распространенности онкологического процесса осуществляют эндоскопическое УЗИ и КТ брюшной полости. Для выявления метастазов назначают МРТ грудной клетки и МРТ брюшной полости. Несмотря на диагностические затруднения, из-за медленного роста большинство лимфом желудка выявляются на первой или второй стадии, что увеличивает вероятность благополучного исхода при данной патологии.
Лечение лимфомы желудка
При локализованных, благоприятно протекающих MALT-лимфомах осуществляют эррадикационную антихеликобактерную терапию. Допустимо использование любых схем лечения с доказанной эффективностью. При отсутствии результата после применения одной из стандартных схем больным лимфомой желудка назначают усложненную трехкомпонентную или четырехкомпонентную терапию, включающую в себя введение ингибиторов протонного насоса и нескольких антибактериальных средств (метронидазола, тетрациклина, амоксициллина, кларитромицина и т. д.). При неэффективности усложненных схем в зависимости от стадии лимфомы желудка проводят химиотерапию или системную терапию.
При других формах лимфомы желудка и MALT-лимфомах, распространяющихся за пределы подслизистого слоя, показано хирургическое вмешательство. В зависимости от распространенности процесса осуществляют резекцию желудка или гастрэктомию. В послеоперационном периоде всем пациентам с лимфомой желудка назначают химиопрепараты. В запущенных случаях применяют химиотерапию или лучевую терапию. Химиотерапия может провоцировать изъязвление и перфорацию стенки желудка (в том числе – бессимптомную), поэтому при использовании данной методики регулярно проводят КТ для выявления свободных жидкости и газа в брюшной полости. На поздних этапах лимфомы желудка существует угроза развития стеноза желудка, перфорации желудка или желудочного кровотечения, поэтому операции рекомендуется проводить даже при опухолях III и IV стадии.
Благодаря медленному росту, поздней инвазии в глубокие слои стенки желудка и достаточно редкому метастазированию прогноз при лимфомах желудка относительно благоприятный. Применение эррадикационной терапии на ранних стадиях MALT-лимфом обеспечивает полную ремиссию у 81% больных и частичную – у 9% больных. Радикальные хирургические вмешательства возможны в 75% случаев. Средняя пятилетняя выживаемость при лимфоме желудка I стадии составляет 95%. На II стадии этот показатель снижается до 78%, на IV – до 25%.
Особенности эндоскопической семиотики и антихеликобактерная терапия MALT-лимфом желудка
Лимфомы гастроинтестинального тракта охватывают от 14% до 27% всех экстранодальных поражений и составляют от 1% до 15% всех злокачественных опухолей желудочно-кишечного тракта. Чаще всего поражается желудок (50–75%), сравнительно реже тонкая кишка (20–35%
Лимфомы гастроинтестинального тракта охватывают от 14% до 27% всех экстранодальных поражений и составляют от 1% до 15% всех злокачественных опухолей желудочно-кишечного тракта. Чаще всего поражается желудок (50–75%), сравнительно реже тонкая кишка (20–35%). Лимфомы толстой кишки наблюдаются в 5–10% случаев. Самыми редкими признаны первичные неходжкинские лимфомы пищевода [1].
В 1983 году Brooks и Enterline [2] провели клинико-морфологическое исследование, где показали, что нодальные и экстранодальные лимфомы отличаются по биологическим свойствам и что экстранодальные варианты лимфомы имеют более благоприятный прогноз.
Brooks и Enterline впервые отметили патогенетическую связь между хроническим воспалением слизистой оболочки желудка и развитием лимфомы. Было высказано предположение, что многие типы лимфом желудка представляют собой злокачественную трансформацию доброкачественных и длительно текущих лимфоцитарных поражений желудка. Авторы пришли к тому заключению, что длительная антигенная стимуляция вместе с аутоиммунным феноменом в клетках слизистой оболочки желудка в целом приводят к появлению злокачественного клона. Эта гипотеза была подтверждена результатами клинико-морфологических исследований, проведенных при лимфомах слюнной и щитовидной желез. Было показано, что лимфомы этих желез могут возникнуть на фоне хронического тиреоидита и сиалоаденита с синдромом Шегрена или без него.
P. Isaacson и D. H. Wright [3] обратили внимание на то, что большая часть первичных лимфом желудка развивается на фоне хронических гастритов. Более того, было показано, что другие варианты экстранодальных лимфом также связаны с хроническими воспалительными процессами. Доказано, что Нelicobacter pylori — грамотрицательная спиралевидная бактерия, впервые выделенная из гастробиоптата австралийскими исследователями Warren и Marschall в 1983 году, является причиной подавляющего большинства случаев хронических гастритов. Она приводит к возникновению язвенной болезни желудка, 12-перстной кишки, является одним из факторов риска аденокарциномы желудка.
Показано, что при эрадикации этого микроорганизма симптомы хронического воспаления становятся менее интенсивными и снижается степень лимфоцитарной инфильтрации. В 1993 году были представлены доказательства, что Н. pylori играет важную роль в возникновении подгруппы лимфом желудка MALT-типа [4]. Рядом авторов [5] было высказано мнение, что Н. pylori вызывает нарушение физиологических и иммунологических процессов, окислительное повреждение ДНК и пролиферацию как гемапоэтических, так и клеток слизистой оболочки желудка. В дальнейшем было установлено, что 90% больных MALT-лимфомой инфицированы Н. pylori [6, 7, 8]. Было показано также, что Н. pylori непосредственно и посредством цитотокина вызывает пролиферацию Т-клеток и макрофагов, что сопряжено с высвобождением цитокинов (интерлейкина-2 и интерлейкина-6). Последние, в свою очередь, вызывают пролиферацию В-клеток, способствуют развитию лимфоидных фолликулов и агрегатов лимфоцитов в толще слизистой оболочки желудка [9].
Материалы и методы исследования
Эндоскопическая картина лимфом желудка изучена нами у 250 пациентов, при этом поражение у 160 (64%) больных расценено как первичное, а у 90 (36%) — как вторичное, наблюдаемых в РОНЦ с 1995 года, из которых было 99 пациентов с MALT-лимфомой желудка. Разработаны эндоскопические и эндосонографические критерии диагноза MALT-лимфомы, ее дифференциально-диагностические признаки, проведена оценка лекарственной терапии.
Результаты и их обсуждение
При тщательном анализе развития болезни нами установлено, что в группе с первичными лимфомами желудка практически одна треть (32%) пациентов имели гастроэнтерологический анамнез: язвенную болезнь желудка, хронический атрофический, гипертрофический или смешанные гастриты, зачастую ассоциированные с инфекцией H. pylori.
Согласно нашим наблюдениям длительность существования гастроэнтерологической патологии до установления наличия опухоли в группе с первичной лимфомой желудка весьма вариабельна: в течение первых трех месяцев диагноз установлен у 30,6% (49 больных), в течение 6 месяцев у 18,1% (29 больных), в срок от 6 до 12 месяцев у 15,6% (25 больных). Отдельно следует отметить, что практически у трети пациентов (27,5% — 44 пациента) диагноз первичной лимфомы желудка был установлен спустя год (табл. 1).
Также отдельно необходимо отметить, что диагноз первичной лимфомы желудка у 8% пациентов выявлен при плановом обследовании по поводу сопутствующей патологии и оказался диагностической находкой, так как заболевание у части больных протекало бессимптомно.
В группе пациентов со вторичным поражением желудка от момента установления диагноза первичной локализации процесса до времени выявления поражения желудка сроки были различны и представлены в табл. 2.
Как видно из представленных в таблице данных, поражение желудка в большинстве случаев развилось в первые два года от начала заболевания, что диктует нам необходимость обязательных периодических эндоскопических исследований желудка с целью своевременного выявления метастатического поражения его при лимфомах.
В нашей работе чаще всего при лимфомах желудка имело место инфильтративно-язвенное и инфильтративное его поражение — 28,4% и 21,6% соответственно, затем в 14,8% встречается язвенная форма роста опухоли. Гастритоподобный вариант опухоли отмечен в 14,4%. Реже встречались смешанная и экзофитная формы роста опухоли — 12,0% и 8,8% соответственно.
Причем, как показывает анализ наших данных, при MALT-лимфоме преобладала гастритоподобная форма роста, которая составила 34,3%.
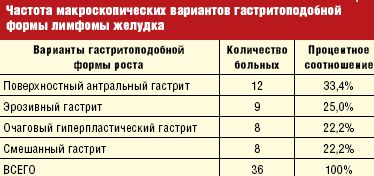
Эндоскопическая картина гастритоподобной формы лимфомы желудка является наиболее вариабельной и по преобладанию макроскопических признаков может проявляться в виде:
Естественно, такое деление является относительно условным, и эти формы выделяются нами по преобладанию наиболее выраженных указанных признаков, симулирующих ту или иную форму гастрита (табл. 3).
Анализируя полученные данные, чаще всего, в 33,4%, отмечался поверхностный антральный гастрит, вторым по частоте стал эрозивный гастрит — 25,0%, с одинаковой частотой в 22,2% встречается очаговый гиперпластический гастрит и смешанный гастрит.
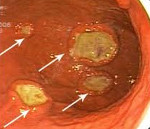
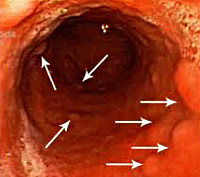
При гастритоподобной форме лимфомы желудка в виде антрального гастрита, как следует из самого определения, визуальные проявления опухоли симулируют воспалительные изменения в антральном отделе желудка, которые отмечены нами в 33,4%. При сохраненной эластичности стенок желудка отмечается пастозность, разрыхленность и очаговая гиперемия слизистой антрального отдела желудка, чередующаяся с участками белесоватого цвета, ее повышенная контактная кровоточивость. Как и при других вариантах, характерным является появление стекловидного блеска. При проведении биопсии подвижность и эластичность слизистой оболочки снижена, отмечается ее фрагментация.
Изменения при лимфоме желудка в виде эрозивного гастрита отмечаются в 25,0% случаев и характеризуются наличием множественных поверхностный острых эрозий неправильной или щелевидной формы на фоне пастозной, неравномерно гиперемированной слизистой с усиленным сосудистым рисунком. Участки эрозий могут локализоваться в различных отделах желудка, чередуясь с неизмененной слизистой, либо занимать изолированную, ограниченную зону. Эластичность стенок остается, как правило, сохраненной или снижена незначительно.
Лимфома желудка в виде локального гиперпластического гастрита. Этот тип лимфомы отмечается в 22,2% случаев и характеризуется умеренным неравномерным утолщением складок на ограниченном участке чаще по большой кривизне и в проксимальном отделе желудка иногда с переходом на переднюю или заднюю стенки. Эластичность стенки сохранена, подвижность складок может быть сохраненной или сниженной. Поверхность складок покрыта вязкой стекловидной слизью, разрыхлена. При инсуффляции складки слизистой пораженного участка, как правило, не расправляются полностью.
В нашем исследовании инфицирование H. pylori было выявлено практически у всех больных при мелкоклеточном варианте и составило 96,7%, при промежуточном варианте MALT-лимфомы желудка — 90%, в отличие от смешанно-клеточных MALT-лимфом, при которых частота инфицирования составила только 53,8%.
При выявлении инфицирования H. pylori мы также определяли степень обсемененности. Оказалось, что при мелкоклеточных MALT-лимфомах высокая частота инфицирования сочетается с выраженной степенью обсемененности чаще (75,9%), чем при других подвариантах. Так, у больных с промежуточным вариантом наличие H. pylori-инфекции сопровождается выраженной степенью обсемененности достоверно реже и выявлено в 38,9%, при смешанных MALT-лифмомах выраженная степень обсемененности установлена у 57,1% пациентов.
Умеренная степень обсемененности при мелкоклеточных опухолях выявлена у 20,7%, при промежуточном варианте чаще — у 61,1%, а при смешанной MALT-лимфоме — у 14,3%.
Слабая степень обсемененности H. pylori встречается у больных MALT-лимфомой желудка крайне редко, она была определена лишь у трех пациентов.
Терапия больных первичной MALT-лимфомой представляет ряд особенностей. Это обусловлено тем, что в мировой практике накоплен относительно небольшой опыт использования всех видов лечебного воздействия — антихеликобактерной терапии, химиотерапии, лучевой терапии, хирургического лечения и их сочетаний.
Антихеликобактерная терапия использовалась нами только при I стадии (классификация Lugano, 1993) MALT-лимфомы желудка мелкоклеточного строения. Лечение проводилось в соответствии с рекомендациями Международного протокола LY03 по изучению MALT-лимфом желудка низкой степени злокачественности [10]. Нами применялась трехкомпонентная схема первой линии эрадикационной терапии, включающая одновременное применение в течение 10–14 дней следующих препаратов:
В результате проведенного лечения у 14 пациентов (87,5%) из 16 больных была достигнута полная ремиссия, у 2 больных (12,5%) констатирована стабилизация заболевания.
Терапевтический эффект антибиотикотерапии реализовался постепенно. Нами установлена последовательность исчезновения проявлений болезни. Первыми ликвидировались клинические симптомы: боль, изжога, тошнота, желудочный дискомфорт.
Вслед за эрадикацией H. pylori постепенно уменьшались визуальные эндоскопические проявления опухолевого поражения: сокращались размеры опухолевого поражения, подслизистой инфильтрации, уменьшался калибр складок слизистой, происходило рубцевание специфических язвенных дефектов, затем восстанавливалась нормальная архитектоника слизистой, исчезала деформация стенок желудка.
Необходимо акцентировать внимание на том, что сроки наступления полного терапевтического эффекта весьма вариабельны. Полная ремиссия, подтвержденная гистологическим и иммунологическим исследованием гастробиоптатов, была диагностирована у больных, получавших антихеликобактерное лечение, в сроки от 2 до 10 месяцев (медиана 5,5 месяцев).
Это означает, что лечение мелкоклеточных MALT-лимфом с применением антихеликобактерных препаратов — это терапия, осуществленная всего за 10–14 дней, но требующая в последующем взвешенного динамического наблюдения и корректной оценки происходящих изменений. Темп наступления полного клинического благополучия является косвенным признаком прогнозирования терапевтического эффекта.
Из 14 больных с подтвержденной полной ремиссией вследствие антихеликобактерной терапии только у одной больной в возрасте 51 год был констатирован рецидив заболевания при контрольном обследовании через 7 месяцев после окончания лечения без каких-либо клинических проявлений. Трактовка эндоскопической картины была сложной: осуществлялась дифференциальная диагностика между эрозивным гастритом и минимальными проявлениями лимфомы. Рецидив был подтвержден иммуноморфологическими исследованиями. В последующем больная получала последовательное лечение Лейкераном (хлорамбуцил), COP с эффектом, который расценен нами как стабилизация заболевания. Учитывая клиническое благополучие, а также наличие тяжелой сопутствующей патологии, было решено хирургическое лечение не применять, а больную оставить под динамическим наблюдением. В течение последующих 36 месяцев больной проводится регулярное обследование (каждые 4–5 месяцев). За этот период наблюдения прогрессирования заболевания не наступило по настоящее время.
Это наблюдение демонстрирует особое свойство мелкоклеточной MALT-лимфомы. Сочетание клинического благополучия с объективными данными стабилизации позволяет длительно наблюдать за больными на фоне проведения регулярного полноценного обследования.
Таким образом, антихеликобактерная терапия правомочна и эффективна при первичных MALT-лимфомах желудка, но при обязательном строгом соблюдении показаний к ее использованию — I стадия процесса с небольшим локализованным поражением слизистого и подслизистого слоев при H. pylori-позитивных опухолях. Обязательным является динамическое исследование опухолевого субстрата на наличие H. pylori, эрадикация которого необходима для реализации противоопухолевого эффекта. Отсутствие эрадикации H. pylori требует использования химиотерапии с повторными курсами антибиотикотерапии.
Хронический гастрит: от гистологического протокола до обоснования этиопатогенетической терапии

Гастрит представляет собой реакцию слизистой оболочки (СО) желудка на повреждение и характеризуется формированием воспалительных, дистрофических и дисрегенераторных изменений в СО желудка, а также атрофией эпителиальных клеток с замещением нормальных желе
Abstract. Gastritis is a reaction of the mucous membrane (MM) of the stomach to damage and is characterized by the formation of inflammatory, dystrophic and dysregenerative changes in the MM of the stomach, as well as atrophy of epithelial cells with replacement of normal glands with fibrous tissue. The progression of chronic gastritis (CG) is accompanied by the development of MM atrophy, dysplasia and becomes a significant factor in the formation of gastric malignant neoplasms. The article presents the modern etiological classification of CG, approaches to the diagnosis of CG, assessing the stage of gastritis on a scale of progressive increase in the likelihood of developing stomach cancer, presents the histological characteristics, and also substantiates etiopathogenetic approaches to the treatment of various forms of CG, including methods for optimizing the eradication therapy of H. pylori infection. which can be used to increase the effectiveness of not only standard triple therapy, but also other anti-Helicobacter treatment regimens. The use of proton pump inhibitors in the treatment of gastritis is considered. For citation: Dolgalev I. V., Kareva E. N., Lyalyukova E. A. Chronic gastritis: from histological protocol to substantiation of etiopathogenetic therapy // Lechaschy Vrach. 2021; 2 (24): 30-34. DOI: 10.26295/OS.2021.76.84.006
Резюме. Гастрит представляет собой реакцию слизистой оболочки (СО) желудка на повреждение и характеризуется формированием воспалительных, дистрофических и дисрегенераторных изменений в СО желудка, а также атрофией эпителиальных клеток с замещением нормальных желез фиброзной тканью. Прогрессирование хронического гастрита (ХГ) сопровождается развитием атрофии, дисплазии СО и становится значимым фактором формирования злокачественных новообразований желудка. В статье приводятся современная этиологическая классификация ХГ, подходы к диагностике ХГ, оценке стадии гастрита по шкале прогрессирующего увеличения вероятности развития рака желудка, представлены гистологические характеристики, а также обоснованы этиопатогенетические подходы к терапии различных форм ХГ, включая методы оптимизации эрадикационной терапии инфекции H. pylori, которые могут быть применены для повышения эффективности не только стандартной тройной терапии, но и других режимов антихеликобактерного лечения. Рассмотрено примение ингибиторов протонной помпы в терапии гастрита.
Хронический гастрит (ХГ) – широко распространенное заболевание пищеварительной системы, регистрируемое у 15-30% населения в различных популяциях и составляющее 80-85% всех заболеваний желудка 2. Медико-социальная значимость проблемы заключается в том, что прогрессирование ХГ сопровождается развитием атрофии, дисплазии слизистой оболочки (СО) и становится значимым фактором формирования злокачественных новообразований желудка [4, 5].
Целью данного обзора было представить гистологическую характеристику и обосновать этиопатогенетические подходы к терапии различных форм ХГ.
Дефиниции
Гастрит представляет собой реакцию СО на повреждение и характеризуется формированием воспалительных, дистрофических и дисрегенераторных изменений в СО желудка, а также атрофией эпителиальных клеток с замещением нормальных желез фиброзной тканью. Развитие этого заболевания сопровождается нарушением секреторной и моторной функций желудка.
К настоящему времени сложилось устойчивое мнение о том, что диагноз гастрита должен быть верифицирован морфологически. Основным гистологическим признаком заболевания являются инфильтрация собственной пластинки воспалительными клетками и структурные изменения железистого аппарата слизистой желудка [5]. При гистологическом исследовании гастрит подтверждается наличием нейтрофилов или мононуклеарных клеток 2-й степени по крайней мере в одном участке биопсии желудка либо нейтрофилов или мононуклеарных клеток 1-й степени по меньшей мере в двух участках [6]. Воспалительный инфильтрат представлен лимфоцитами, плазматическими клетками, гистиоцитами и гранулоцитами, расположенными диффузно или в виде скоплений в собственной пластинке СО, иногда – внутри желез. Активность воспалительного процесса определяется степенью инфильтрации полиморфноядерными лейкоцитами (нейтрофилами и ацидофильными гранулоцитами) собственной оболочки (lamina propria) слизистой желудка [7].
Международная группа патологов Оперативного звена для оценки гастрита (Operative Link for Gastritis Assessment – OLGA) предложила интегральный метод оценки выраженности морфологических изменений СО желудка и стандартизировала гистологические фенотипы по степени и стадии развития (OLGA Staging System) 8. Локализация нейтрофилов определяет степень: нейтрофилы в собственной пластинке оболочки – легкая (+-) активность; нейтрофилы в эпителии – умеренная (++-) активность и нейтрофилы в просвете железы – выраженная (+++) активность.
Прогрессирование заболевания сопровождается замещением собственных железистых структур lamina propria фиброзной тканью (неметапластическая атрофия) или заменой желез метапластическими железами. Метапластическая атрофия может иметь два фенотипа: кишечная метаплазия (КМ), поражающая слизистые железы, и псевдопилорическая метаплазия, которая также известна как метаплазия псевдопилорических желез. Система позволяет оценить стадию гастрита по шкале прогрессирующего увеличения вероятности развития рака желудка – риск от самого низкого (стадия 0) до самого высокого (стадия IV). Таким образом, под степенью гастрита подразумевается выраженность суммарной воспалительной инфильтрации (нейтрофильными лейкоцитами и мононуклеарными клетками), под стадией – выраженность атрофии. Такая система дает достаточно полную характеристику гастрита и отражает его динамику.
Альтернативная система определения стадии заболевания (Operative Link on Gastric Intestinal Metaplasia Assessment – OLGIM) предлагает рассматривать только КМ для оценки атрофии [9]. Различение неатрофического и атрофического гастрита необходимо, чтобы получить информацию о том, за какими пациентами требуется клиническое/эндоскопическое наблюдение.
Этиология ХГ
Современная этиологическая классификация ХГ была предложена в 2015 г. на Международном консенсусе в Киото (Япония) [12].
С учетом этиологического фактора различают следующие формы гастрита:
I. Аутоиммунный ХГ (АИГ) (этиология неизвестна; аутоиммунный патогенез).
II. Инфекционный ХГ.
III. Экзогенный ХГ (лекарственный, алкогольный, радиационный, вызванный химическими веществами).
IV. ХГ, вызванный воздействием специфических причин (лимфоцитарный, гигантский гипертрофический (болезнь Менетрие), аллергический, эозинофильный).
V. Вторичный ХГ, вызванный другими заболеваниями (при саркоидозе, васкулитах, болезни Крона).
Аутоиммунный хронический гастрит
В общей популяции встречается нечасто – менее чем в 1% случаев, а среди больных ХГ – до 5% [13]. Заболевание вызывает поражение фундального отдела и тела желудка. АИГ является наследственно обусловленным и передается как аутосомно-доминантный признак, часто сочетаясь с другими аутоиммунными заболеваниями (сахарным диабетом 1 типа, тиреоидитом Хашимото, синдромом Шегрена) [14]. Патогенетически это аутоиммунная патология, связанная с наличием антител, направленных против париетальных клеток желудка и их компонентов (внутренний фактор и протонная помпа) с формированием атрофии СО желудка. Прогрессивное снижение количества париетальных клеток приводит к гипохлоргидрии вплоть до анацидного состояния. Снижение синтеза соляной кислоты стимулирует G-клеточную гиперплазию и таким образом способствует повышению уровня гастрина в сыворотке крови. В свою очередь гипергастринемия создает условия для гиперплазии энтерохромаффиноподобных клеток, которые иногда трансформируются в злокачественную опухоль желудка [15]. Относительный риск развития аденокарциномы желудка у этих больных возрастает в 3 раза [16]. Снижение образования внутреннего фактора приводит к мальабсорбции витамина В12 и его дефициту в организме, что может стать причиной пернициозной (мегалобластной) анемии, а также множественных неврологических расстройств (фуникулярный миелоз) [15].
Типичные гистологические паттерны аутоиммунного гастрита 16
Другие гистологические паттерны
ХГ, ассоциированный с инфекцией H. pylori
Инфекция H. pylori – наиболее частая причина развития ХГ. Заболевание первоначально развивается как хронический активный гастрит, при котором H. pylori обнаруживается как в антральном отделе, так и в теле желудка (обычно в большем количестве в антральном отделе). Длительно сохраняющийся активный гастрит, ассоциированный с H. pylori, создает условия для развития вторичной атрофии СО желудка. Так, по результатам 10-летнего проспективного наблюдения больных хеликобактерным активным гастритом, атрофия выявлена у 6% пациентов через 2 года, у 22% – через 4 года, у 34% – через 6 лет и у 43% – через 10 лет наблюдения, при этом в группе контроля (Нр-негативные) атрофия не развивалась [19].
Гистология процесса представлена следующим образом: полиморфноядерные лейкоциты инфильтрируют собственную пластину, железы и фовеолярный эпителий, образуя небольшие микроабсцессы. Наблюдаются лимфоидные агрегаты и лимфоидные фолликулы, расширяющие собственную пластинку СО, иногда лимфоциты проникают в эпителий. Инфекция H. pylori – основная причина вторичной атрофии СО желудка. Атрофические изменения (как метапластические, так и неметапластические) в образце биопсии из угла и антрального отдела в первую очередь следует рассматривать как доказательства хеликобактерного гастрита. На поздних стадиях атрофии, связанной с хронической инфекцией H. pylori, как в теле, так и в антральном отделе наблюдается обширное замещение КМ, связанной с развитием гипохлоргидрии. По мере распространения КМ количество бактерий H. pylori, обнаруживаемых в желудке, уменьшается, так как H. pylori исчезает из участков метапластического эпителия. Особое значение этой проблеме придает то, что атрофический гастрит является начальной ступенью каскада изменений СО, приводящего к злокачественному новообразованию желудка (каскад Корреа) [20]. Вероятность развития рака желудка возрастает по мере нарастания тяжести атрофии слизистой, и этот риск находится в прямой зависимости от степени атрофических изменений, выявляемых в антральном отделе и в теле желудка, в особенности при наличии метаплазии [21]. Длительное течение гастрита, ассоциированного с H. pylori, повышает вероятность развития злокачественной опухоли желудка в 6 раз [21].
Типичные гистологические паттерны
Варианты гистологических паттернов
Последствия
Цитомегаловирусный (ЦМВ) гастрит
Единственная вирусная инфекция желудка с отчетливой патологической картиной. Преимущественно поражает детей и пациентов с ослабленным иммунитетом. Обычно поражаются разные участки желудочно-кишечного тракта. Эндоскопически СО желудка может выглядеть полностью нормальной или иметь эрозии и язвы. В редких случаях это может быть образование, называемое псевдоопухолью. Гистологически многочисленные включения ЦМВ в эпителиальных клетках можно увидеть реже, чем в эндотелиальных, а также в макрофагах с незначительным воспалением или его отсутствием. В этом случае иммунологический статус пациентов обычно сильно подавлен. В других случаях может наблюдаться обильная грануляционная ткань с серьезной воспалительной реакцией, в то время как включения ЦМВ трудно увидеть без методов иммуногистохимии или гибридизации in situ. Эозинофильные инфильтраты также могут быть важным компонентом воспаления при ЦМВ-гастрите [7].
Гастрит, вызванный лекарственными средствами; алкогольный гастрит; лучевой гастрит, рефлюкс-гастрит
Химические агенты увеличивают обновление эпителия желудка, что приводит к фовеолярной гиперплазии. Эти состояния часто протекают бессимптомно, но они могут привести к множественным эрозиям или язвам, даже с кровотечением. Атрофические изменения встречаются редко [7].
Диагноз основан на микроскопическом исследовании СО желудка, и, согласно существующему определению, основным его признаком является наличие не менее 25 интра-эпителиальных лимфоцитов на 100 эпителиальных клеток желудка. Большинство этих лимфоцитов имеют фенотип CD3+ и CD8+. Известно, что инфекция H. pylori связана с ЛГ, достигая от 0% до 27% случаев. Связь между ЛГ и глютеновой болезнью установлена и колеблется от 10% до 38% [7].
Эозинофильный гастрит (ЭГ)
Является частью семейства эозинофильных желудочно-кишечных расстройств, которое включает эозинофильный эзофагит, эозинофильный гастроэнтерит и эозинофильный энтерит/колит, связанные с триггерами пищевых аллергенов. У многих пациентов в анамнезе были атопические состояния, включая астму, аллергический ринит или атопический дерматит, а также аллергию на лекарственные продукты или пыльцу. Рекомендованы два основных критерия диагностики ЭГ: 1) в биоптате желудка средняя плотность эозинофилов > 127/мм 2 (или > 30 эозинофилов/поле высокого увеличения (HPF) на микроскопах, оснащенных широкоугольными окулярами (FN 22), по крайней мере в пяти отдельных HPFs); 2) отсутствие известных ассоциированных причин эозинофилии (например, инфекция H. pylori, болезнь Крона, паразитарные инфекции, а также гематологические или лимфоидные нарушения) [7].
Диагностика ХГ
Диагностика ХГ включает клиническое обследование, cерологическое исследование (пепсиногены и антитела против инфекционных агентов и/или аутоантигены), эндоскопию верхних отделов желудочно-кишечного тракта (с применением стандартизированных протоколов биопсии) и последующее гистологическое исследование. Гистологическое изучение биоптата является «золотым стандартом» в диагностике заболевания. Прицельная биопсия из пяти мест: антральный отдел, большая (А1) и малая кривизна (А2), угол (А3) и тело желудка, большая (С1) и малая кривизна (С2).
Стандартизация морфологических признаков ХГ нашла отражение в полуколичественных системах гистологической классификации гастритов, которые были заложены Сиднейской системой (Sydney Systems, 1990) и получили дальнейшее развитие в Хьюстонской модифицированной классификации (1994) и системах OLGA и OLGIM (2008) 22.
Подходы к терапии отдельных форм ХГ
Своевременная диагностика и верное определение классификационной группы ХГ имеют основополагающее значение для успешного лечения этого заболевания.
Особенности АИГ зависят от стадии, наличия инфекции H. pylori, текущего дефицита питательных веществ, сопутствующих аутоиммунных состояний и риска злокачественной трансформации. Так как инфекция H. pylori может играть решающую роль в патогенезе АИГ, необходим скрининг на H. рylori пациентов с диагностированным АИГ, атрофией желудка, КМ/дисплазией и гипо- или ахлоргидрией. При положительном результате на H. pylori пациенты нуждаются в последующем лечении. Исследования подтверждают, что эрадикация H. pylori была связана со снижением уровней антител к париетальным клеткам и антител против внутреннего фактора на ранних стадиях AИГ.
Пероральный прием витамина B12, железа и фолиевой кислоты рекомендуется на ранних стадиях АИГ. При появлении неврологических симптомов следует назначать витамин B12 парентерально.
Поскольку различные аутоиммунные заболевания признаются сопутствующими AИГ, необходимо уделять внимание их скринингу и последующему лечению.
Тактика лечения AИГ с предотвращением осложнений требует надлежащего длительного наблюдения в соответствии с текущими симптомами, серологическими результатами и данными визуализации. Для этого необходим правильный мониторинг показателей – один раз в год (общий анализ крови, уровень гастрина, железа и витамина B12) [25, 26].
ХГ, вызванный Н. pylori, в том числе у «бессимптомных» лиц, является показанием к проведению эрадикационной терапии инфекции Н. pylori. Эрадикация способствует излечению хронического неатрофического гастрита, может привести к регрессии атрофического гастрита и снижает риск развития рака желудка у пациентов с неатрофическим и атрофическим гастритом. Эрадикация H. pylori у пациентов с КМ тяжелой степени, судя по всему, не приводит к существенному снижению риска развития рака желудка, как минимум в краткосрочной перспективе, однако обеспечивает снижение выраженности воспаления и атрофии, и у таких пациентов следует рассмотреть возможность ее проведения [27].
В России терапией первой линии эрадикации служит стандартная тройная терапия, включающая ИПП, кларитромицин и амоксициллин. Стандартную тройную терапию следует проводить, применяя различные меры, повышающие ее эффективность. Среди методов оптимизации, позволяющих повысить эффективность эрадикационной терапии инфекции H. pylori, следует отметить увеличение продолжительности лечения до 14 дней, выбор надежного ИПП или увеличение дозы ИПП, добавление висмута трикалия дицитрата или пробиотика. В качестве альтернативного варианта эрадикационной терапии первой линии может быть использована классическая четырехкомпонентная схема на основе висмута трикалия дицитрата или без препаратов висмута, которая включает ИПП, амоксициллин, кларитромицин и метронидазол. Квадротерапию с висмута трикалия дицитратом применяют также как основную схему терапии второй линии при неэффективности стандартной тройной терапии. Другая схема второй линии включает ИПП, левофлоксацин и амоксициллин. Тройная терапия с левофлоксацином может быть назначена только гастроэнтерологом по строгим показаниям. Терапию третьей линии подбирают индивидуально в зависимости от предшествующих схем лечения.
Методы оптимизации эрадикационной терапии инфекции H. pylori могут быть применены для повышения эффективности не только стандартной тройной терапии, но и других режимов антихеликобактерного лечения, а комбинирование этих методов позволяет добиться наилучшего результата у конкретного пациента [28].
Эрадикация H. pylori позволяет купировать симптомы диспепсии и активность гастрита.
Если все варианты терапии исчерпаны, обычное лечение будет направлено на снижение секреции кислоты СО желудка и защиту слизистого барьера.
В клинической практике кислая среда в желудке играет решающую роль в развитии гастрита, вызванного H. рylori, и ассоциированных с ним симптомов диспепсии, поэтому ИПП являются важной стратегией лечения пациентов с симптоматическим гастритом [29].
Кислотообразующая АТФаза, известная как АТФаза вакуо-лярного типа, помимо париетальных клеток имеется также в лизосомах лейкоцитов, и на ее активность тоже влияют ИПП [31]. Противовоспалительный эффект ИПП включает торможение хемотаксиса и дегрануляции нейтрофилов, взаимодействие нейтрофилов с эндотелиоцитами, выработку нейтрофилами свободных радикалов [32]. Противовоспалительная активность ИПП подтверждена результатами клинических и экспериментальных исследований. В частности, в экспериментальном исследовании было оценено влияние омепразола на адгезивную активность нейтрофилов, стимулированную H. pylori. Адгезия нейтрофилов увеличивалась за счет присутствия H. рylori, тогда как введение ИПП (омепразола), напротив, значительно снижало адгезию дозозависимым образом [31].
Использование авторадиографии позволило выявить накопление 3H-лансопразола в цитоплазматических гранулах нейтрофилов, инфильтрирующих СО желудка. За счет повышения внутривакуолярного уровня pH в лизосомах нейтрофилов, ИПП ослабляют активацию нейтрофилов и высвобождение ими токсичных метаболитов [33].
В исследованиях in vivo было показано, что омепразол (1-100 мкМ) дозозависимо увеличивал рН в лизосомах, ингибировал подвижность активированных нейтрофилов, подавлял выработку ими токсичных продуктов и снижал работу лизосомальных ферментов. У здоровых добровольцев, которым вводили омепразол в дозе 40 мг/сут в течение 7 дней, выявлено значительное снижение хемилюминисценции (отражающей активности) периферических нейтрофилов [34].
Учитывая, что длительное воспаление в СО желудка сопряжено с повреждением ДНК и риском канцерогенеза, своевременное и эффективное лечение гастрита, особенно на ранних его стадиях, является важным аспектом канцеропревенции в гастроэнтерологии.
Таким образом, не вызывает сомнений тот факт, что класс ИПП является наиболее востребованным при лечении кислотозависимых заболеваний с позиции доказательной медицины. Согласно реестру Сomcon (2020) [35], омепразол занимал и продолжает занимать лидирующие позиции в назначениях докторов и полностью отвечает критериям эффективности и безопасности при лечении кислотозависимых заболеваний [36].
Среди препаратов омепразола, представленных на российском фармацевтическом рынке, одним из самых изученных и надежных, а также известных [37] является Омез®. Полный цикл производства лекарственного препарата Омез® соответствует международным стандартам GMP [сертификат, подтверждающий производство Омеза по стандартам GMP], что обеспечивает высокое качество препарата и достижение должного уровня рН в желудке у пациентов, необходимого для кислотосупрессии. Омез® включен в Оранжевую Книгу FDA с терапевтической эквивалентностью категории «А», что подтверждает его качество на мировом уровне и идентичность оригинальному омепразолу [38].
Сравнительное исследование по оценке эффективности генериков омепразола, назначаемых в течение 7 дней в параллельных группах (в одной из которых использовали ИПП Омез®, в других – небрендированные омепразолы разного производства), показало, что уровень кислотосупрессии желудка достоверно выше на фоне применения Омез® в дозе 20 мг 2 раза в сутки. Использование других генериков омепразола в приведенном исследовании не приводило к целевому снижению уровня кислоты в желудке, что очевидно отражает их потенциальную клиническую неэффективность. Полученные различия могут быть связаны как с качеством субстанции, так и различиями лекарственных форм. Все молекулы ИПП являются кислотонеустойчивыми, и потому для сохранения действующего вещества в нативном виде для всасывания в кровь в кишечнике абсолютно необходимо защитить молекулу от кислоты. Для этого в лекарственной форме имеется кишечнорастворимая оболочка. Из капсулы Омез®, которая растворяется в желудке, высвобождаются гранулы (пеллеты), покрытые кишечнорастворимой оболочкой (MUPS – multi-unit pellet system). Пеллеты правильной формы и одинакового размера, который позволяет им смешаться с химусом и без задержек отправиться в тонкую кишку. Здесь происходит растворение оболочки, выход омепразола в жидкую среду и абсорбция его энтероцитами. Этот процесс должен происходить дружно, и пик концентрации омепразола должен совпасть с пиком активации протонных насосов (для этого обязательно принять пищу через 30 мин после приема препарата ИПП), только в активированном состоянии они доступны для связывания и блокады. Очевидно, что оптимизация лекарственных форм отражается на клинической эффективности препаратов. Но это статья расходов, на которой дженериковые компании зачастую экономят. Поэтому при выборе медикаментозной кислотосупрессивной терапии следует учитывать потенциальные возможности лекарственных препаратов, ориентируясь на должный уровень эффективности [39].
Омез® – один из немногих препаратов омепразола, имеющих форму выпуска – капсулы 40 мг. Пациентам с низкой приверженностью к терапии можно рекомендовать Омез® 40 мг 1 раз в сутки за 30 минут до завтрака [40]. Эта доза является оптимальной и для быстрых метаболизаторов. Еще одним несомненным достоинством препарата является его доступная цена при высоком качестве субстанции и уникальной лекарственной форме, что дает возможность в сложившихся социально-экономических условиях поддерживать на высоком уровне качество жизни большого числа больных кислотозависимыми заболеваниями.
КОНФЛИКТ ИНТЕРЕСОВ. Авторы статьи подтвердили отсутствие конфликта интересов, о котором необходимо сообщить.
CONFLICT OF INTERESTS. Not declared.
Литература/References
* ФГБОУ ВО Сибирский ГМУ Минздрава России, Томск, Россия
** ФГАОУ ВО РНИМУ им. Н. И. Пирогова Минздрава России, Москва, Россия
*** ФГАОУ ВО Первый МГМУ им. И. М. Сеченова Минздрава России, Москва, Россия
**** ФГБОУ ВО ОмГМУ Минздрава России, Омск, Россия
***** ФГБОУ ВО МГМСУ им. А. И. Евдокимова Минздрава России, Москва, Россия
Хронический гастрит: от гистологического протокола до обоснования этиопатогенетической терапии/ И. В. Долгалёв, Е. Н. Карева, Е. А. Лялюкова, Н. В. Павлова
Для цитирования: Долгалёв И. В., Карева Е. Н., Лялюкова Е. А., Павлова Н. В. Хронический гастрит: от гистологического протокола до обоснования этиопатогенетической терапии // Лечащий Врач. 2021; 2 (24): 30-34.
Теги: хеликобактерная инфекция, слизистая оболочка, дисплазия, факторы риска