Что такое ксеногенный клапан
Искусственные клапаны сердца

Искусственный клапан сердца: 2 основных типа
При нарушении работы какого-либо из 4 клапанов сердца — их сужении (стеноз) или чрезмерном расширении (недостаточности) — существует возможность их замены или реконструкции при помощи искусственных аналогов. Искусственный клапан сердца — это протез, который обеспечивает требуемое направление тока крови за счет прерывистого перекрывания устьев венозных и артериальных сосудов. Основным показанием к протезированию служат грубые изменения створок клапана, приводящие к выраженному нарушению кровообращения.
Рисунок 1. Два основных типа искусственных клапанов
Механический клапан сердца или биологический протез?
Механический клапан сердца надежен, служит долго и не нуждается в замене, но требует постоянного приема специальных медикаментов, снижающих свертываемость крови.
Биологические клапаны постепенно могут разрушаться. Срок их службы в значительной степени зависит от возраста больного и сопутствующих заболеваний. С возрастом процесс разрушения биологических клапанов существенно замедляется.
Жизнь с искусственным клапаном сердца
Люди с протезами сердечных клапанов относятся к категории пациентов с очень высоким риском тромбоэмболических осложнений. Борьба с тромбозами — основа стратегии ведения таких пациентов, и именно ее успешность во многом определяет прогноз для больного.
К наиболее важным аспектам врачебного наблюдения за пациентом с искусственным клапаном сердца на сегодняшний день относятся 4 :
Профилактика тромбозов у пациентов с механическими клапанами сердца
Профилактика тромбоза у пациентов с механическим клапаном сердца требует пожизненной антитромботической терапии.
Интенсивность терапии варфарином зависит от локализации протеза и его типа. Например, в соответствии с рекомендациям ACC/AHA (2008) механический протез аортального клапана требует поддержания МНО в пределах 2,0-3,0 при использования двухлепестковых (двустворчатых) протезов, а также клапана Medtronic Hall (один из самых популярных в мире одностворчатых искусственных клапанов), или в дипазоне 2,5-3,5 для всех остальных дисковых клапанов, а также для шарового клапана Starr–Edwards.
Таблица 1. Рекомендуемое значение МНО при механических клапанах сердца 5
| Позиция клапана сердца | Факторы риска ТЭ-осложнений | |
| отсутствуют | присутствуют | |
| Аортальная | 2,0-3,0 | 2,5-3,5 |
| Митральная | 2,5-3,5 | 3,0-4,0 |
В настоящее время существуют портативные аппараты для самостоятельного определения МНО (по типу систем для контроля уровня сахара у больных диабетом), которые помогают удерживать уровень МНО в необходимом диапазоне. Среди них зарекомендовал себя Coagucheck XS для самостоятельного проведения анализов и немедленного получения результатов ПТВ/МНО. Прибор позволяет получить точные результаты менее чем за минуту, используя при этом всего 8 мкл (одну каплю крови).
Тем не менее, независимо от выбранной стратегии антитромботического лечения после протезирования сердечных клапанов, принципиально важным остается регулярное наблюдение за пациентом, его обучение и тесное сотрудничество с лечащим врачом.
Это позволяет своевременно корректировать дозы препаратов, а также изменения их тромболитической активности в зависимости от особенностей питания, состояния функции печени и почек пациента.
Профилактика тромбоза у пациентов с биопротезами клапанов
Пациентам с биопротезами клапанов показана менее агрессивная антикоагулянтная терапия, поскольку в большинстве исследований риск тромбоэмболических осложнений у таких больных даже при отсутствии терпи антикоагулянтами составлял в среднем всего 0,7 %.
Таблица 2. Рекомендуемое значение МНО при биологических клапанах сердца
| Позиция клапана сердца | Факторы риска ТЭ-осложнений | |
| отсутствуют | присутствуют | |
| Аортальная | 2,0-2,5 | 2,5-3,0 |
| Митральная | 2,5-3,0 | 3,0-3,5 |
| Трикуспидальная | 2,5-3,0 | 3,0-3,5 |
В европейском руководстве использовать варфарин у таких больных рекомендуется только на протяжении первых 3 мес. после операции (целевое МНО — 2,5).
Длительная (пожизненная) антикоагулянтная терапия у пациентов с биопротезами клапанов может быть целесообразной только при наличии факторов высокого риска (например, мерцательной аритмии; в меньшей мере таким фактором риска может выступать сердечная недостаточность с ФВ ЛЖ
Одной из наиболее существенных проблем ведения таких пациентов в условиях отечественного здравоохранения является невозможность адекватного контроля показателей свертывания крови на фоне постоянного приема антикоагулянтов.

Информация для пациентов
Традиционным видом хирургического лечения пораженных клапанов сердца у нас в стране и за рубежом является замена их различными протезами.
 |  |  |
| Рис.1 Отечественный однодисковый протез « ЛИКС-2» | Рис.2-1 Отечественный двустворчатый протез « Карбоникс-1» | Рис.2-2 Двустворчатый протез фирмы Sulzer Carbomedics ( США) |
Имплантация механических протезов с самого раннего этапа сопровождалась частыми случаями развития нарушений мозгового кровообращения с глубокой инвалидизацией пациентов или их смертью, в связи с чем было выработано главное условие жизни больного с механическим протезом – прием препаратов, нарушающих процесс свертывания крови за счет снижения выработки белков коагуляции в печени. Целенаправленное избирательное подавление функции печени с этой целью достигалось назначением больному специфических веществ – производных кумарина. Лечение производными кумарина относится к так называемой антикоагулянтной терапии, а сами вещества названы непрямыми антикоагулянтами. Несколько десятилетий применения механических протезов дали не столь удовлетворительные результаты, как это ожидалось, вне зависимости от модели протеза. Главной проблемой после их имплантации остается высокая частота развития нарушений кровообращения в органах, в том числе в мозге, за счет отрыва от синтетических подвижных частей протеза мелких кровяных свертков, возможность образования которых существует даже при старательной и избыточной антикоагулянтной терапии. С другой стороны, медикаментозное углубление нарушений свертывания крови повышает риск кровотечений различной локализации, нередко фатальных. Поэтому у пациентов, имеющих язву желудка и двенадцатиперстной кишки, выраженную гипертоническую болезнь с опасностью мозговых кровоизлияний и пр. применение антикоагулянтов очень опасно.
В настоящее время можно с уверенностью утверждать, что попытки видоизменения механизмов крепления створок механических протезов, придание им подвижности, создание протеза из гибких синтетических структур и т.д. полностью исчерпали свои возможности в снижении частоты развития тромбоэмболических нарушений кровообращения, а применение антикоагулянтной терапии со всеми возможными ее осложнениями обязательно при любом механическом протезе.
Исчерпав резервы изменения моделей механических протезов в отношении снижения нарушений кровообращения, исследователи и клиницисты пытаются найти способы точного управления действием непрямых антикоагулянтов в надежде иметь возможность углубления антикоагулянтной терапии с минимизацией осложнений последней. С середины 80-х годов в странах Западной Европы и Северной Америки существует лабораторная система тестирования всех реактивов для выполнения анализа на степень глубины антикоагулянтной терапии ( реактивов для определения т.н. протромбинового индекса, времени, отношения) в сравнении с эталоном Всемирной Организации здравоохранения ( ВОЗ). Реактивы, чувствительность которых отличается от эталона ВОЗ более чем на 20%, считаются непригодными для применения. Остальные реактивы используются с корригирующим коэффициентом для определения современной формы выражения протромбинового времени – Международного нормализованного отношения ( МНО).
Наконец, фирмами-производителями механических протезов созданы персональные коагулометры, основанные на определении МНО с помощью полосок с сухими реагентами. Пациент сам или с помощью родственников осуществляет забор крови путем прокалывания подушечки пальца, наносит каплю крови на определенное место на полоске с реактивами, а затем вводит полоску в аппарат, на экране которого через 30-60 сек. выдается показатель МНО.
В кардиохирургической литературе сейчас с надеждой оценивают влияние новых методов контроля за терапией непрямыми антикоагулянтами на частоту возникновения нарушений мозгового кровообращения и длительность жизни пациентов с механическими протезами в целом.
Из выше изложенного можно заключить, что несмотря на все предпринимаемые меры, тромбообразование на механическом протезе остается высоко вероятным, а небезопасная сама по себе антикоагулянтная терапия обязательна для пациента с любым механическим протезом.
Теперь оценим российские условия жизни пациента с механическими протезами.
Что же касается проблем свертывания крови на протезе, все выше изложенные моменты можно полностью перенести на наши российские протезы, но с некоторыми национальными особенностями, которые изложены ниже.
Во – первых, в России существуют реальные трудности в точном определении протромбинового теста в том или ином варианте в связи с закупкой больницами самых разнообразных реагентов, зачастую весьма далеких от эталонов ВОЗ. Имеется порочная практика длительного хранения приготовленного реагента с целью экономии, в результате чего цифровое выражение протромбинового теста совершенно дезинформирует и больного, и лечащего врача. Определение же современной формы выражения протромбинового времени, т.е. МНО, выполняется еще в меньшем количестве лабораторий страны. В результате, получить достоверный анализ можно исключительно в больницах, где выполняются операции на сердце и верификации методики уделяется большое внимание. Из этого вытекает вторая особенность.
Во – вторых, если учесть, что таких больниц и центров в России лишь несколько десятков, то можно представить себе препятствия в получении анализа, которые носят территориальный характер.
В – третьих, в России непрямые антикоагулянты не производятся. Из недорогих препаратов имеется препарат фенилин производства Харьковского химфармзавода ( ХФЗ) и Таллинского ХФЗ. Несмотря на одинаковую дозировку, производимое действие препаратов заметно отличается. Мало того, мы замечали отличие и между разными сериями препарата одного и того же завода. Все это опять же требует приближения пациента к лаборатории, могущей дать оценку эффекта от приема препарата. К счастью, сейчас в России имеется в продаже высоко стандартизированный непрямой антикоагулянт варфарин фирмы Никомед, а также ввозятся в Россию индивидуальные коагулометры фирмы Зульцер, но стоимость этих продуктов несравнима с выше упомянутыми препаратами, и они недоступны для большинства россиян.
В – четвертых, осведомленность провинциальных российских врачей о принципах проведения терапии непрямыми антикоагулянтами совершенно недостаточна. Наша практика дает обилие примеров полного непонимания врачом, как соотносятся результаты анализа и дозировка препарата, какую тактику избрать при выполнении хирургических процедур у больного с приемом непрямых антикоагулянтов и т.д. В результате, больной сам должен глубоко разбираться в этом предмете, т.е. работает принцип — « спасение утопающих – дело рук самих утопающих».
За годы увлечения механическими протезами, годы надежд и разочарований, кардиохирургия шла вперед, снижая и снижая смертность, связанную с операцией, в результате чего повторное вмешательство на сердце стало обыденностью, выполняемой с риском, не отличающимся от первичной операции.
В новых условиях необходима переоценка наших взглядов на протезирование клапанов, заключающаяся в том, что качество жизни больного с протезом должно быть для нас более значимым, чем страх перед второй операцией, что кажущаяся надежность и долговечность механического протеза оборачивается заменой одной болезни на другую, иногда более опасную, чем первая. Вот почему мы предлагаем пациентам вернуться к имплантации протезов из биологических тканей. Эти протезы не требуют терапии непрямыми антикоагулянтами, современные методики обработки биоткани позволяют обеспечить нормальную работу протеза до 10-12, а иногда и до 20 лет, биологическая деградация протеза происходит постепенно, без возникновения критических ситуаций, подобно природному человеческому клапану, пораженному патологическим процессом. Заглянем в инструкцию к биологическому протезу Sulzer Mitroflow Synergy в раздел « Показания»: « …клапан предложен для использования у тех пациентов, которым нежелательна долговременная антикоагулянтная терапия по разным причинам, проживание в отдаленных областях, наличие болезней желудочно-кишечного тракта или других потенциальных источников кровоточивости, у которых ожидается хирургическая операция в других областях, у пожилых пациентов, и при прочих ситуациях, когда предвидятся трудности в проведении антикоагулянтной терапии по социальным или медицинским причинам». А есть ли вообще пациенты, которым показана имплантация механического протеза? Кто может знать, что ждет больного с механическим протезом в будущем, не возникнет ли у него язва желудка, не потребуется ли операция, не захочет ли молодая женщина родить ребенка? Жизнь с механическим протезом полна опасностей и ограничений.
Вот почему мы имеем в нашем арсенале и предлагаем больным большой набор заменителей клапанов, созданных из биотканей. Среди них ксеноартериальные ( рис.3) и ксеноперикардиальные ( рис.4) протезы бразильской фирмы BRAILE, биологические протезы фирмы Зульцер ( рис.5-1), ( рис.5-2), отечественные биопротезы « КемКор» ( г. Кемерово) ( рис.6) и, наконец, донорские гомографты оригинального производства ( рис.7).
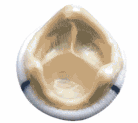 | 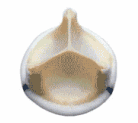 |  |
| Рис. 3 Биологический ксеноаортальный протез BRAILE ( Бразилия) | Рис.4 Биологический ксеноперикардиальный протез BRAILE ( Бразилия) | Рис. 5-1 Биологический ксеноперикардиальный протез Mitraflow Synergy ( США) |
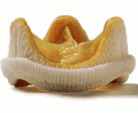 | 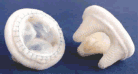 |  |
| Рис. 5-2 Биологический ксеноаортальный протез «LABCOR » ( США) | Рис.6. Отечественный биологический ксеноаортальный протез « КемКор» | Рис.7 Гомоаортальный трансплантат ( гомографт,аллографт) |
ООО «Центр Хирургии Сердца»
454047, Челябинск, Цветочный тупик, 2А
Что такое ксеногенный клапан
ДЛЯ ТОГО ЧТОБЫ СКАЧАТЬ СТАТЬЮ В ФОРМАТЕ PDF ВАМ НЕОБХОДИМО АВТОРИЗОВАТЬСЯ, ЛИБО ЗАРЕГИСТРИРОВАТЬСЯ
Имеющиеся осложнения, связанные с протезированием клапанов сердца, диктуют необходимость разработки новых методов создания протезов клапанов. Одним из таких методов является тканевая инженерия клапанов сердца. Клапаны, изготовленные с помощью тканеинженерного подхода, являются биосовместимыми, прочными, длительно служащими, не требуют антикоагулянтной терапии, а главное, способны к регенерации и росту вместе с ростом сердца реципиента. Наиболее развитым направлением тканевой инженерии клапанов сердца является их децеллюляризация, то есть создание бесклеточного матрикса, который можно заселить клетками-предшественницами пациента и трансплантировать. В данном обзоре рассмотрены основные способы и методы децеллюляризации, их качество и способность влиять на структурные и биомеханические свойства алло- и ксенографтов.
Структура клапана сердца
Тканеинженерные подходы к созданию клапанов сердца
Децеллюляризация клапанов сердца
Способы децеллюляризации матрикса
Тритон Х-100 (октилфенилполиоксиэтилен) – неионный детергент, используемый в биохимических реакциях как вещество для солюбилизации мембран. Структура тритона Х-100 очень похожа на структуру IGEPAL CA630, и эти два названия часто используются как синонимы. Однако молекула тритона обладает более выраженными гидрофильными свойствами, поэтому для многих реакций они не являются взаимозаменяемыми. Тритон Х-100 является детергентом выбора, так как обладает способностью мягко солюбилизировать мембраны клеток без денатурирующей активности. Для децеллюляризации используется 0,5% или 1% раствор.
Использование в клинической практике
Последнее десятилетие стало прорывом в области тканевой инженерии клапанов сердца, что привело к первым результатам использования таких клапанов в клинической практике, в первую очередь в детской кардиохирургии. Следует отметить, что все сообщения подобного характера касаются имплантации бесклеточных матриксов, изготовленных методом децеллюляризации, или трансплантации тканеинженерных клапанов на основе тех же матриксов, совмещенных с клетками.
В целом, положительные результаты клинического применения децеллюляризованных ксено- и аллографтов вселяют надежду на дальнейшее развитие данного направления в тканевой инженерии и совершенствование протоколов децеллюляризации клапанов сердца, которое позволит более широко использовать материал в лечении пациентов кардиологического профиля.
Заключение
Таким образом, тканеинженерные разработки в части создания клапанов сердца нацелены на получение функционального бесклеточного матрикса с использованием оптимальных протоколов децеллюляризации и его совмещение с ЭК и ИК с получением графта, способного к регенерации и росту и обладающего структурными и биомеханическими свойствами, соответствующими нативному клапану сердца. Однако наличие большого количества протоколов децеллюляризации свидетельствует об отсутствии универсальной оптимальной методики, минимально влияющей на ЭЦМ исходного тканевого материала. Для успешной разработки и внедрения в клиническую практику оптимальных тканеинженерных клапанов необходимо дальнейшее совершенствование протоколов децеллюляризации и накопление опыта исследований in vivo.
Что такое стеноз аортального клапана?
Строение и функция
Клапан аорты состоит из трех полулунных лепестков (левого, правого и заднего). Расположен он в устье левого желудочка в аорте (т. е. основной артерии). Во время систолы лепестки расширяются, позволяя перекачивать кровь из левого желудочка сердца в аорту. Сразу после окончания систолы лепестки клапанов закрывают устье левого желудочка, таким образом предотвращая обратный ток крови из аорты в сердце.
Стеноз аортального клапана обычно является приобретенным нарушением. Его развитию способствуют, в частности:
Наиболее частой причиной врожденного стеноза аортального клапана у детей является двустворчатый клапан, который быстрее подвергается дегенерации, чем клапан с правильной структурой.
Последствия
Сужение пути оттока из левого желудочка сердца сопровождается повышением систолического давления в левой камере. Сердечная мышца, чтобы кровь прошла через суженное устье, должна генерировать большую силу сокращения. Это является причиной гипертрофии левого желудочка сердца и удлинения времени выброса крови.
Со временем сократительная активность подвергается нарушению. Снижение сократительной способности миокарда левого желудочка влияет на уменьшение величины фракции выброса крови. Этот параметр оценивается трансторакальной эхокардиографией, которая сообщает о количестве крови, проходящем через сердце во время одного сокращения. Гипертрофия миокарда затрудняет поддержание коронарного потока (что может быть причиной ишемии миокарда).
Пациент может ощущать следующие симптомы, связанные со стенозом аортального клапана и его последствиями:
Симптомы стеноза аорты могут давать серьезные осложнения. Одним из них является отек легких. Давление крови в сердце меняет этот показатель в сосудах легких. Это вызывает застойные явления и трудности с дыханием. Если не начать лечение, левый желудочек сердца может увеличиться. Это уменьшает возможность камеры перекачивать кровь.
Может появиться аритмия сердца. Некоторые аритмии желудочков могут вызвать остановку сердца, например, при фибрилляции желудочков, камеры начинают двигаться совершенно хаотично, что препятствует выполнению правильной работы сердца.
Диагностика
Характерные симптомы болезни наблюдаются при прослушивании сердца пациента, особенности гипертрофии левого желудочка сердца видны на ЭКГ и на снимке рентгеновского исследования. Исследованием, которое с наибольшей вероятностью позволяет определить стеноз клапана аорты, является эхокардиография. Она позволяет оценить тяжести дефекта, фракции выброса. Степень нарушений определяется благодаря допплеровскому исследованию, которое позволяет измерить максимальную скорость потока крови через клапан и градиент давления между левой камерой и аортой. Эхокардиография выполняет измерение площади аортального клапана (в правильных условиях эта площадь составляет около 3-4 см²).
На основе результата выделяются следующие степени стеноза:
Применяемое лечение
Стеноз аортального клапана может развиваться несколько лет и долго оставаться бессимптомным, однако появление первых симптомов (учащенное сердцебиение, боли в сердце, обмороки) значительно ухудшает прогноз для пациента. Поэтому больные с плотным аортальным стенозом нуждаются в незамедлительном профессиональном лечении в операционных условиях. В хирургическом вмешательстве нуждаются и пациенты с плотным бессимптомным стенозом, если:
Оперативное лечение подразумевает имплантацию протеза на место аортального клапана. Оно требует открытия грудной клетки, остановки сердца, применения сердечно-легочного шунтирования и разреза стенки сердца.
Этот протез является менее прочным, значит, такого рода операция не может быть выполнена у молодых пациентов. Так что в настоящее время, этот метод лечения используется для пожилых людей. Результаты лечения являются весьма положительными.
Искусственные шунты сердца, используемые в кардиохирургии, делятся на механические и биологические.
Механические состоят из одного или двух дисков, которые открываются или закрываются в зависимости от систолы и диастолы сердца. Большим преимуществом данного типа имплантатов является их очень длительный срок службы (в большинстве случаев они работают до конца жизни пациента), поэтому не требуется повторная операция по замене искусственного шунта, как это имеет место при биологических клапанах. Недостатком механических шунтов является необходимость применения антикоагулянтных средств в течение всей жизни пациента.
Биологические можно разделить на ксеногенные и гомогенные клапаны.
Показания к имплантации
Механический шунт рекомендуется имплантировать следующим пациентам:
Пациенты, у которых можно применить биологический шунт:
Прием антикоагулянтных препаратов
Пациентам после имплантации механического шунта сердца требуется прием антикоагулянтных средств до конца жизни, потому что существует большой риск возникновения тромбов в пределах имплантата. После имплантации биологического шунта лечение с помощью антикоагулянтов следует проводить в течение первых трех месяцев.
К антикоагулянтным средствам относятся варфарин и аценокумарол.
Указанные препараты блокируют действие витамина K в печени, который участвует в процессах создания факторов свертывания крови. Это приводит к удлинению времени свертывания крови. Антикоагулянты начинают работать в течение 4-5 дней с момента принятия первой дозы.
Рекомендуется проведение первого контрольного исследования у пациентов после операции по замене клапана аорты после 6 недель со дня операции.
Схема диагностики включает в себя осмотр пациента врачом, выполнение ЭКГ, эхокардиографии, рентгенографии грудной клетки, а также исследования крови. Пациенты с биологическим шунтом сердца должны быть под более тщательным медицинским контролем из-за возможности появления дегенеративных изменений в области сердца. У таких людей рекомендуется выполнение ежегодного эхокардиографического исследования спустя 5 лет после операции.
Осложнения и прогноз
Осложнения стеноза аорты встречаются редко. К ним относятся застойные явления крови, вызванные тромбированием или кальцификацией лепестка клапана, а также инфекционный эндокардит (это касается в основном пациентов молодого возраста).





