Что такое кожная аутосенсибилизация
Что такое кожная аутосенсибилизация
— Острое заболевание, провоцируется инфекцией, застойным и контактным дерматитом, ионизирующей радиацией, тупой травмой и оставшимся после операции шовным материалом.
— Распространенные, зудящие, папуловезикулезные высыпания, чаще всего на конечностях.
— Сопутствующие признаки являются признаками способствующего аутосенсибилизации заболевания.
— Патоморфологическая картина не имеет диагностического значения и проявляется острым спонгиотическим процессом в эпидермисе с поверхностным, периваскулярным, лимфогистиоцитарным инфильтратом в дерме, содержащим единичные эозинофилы.
а) Эпидемиология. Аутосенсибилизирующий дерматит — феномен, в результате которого острый дерматит развивается в виде поражения кожи на удалении от воспалительного очага, а вторичный острый дерматит не объясним причиной, вызвавшей первичное воспаление. Классическая картина аутосенсибилизации наблюдается у пациентов с венозной застойной болезнью, где не менее чем у 37% пациентов развивается по крайней мере хотя бы один эпизод аутосенсибилизации, а также среди больных дерматофитией, 4-5% которых страдают реакциями по типу дерматофитид.
б) Этиология и патогенез. Термин «аутосенсибилизированный дерматит» был предложен Уайтфельдом (Whitfield) в 1921 г. для описания картины реакций, начиная от генерализованных, эритематозных, кореподобных и уртикарных высыпаний после тупой травмы до генерализованного, петехиального, папуловезикулезного дерматита вследствие острого раздражения при хроническом статическом дерматите.
Следовательно, в эту рубрику могут быть включены везикулезные Id-реакции, вызванные туберкулезом, гистоплазмозом, дерматофитией и бактериями. Такие неэкзематозные реакции, как многоформная эритема и нейтрофильный лобулярный панникулит, также рассматривались как следствие аутосенсибилизации, связанной с различными инфекциями.
К другими факторам, способствующим этому феномену, относятся применение раздражающих или сенсибилизирующих химикатов, ионизирующая радиация и шовный материал, оставшийся после операции.
Хотя первоначально считалось, что это заболевание развивается вследствие аутосенсибилизации к эпидермальным антигенам, экспериментально эта концепция не была подтверждена. В исследованиях на мышах, с целью определения роли белков кератиноцитов как антигенных переносчиков для гаптена, Fehr и соавт. получили клоны Т-клеток CD4+ Т-клеточного рецептора α/β, ограниченные по системе главного комплекса гистосовместимости, которые пролифелировали в ответ на воздействие экстрактов кератиноцитов, не сопряженных с гаптеном.
В этих исследованиях такие аутореактивные клоны Т-клеток нельзя было получить после обработки ирритантами. Тем не менее авторы предположили, что Т-клетки, аутореактивные к антигенам кератиноцитов, могут генерироваться во время контактной гиперчувствительности и приводить к развитию Id-реакции.
В одном из исследований с самым большим на сегодня количеством участников, только у 4 из 81 пациента с аутосенсибилизированным дерматитом были выявлены сывороточные антитела с цитотоксичностью к аутологовой или гомологичной коже. Однако роль таких антител в развитии заболевания, даже в этих 4 случаях, должна интерпретироваться с осторожностью, учитывая высокую частоту эпидермальных аутоантител у здорового взрослого населения.
В одном из экспериментов, в котором морским свинкам выполнялась инъекция аутологичной кожи, Wilhelmj и соавт. выявили дерматит у 2 из 11 животных, однако было не ясно, являлась ли эта реакция иммунологической, и что же могло служить причинным аллергеном (аллергенами). Другие исследователи, используя подобные методики, не смогли индуцировать кожного заболевания у животных путем введения эпидермального экстракта. В противоположность этому, у 19 из 24 пациентов с активной сенсибилизацией реакция развилась после внутридермального введения водного экстракта аутологичных эпидермальных клеток.
Термин аутосенсибилизация является, по сути, неточным. Болезнь чаще всего развивается вследствие гиперреактивности кожи, индуцированной либо иммунологическими, либо неиммунологическими факторами. Такие факторы, как раздражение, сенсибилизация, инфекция и травма, которые вызывают аутосенсибилизацию, способствуют высвобождению различных эпидермальных цитокинов. После гематогенной диссеминации в достаточных количествах эти цитокины могут повышать чувствительность кожи к целому ряду неспецифических и при прочих условиях безвредных стимулов, создавая картину «запредельной» реакции, обозначаемой классическим термином аутосенсибилизация. Такая гипотеза объясняет:
а) результат тестирования с аутологичными эпидермальными клетками в форме гиперчувствительности замедленного типа у людей,
б) гистопатологические признаки заболевания и
в) наличие активированных Т-лимфоцитов, которые иногда наблюдаются в крови пациентов с аутосенсибилизацией.
Характерное распределение высыпаний при заболевании можно было бы также объяснить, если бы было обнаружено, что кожа верхних и нижних конечностей содержит больше рецепторов различных цитокинов, чем кожа лица и кистей, или что в данных участках кожной поверхности эти рецепторы более авидные. Такой «географический» вариант распределения антигена буллезного пемфигоида действительно наблюдался, в связи с чем была выдвинута гипотеза, что этим и объясняются клинические проявления данного иммунного заболевания. Возможно, современные биотехнологии помогут объяснить загадку аутосенсибилизации.
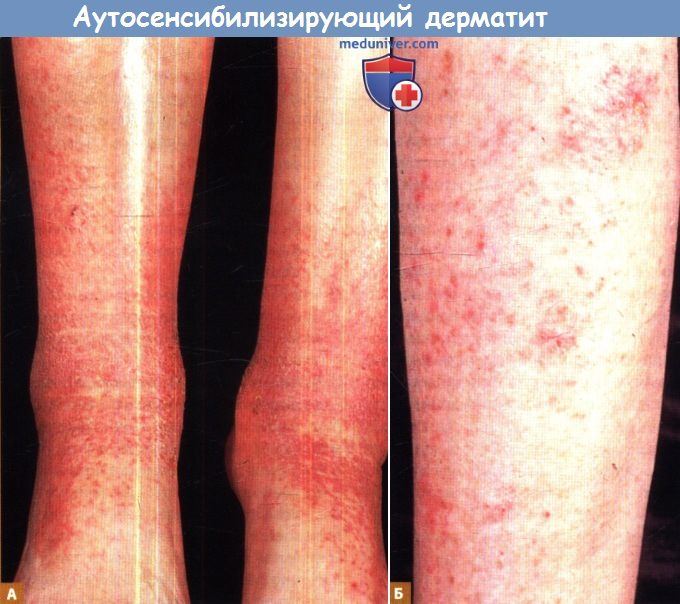
У пожилой женщины с длительным анамнезом застойного дерматита отмечается постепенное нарастание отека,
кожный зуд и множественные, точечные, поверхностные, экскориированные язвы, расположенные в области медиальной лодыжки (А).
Спустя девять дней после образования язв развились острые, интенсивно зудящие, эритематозные, папуловезикулезные высыпания на предплечьях (Б),
которые прогрессируют и распространяются на плечи, туловище и кисти.
Кроме того, острый папуловезикулезный дерматит может поражать нижние конечности, а также наслаиваться на хронический застойный дерматит (А).
в) Клиника аутосенсибилизирующего дерматита. В типичных случаях через 1-2 недели после острого воспаления развиваются сильно зудящие, симметричные, диссеминированные, эритематозные высыпания в форме пятен, папул и везикул. Высыпания в порядке убывания частоты поражают предплечья, бедра, голени, туловище, лицо, кисти, шею и стопы. Во время эволюции дерматита его морфологические изменения зависят от возрастающей хронизации процесса (например, от везикул до чешуек).
Гистопатологические признаки не патогномоничны: спонгиотические эпидермальные везикулы в сочетании с поверхностным, периваскулярным, лимфогистиоцитарным дермальным инфильтратом, который содержит рассеянные эозинофилы. При иммунофенотипических исследованиях кожи было выявлено, что большиство лифоцитов в эпидермисе — это CD3+ и CD8+ Т-клетки, а в дерме — преимущественно клетки CD4+. У большинства лиц с аутосенсибилизацией в пораженной коже отложения антител или комплемента не обнаружены.
Как упоминалось выше, также существуют сообщения о неэкзематозных типах аутосенсибилизации. По имеющимся данным как многоформная эритема, так и нейтрофильный лобулярный панникулит могут быть индуцированы различными инфекционными процессами. Гистологическая картина в этих случаях соответствует изменениям, свойственным многоформной эритеме или лобулярному панникулиту.
г) Дифференциальный диагноз аутосенсибилизирующего дерматита:
1. Наиболее вероятный:
— Аллергический контактный дерматит
— Ирритантный контактный дерматит
— Атопический дерматит
— Нумулярный дерматит
2. Следует учесть:
— Полиморфный фотодерматит
— Розовый лишай
— Эруптивный (каплевидный) псориаз
3. Необходимо исключить:
— Инфекционные заболевания
— Дерматофитии
— Чесотку и другие клещевые дерматозы
— Вирусные экзантемы
— Токсидермию
д) Прогноз и течение. Заболевание часто персистирует и распространяется до устранения причинного первичного воспаления.
е) Лечение аутосенсибилизирующего дерматита. Лечение считается наиболее успешным, когда направлено на основное заболевание. Часто выраженность мокнущих, везикулезных высыпаний при аутосенсибилизации снижается после применения подсушивающих средств, таких, как сульфат алюминия и ацетат кальция.
Учитывая вероятное участие цитокинов и модиаторов воспаления, чувствительных к глюкортикостероидам и макролактамам, может помочь системное и/или местное лечение этими препаратами.
Чтобы предупредить появление вторичных эффектов экскориаций, необходимо контролировать кожный зуд местными противозудными средствами или пероральными антигистаминными препаратами.
Однако местные препараты следует применять осторожно, учитывая возможность провокации местными средствами аллергической реакции в уже страдающей дерматитом коже.
Что такое кожная аутосенсибилизация
ФГБОУ ВО «Ярославский государственный медицинский университет» Минздрава России, Ярославль, Россия, 150000
К вопросу классификации и патогенетической терапии дерматитов различного генеза, атопического дерматита и экземы
Журнал: Клиническая дерматология и венерология. 2018;17(2): 100-107
Завадский В. Н. К вопросу классификации и патогенетической терапии дерматитов различного генеза, атопического дерматита и экземы. Клиническая дерматология и венерология. 2018;17(2):100-107.
Zavadsky V N. Classification and pathogenetic therapy of dermatitis of various origins, atopic dermatitis, and eczema. Klinicheskaya Dermatologiya i Venerologiya. 2018;17(2):100-107.
https://doi.org/10.17116/klinderma2018172100-107
ФГБОУ ВО «Ярославский государственный медицинский университет» Минздрава России, Ярославль, Россия, 150000
Патогенетическая терапия атопического дерматита (АтД) и экземы — актуальная задача. Считается, что АтД — аутоиммунное заболевание; в частности, обнаружены аутоантитела к тканевым антигенам кожи. Контактная экзема развивается из контактного дерматита (шифр общий с ним) и отличается от него не элементами сыпи, а особенностью течения — тенденцией к спонтанным рецидивам, что указывает на формирование аутоиммунного процесса. Кроме того, для экземы характерно появление аутосенсибилизации (экзематидов). Цель исследования — оценить патогенетическую направленность и эффективность иммуномодулирующей мезотерапии (ИММТ) при АтД и экземе. Материал и методы. В исследовании участвовали 212 пациентов, в том числе с АтД 142 человека (включая 43 подростка 14—18 лет и 12 детей старше 8 лет); с экземой — 70 (контактная экзема у 49 больных, себорейная у 14, инфекционная у 7). Распределение по полу примерно одинаковое. Всем больным проведено клиническое исследование общего состояния и поражения кожи. Лечение — иммуномодулирующая мезотерапия (ИММТ). Суспензию глюкокортикоида пролонгированного действия, в минидозе — 7 мг бетаметазона либо 40 мг триамцинолона — разводили в 5—10 раз физраствором натрия хлорида и вводили внутрикожно в очагах поражения, однократно или 1 раз в месяц и реже (создание депо иммуномодулятора). Результаты. Ремиссия у всех больных начиналась уже в первые 2—3 дня и продолжалась 3—4 нед. При АтД требовалось провести 3—4 ИММТ с интервалом 1—1,5 мес для устойчивой (до 1 года) и достаточно хорошей ремиссии у 55—82% пациентов (р=0,05). При контактной экземе наступала полная и продолжительная ремиссия (1—3 года) после 2 процедур ИММТ у 67—89% пациентов (р=0,05). Заключение. Достаточно продолжительные и устойчивые ремиссии при АтД и экземе наступали после избирательно кожного, иммуномодулирующего лечения в виде монотерапии (разовой или пульсовой ИММТ). Этот факт может означать, что аутоиммунный процесс, отмечаемый при АтД и экземе, представляет собой органоспецифическое аутоиммунное поражение кожи (и слизистых оболочек при АтД). Патологию желудочно-кишечного тракта и верхних дыхательных путей у больных АтД следует отнести к ассоциированным заболеваниям. Они, видимо, провоцируются реактивным воспалением слизистых оболочек, на фоне характерного для АтД сосудистого вегетоневроза с нарушением микроциркуляции, а также связаны с присоединением инфекции.
ФГБОУ ВО «Ярославский государственный медицинский университет» Минздрава России, Ярославль, Россия, 150000
Международная статистическая классификация болезней (МКБ-10) стала обязательной. Она принципиально отличается от традиционной, «клинической» классификации тем, что определяющим критерием в ней являются, по умолчанию, вероятная причина, механизм и динамика заболевания. Это соответствует патогенетическому направлению современной «доказательной медицины». Заметим, что корифеи отечественной дерматологии всегда призывали постигать сущность процесса, а «не жонглировать папулами и чешуйками»! Патогенетический принцип МКБ-10 распространяется, по факту, и на содержание базовых терминов «дерматит» и «экзема». Термин «дерматит» в МКБ-10 означает вообще воспалительное поражение кожи, и он обязательно должен дополняться указанием на вероятную причину или механизм поражения. Например, L23. Аллергический контактный дерматит, L24. Ирритантный (раздражительный) контактный дерматит. А дерматит «не топический» (дословно: не местный по происхождению, άτοπη) обозначается L20. Атопический дерматит. По современным представлениям, атопический дерматит (АтД) – генетически обусловленное, аутоиммунное заболевание. При АтД выявлены генные дефекты в отдельных локусах некоторых хромосом, что может вести к нарушению «дермального ответа» [1]. Обнаружены также аутоантитела к тканевым антигенам кожи (кератину, коллагену, эластину) и установлена прямая корреляция между ними и тяжестью течения АтД [2, 3]. Не следует отождествлять генетическую предрасположенность к АтД (эндогенный фактор!) с триггерами (провоцирующими факторами). Триггеры могут быть как экзогенными (аллергены, ирританты), так и эндогенными (сопутствующая общая патология); соотношение между ними меняется и варьирует индивидуально. В МКБ-10 предусмотрена диагностика клинических вариантов АтД. Это L20.8. Другие атопические дерматиты:
атопическая экзема и атопический нейродермит (локализованный и диффузный). Атопическая экзема и нейродермит различаются по механизму микроциркуляторных изменений в коже. Соответственно: экссудация/сухость, отек/лихенизация, зуд слабый/сильный, реакция адренергическая/холинергическая, дермографизм красный/белый. Дермографизм служит наглядным и удобным маркером. Варианты АтД могут проявляться либо как стадии (чередуясь), либо как устойчивые формы заболевания. Еще один вариант АтД — L20.9. Атопический дерматит неуточненный. Обычно это переходное состояние между двумя вышеназванными вариантами АтД. Дермографизм в этом случае смешенный или практически не выявляется. Довольно часто рассматривают АтД упрощенно — как синоним нейродермита, игнорируя тем самым экзематозный вариант. Однако Европейская ассоциация аллергологов и клинических иммунологов (EACCI, 2001) рекомендует указывать в диагнозе атопическую экзему.
Контактные дерматиты в отличие от АтД не рецидивируют, если устранен контакт с индуцирующим агентом. Но если контакты периодически повторяются, то это приводит к нарушению иммунных реакций кожи [5]. Возможно появление L30.2. Кожной аутосенсибилизации (экзематидов). Но, главное, может измениться течение дерматита, который приобретет склонность к спонтанным рецидивам (без участия индуцирующего агента, под влиянием различных провоцирующих факторов). Эти изменения указывают на формирование аутоиммунного процесса и означают, что аллергический или ирритантный дерматит трансформировался в качественно новое состояние, которое обозначается термином «экзема» [4, 5—7]. Впрочем предполагается, что для развития экземы человек должен быть к ней генетически предрасположен [4]. Для контактной экземы сохраняются шифр и название предшествующего дерматита, как свидетельство динамики патологического процесса: L23. Аллергическая контактная экзема, L24. Ирритантная контактная экзема, L25. Неуточненная контактная экзема. Таким образом, от предшествующего дерматита экзема принципиально отличается хроническим, спонтанно рецидивирующим течением, тогда как поражение кожи нередко оказывается сходным: поверхностный эпидермодермит, склонный к эволюционному полиморфизму элементов сыпи. Трансформироваться в экзему могут дерматиты, вызванные не только химическими факторами, но также физическими, биологическими. Например, L30.3. Инфекционный дерматит, L30.8. Другие уточненные дерматиты, L30.9. Дерматиты неуточненные, — иногда тоже предшествуют экземе. В отличие от контактных экзем атопическая экзема является вариантом АтД (наряду с нейродермитом), имеет эндогенное происхождение и чаще всего начинается в детстве.
Следует заметить, что в пояснении [Note] к блоку Dermatitis and eczema (L20—L30) в оригинальном тексте МКБ-10 сказано, что термины дерматит и экзема чередующиеся [interchange], т. е. они переходящие, преемственные. В распространенном русском переводе используется выражение «взаимозаменяемые», хотя тогда было бы interchangeable. Краткость формулировки, которую действительно можно понять, по-разному, и отсутствие комментариев породили не только вопросы, но и попытку определять термин «экзема» только по элементам сыпи [8], не учитывая главное — его патогенетическую сущность. Понятие экзема отражает динамику, трансформацию процесса (по сравнению с предшествующим дерматитом). Локальный статус описывают по элементам сыпи, а нозологическую форму определяют по критериям, принятым в классификации (МКБ-10). В общем «клинике — клиническое, а нозологии — нозологическое». В диагностике рекомендуется нозологический принцип [13, 14].
Цель исследования — оценить информативность МКБ-10 (блок L20-L30) и ее соответствие клиническим задачам практического врача. Апробировать иммуномодулирующую мезотерапию (ИММТ) при АтД и экземе и оценить ее эффективность и патогенетическую направленность.
Материал и методы
Объект исследования — больные АтД и экземой, всего 212 человек. L20 АтД у 142 человек (69 мужчин, 73 женщины); из них: взрослых (19—40 лет) 87, подростков (14—18 лет) 43, детей (8—13 лет) 12. Варианты АтД: L20.8. Атопический нейродермит локализованный (локтевые и подколенные сгибы, запястья) — 43 человека (включая 17 подростков и детей); L20.8. Aтопический нейродермит диффузный (выходящий за пределы «излюбленной локализации») — 64 человека (включая 20 подростков и детей); L20.8. aтопическая экзема — 25 человек (включая 12 подростков и детей). L20.9. АтД неуточненный — 10 человек (включая 6 подростков).
Экзема (исключая атопическую экзему) у 70 человек (31 мужчина, 39 женщин): L23. Аллергическая контактная экзема — 11 взрослых (5 мужчин, 6 женщин;); L24. Ирритантная контактная экзема — 8 (4 мужчины, 4 женщины; взрослые); L25. Неуточненная контактная экзема — 30 (13 мужчин, 17 женщин; взрослые); L30.3. Инфекционная экзема — 7 человек (3 мужчин, 4 женщины; взрослые); L21. Себорейный дерматит/экзема — 14 человек (6 мужчин, 8 женщин; взрослые).
Метод оценки тяжести кожного поражения (интенсивность, распространенность) — индекс SCORAD [9]. К исследованию не привлекались больные с тяжелым поражением кожи, например с эритродермией.
Методы оценки общего состояния пациентов: клинические анализы крови, мочи; УЗИ внутренних органов. Больных консультировали врачи-специалисты. Выявленные очаги хронической инфекции (зубной кариес, синусит, тонзиллит, холецистит и т. д.) санировали. Больные с тяжелой общей патологией в исследовании не участвовали.
Метод лечения — иммуномодулирующая мезотерапия (ИММТ) [10]; единичные либо пульсовые процедуры. Внутрикожно, в очагах поражения создавали депо глюкокортикоида пролонгированного действия в минидозе (бетаметазон, 7 мг либо триамцинолон, 40 мг) — не чаще 1 раза в месяц. Предварительно суспензию указанного препарата разводили физраствором хлорида натрия в 5—10 раз. Суммарная доза глюкокортикоида не выше, чем при мазевой терапии. Считается, что минидозы глюкокортикоида в коже блокируют белок-активатор (АР) и ядерные факторы активированных Т-клеток (NF-AT) и транскрипции генов (NF-kB), ингибируя, тем самым активность провоспалительных интерлейкинов, цитокинов [11]. Никакого другого лечения не проводилось. Исключение составляли больные с микробной экземой, которым назначали (перед ИММТ или одновременно) бициллин-5 или цефтриаксон.
Метод статистической обработки — определение доверительных границ частоты случаев (при р=0,05), в процентах, по специальным таблицам для малых выборок [12]. Вероятность ошибки (р=0,05) может составлять ±5%.
Результаты
L20 АтД. После однократной ИММТ уже в первые 2—3 дня наблюдалось явное улучшение у всех пациентов. Исчез или значительно ослабел зуд, прекратились травмирующие расчесы, уменьшилось воспаление в очагах поражения. В течение 1 нед установилась ремиссия, продолжительность которой варьировала при разных вариантах АтД.
L20.8 АтД локализованный (локализованный нейродермит). Улучшение после однократной ИММТ нарастало в течение 1 нед и наступившая ремиссия продолжалась не менее 3—4 нед (рис. 1) 
L20.8 АтД диффузный (диффузный нейродермит). Острота поражения снималась после однократной ИММТ уже в 1-ю неделю. Удовлетворительное состояние кожи — без приступов зуда и без выраженного воспаления охранялось 3—4 нед у большинства больных (49 из 64 = 65—87%; р=0,05). Однако для поддержания достигнутого эффекта требовалось через 3—4 нед повторить ИММТ. После двукратной ИММТ достаточно удовлетворительное состояние кожи (рис. 2) 
L20.8 АтД по типу атопической экземы и L20.9 АтД неуточненный. После онократной ИММТ, через 3 дня практически у всех больных наблюдался хороший клинический эффект (рис. 3). 
Контактная экзема: L23. Аллергическая контактная экзема (рис. 4), 

L21. Себорейный дерматит/экзема. Поражение регрессировало после однократной ИММТ (рис. 6). 
L30.3. Инфекционная (микробная) экзема. Хороший эффект наблюдался при сочетании бициллина-5 (или цефтриаксона) с однократной ИММТ (7 из 7 = 64—100%; р=0,05).
Побочное действие ИММТ. Общего побочного действия не наблюдалось. Этому, вероятно, способствует принцип мезотерапии (M. Pisor): нужный препарат вводится «мало, редко, внутрикожно, в нужное место». Местное побочное действие встречалось примерно у 1% пациентов в виде небольшого участка субатрофии кожи с западением на месте инъекции. Предупреждение косметического дефекта от инъекций: а) достаточное разведение препарата физраствором натрия хлорида в 5—10 раз; б) инъекции, по возможности, делать на менее заметных участках в зоне поражения либо регионарно (например, за ушами — при наличии очагов на лице).
Обсуждение
МКБ-10 является обязательной. Она достаточно информативна и соответствует современному, патогенетическому направлению в диагностике и лечебно-профилактической работе. В МКБ-10 представлены нозологические формы заболеваний (номенклатурные единицы), формулировка которых обязательна в диагнозе. Обозначение клинических вариантов тоже предусмотрено, для чего имеются подпункты «Другие…». Например, L20.8. Другие атопические дерматиты. МКБ-10 ориентирует врача не только на патогенетическое лечение, но и на целенаправленную профилактику, а также на привлечение специалистов-консультантов к решению возникших проблем. Очевидно, поэтому требуется указывать в диагнозе контактного дерматита его конкретную причину (красители, пластик, косметика и т. п.).
Современные исследования позволяют считать, что АтД-аутоиммунное заболевание [2, 3]. Соответственно, это относится и к вариантам АтД: к L20.8. Атопическая экзема и Атопический нейродермит. Клиническими признаками аутоиммунных реакций являются особенности течения (!) болезни: тенденция к спонтанным рецидивам (на фоне торпидного процесса) и появление экзематозной аутосенсибилизации (экзематидов). Указанные особенности течения характерны не только для АтД, но и для контактных экзем: аллергической (L23) и ирритантной (L24) [4—7]. Именно эти характерные особенности течения позволяют отличить экзему от предшествующего ей контактного дерматита. Элементы сыпи (локальный статус) предшествующего дерматита и экземы могут выглядеть одинаково или сходно, но употреблять термины дерматит и экзема в качестве «взаимозаменяемых» («синонимов») вряд ли уместно, разве что в предварительном диагнозе, под знаком вопроса. Эти термины обозначают понятия качественно разного уровня.
Анализ результатов ИММТ дает основание уточнить некоторые особенности патогенеза АтД и экземы. ИММТ применялась как монотерапия, которая была избирательно направлена на очаги кожного поражения, где внутрикожно депонировали иммуномодуляторы. Делалось это однократно или редко (1 раз в месяц или реже), причем в минидозе (чтобы свести к минимуму возможность общего воздействия). Тем не менее ИММТ вызывала быструю, достаточно полную и устойчивую ремиссию у большинства больных АтД и экземой. (Кстати, даже наружная кортикостероидная терапия, хотя она менее эффективна, чем ИММТ, в легких случаях оказывает вполне достаточный эффект.) В этой связи можно сделать вывод, что аутоиммунный процесс при АтД и экземе (наличие которого подтверждается многими данными) протекает по типу органоспецифического аутоиммунного поражения кожи (с распространением при АтД на слизистые оболочки желудочно-кишечного тракта и верхних дыхательных путей). При АтД (нейродермите и атопической экземе) этот процесс во многом более торпидный, чем при контактной экземе. Не исключено, что при контактной экземе аутоиммунные реакции могут носить обратимый характер; во всяком случае наблюдались многолетние ремиссии при прекращении контакта с индуцирующим агентом. Итак, органом-мишенью при АтД и экземе является кожа (и отчасти, слизистые оболочки — при АтД). Что касается общей патологии, то она может наблюдаться при АтД и создавать картину системного заболевания, однако она не связана с аутоиммунным процессом (хотя попытки найти антитела к внутренним органам делались [2]). Общие нарушения при АтД, вероятно, можно рассматривать как проявление ассоциированных заболеваний. Соответственно, рекомендуется диагностировать их и лечить как отдельные нозологические формы [13, 14]. Заметим, что подобное сочетание органоспецифического аутоиммунного процесса с неаутоиммунными ассоциированными болезнями — нередкое явление. Например, сахарный диабет 1-го типа — органоспецифическое аутоиммунное заболевание, часто сопровождается различной неаутоиммунной патологией [15]. Поражение желудочно-кишечного тракта и верхних дыхательных путей при АтД может сформироваться вследствие реактивного воспаления слизистых оболочек, на фоне характерного для АтД сосудистого вегетоневроза, и за счет присоединения инфекции. Предрасположенность к указанной патологии, возможно, связана частично с общностью эмбрионального развития иммунной системы кожи и желудочно-кишечного тракта. Кроме того, кожа и нервная система — производные эктодермы. Сосудистый вегетоневроз способствует нарушению микроциркуляции в коже и слизистых оболочках, поддерживая воспаление.
Механизм локального действия минидоз глюкокортикоидов в основном известен [11]. В частности, они блокируют в коже (в органе-мишени) нуклеарный фактор активированных Т-клеток (NF-AT), а также — белок-активатор (АР) и нуклеарный фактор транскрипции генов (NF-κВ). Тем самым, ингибируется транскрипция зависимых генов, ответственных за образование провоспалительных цитокинов и интерлейкинов. Кроме того, тормозится процесс активации Т-клеток и снижается их «дерматотропность». Таким образом, ИММТ можно рассматривать как патогенетический метод лечения АтД и экземы.
Вывод
МКБ-10 (блок L20—L30) достаточно информативна для практической работы врача и имеет патогенетическую направленность, необходимую при современном решении вопросов диагностики, лечения, профилактики. Иммуномодулирующая мезотерапия (ИММТ), которая заключается в депонировании минидозы глюкокортикоида внутрикожно, в очагах поражения, однократно или не чаще 1 раза в месяц, обеспечивает быструю, длительную (от 1 мес до года и дольше) и достаточно полную ремиссию у подавляющего большинства больных с АтД и экземой. ИММТ может рассматриваться как патогенетический способ лечения АтД и экземы. Избирательно кожная, иммуномодулирующая монотерапия (ИММТ) при АтД и экземе оказалась достаточно эффективной, что позволяет рассматривать аутоиммунный процесс, отмечаемый при этих заболеваниях, как органоспецифическое поражение кожи (и слизистых оболочек при АтД). Патология желудочно-кишечного тракта и верхних дыхательных путей при АтД относится к ассоциированным заболеваниям. Вероятно, она провоцируется реактивным воспалением слизистых оболочек и характерным сосудистым вегетоневрозом с нарушением микроциркуляции, а также присоединением инфекции.
Автор заявляет об отсутствии конфликта интересов.
