Что такое клиренс лекарства
КЛИРЕНС в медицине
Клиренс в медицине (англ. clearance) — скорость очищения плазмы крови, других сред или тканей организма от какого-либо вещества в процессе его биотрансформации, перераспределения в организме и (или) выделения из организма.
Понятие «клиренс» в медицине было сформулировано в 1929 г. Ван-Слайком (D. D. Van Slyke) с соавт. применительно только к очищению плазмы от веществ, выделяемых почками, в частности от мочевины. При этом К. определялся как степень очищения от какого-либо вещества плазмы крови, прошедшей через почки за 1 мин. В последующие годы в связи с широким применением в диагностике индикаторных красок и радиоактивных изотопов понятие «клиренс» стали использовать для обозначения не только показателя очищения плазмы, но и скорости убывания индикаторного вещества из исследуемого объема какой-либо ткани, органа. Однако традиционное употребление понятия «клиренс» (применительно к очищению плазмы) наиболее устойчиво.
В сложившейся терминологии очищение плазмы от какого-либо вещества обозначают как Клиренс. данного вещества, напр. Клиренс инулина, Клиренс креатинина. В формулах К. обозначают символом С, рядом с к-рым сокращенно обозначают вещество, напр. Cin — К. инулина. В зависимости от того, роль какого органа в очищении плазмы изучается, говорят о почечном К., печеночном К. и т. д. Существует также понятие общего, или тотального плазматического К. (Стр), величина к-рого характеризует скорость очищения плазмы от вещества независимо от механизмов очищения (выделение экскреторными органами, биотрансформация с потерей исходных свойств и др.). Определив одновременно общий плазматический К. и интенсивность очищения от данного вещества почкой или печенью, рассчитывают роль этих органов в общем плазматическом К. Так была показана, напр., ведущая роль почек в очищении плазмы от пенициллина, инулина, парааминогиппурата (ПАГ) и ведущая роль печени в К. бромсульфофталеина и бенгальского розового.
Для определения общего плазматического К. индикаторное вещество однократно инъецируют в вену и через определенные интервалы времени собирают несколько проб крови для изучения динамики концентрации введенного вещества в плазме. Падение концентрации в крови некоторых веществ, напр. ПАГ, происходит по экспоненте (за равные промежутки времени концентрация снижается на одинаковую относительную часть исходной величины), других веществ, напр, бромсульфофталеина, этанола, цитембена,— в виде линейной зависимости (концентрация уменьшается на одинаковую абсолютную величину за равные интервалы времени), а некоторые вещества имеют кривую снижения концентрации в крови в виде неправильной функции. В зависимости от характера падения концентрации вещества в плазме крови для расчета К. используют различные формулы.
Тотальный плазматический Клиренс рассчитывают по формуле
где I — количество введенного в кровь вещества, S — площадь под кривой концентрации вещества в плазме (по оси ординат) за время исследования (на оси абсцисс). При экспоненциальном характере кривой концентрации, чтобы не определять площадь под ней, используют формулу
где Р0 — исходная концентрация в плазме в мг/мл, Т1/2 — время (в минутах или в часах) уменьшения концентрации вещества в плазме в 2 раза, I — количество введенного вещества.
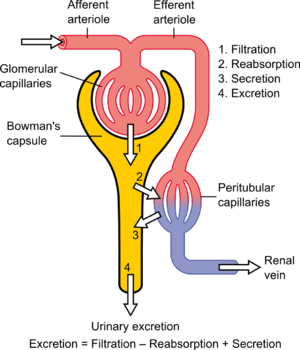
Роль отдельных органов в К. какого-либо вещества может быть установлена по различию концентраций этого вещества в плазме притекающей к органу и оттекающей от него крови. Об этой разнице можно судить также по различию концентраций вещества в плазме и в выделяемых жидкостях (для экскреторных органов). К. вещества, обусловленный выделительной функцией, определяется по общей формуле
где V — объем секрета (экскрета), полученный за единицу времени (обычно в мл/мин), К — концентрация вещества, т. е. количество в 1 мл секрета (напр., мочи, желчи), P — концентрация вещества в плазме. Методически существенно, что для определения общего плазматического К. производят однократную инъекцию вещества; для измерения органного, в частности почечного, К. предпочтительна непрерывная инфузии, чтобы поддерживать концентрацию тест-вещества в плазме на постоянном уровне.
Клиническое значение клиренс-тестов
Поскольку определение почечного К. связано с исследованием концентрации тест-вещества в моче, то нельзя не учитывать транспорт воды в почках, а также их способность не только экскретировать, но и удерживать некоторые вещества в организме. В последнем случае концентрация вещества в моче будет меньше, чем в плазме крови. Чтобы определить, происходит ли экскреция почкой данного вещества, пользуются расчетом К. по формуле
где U — концентрация вещества в моче. Для веществ, концентрация которых в моче ниже, чем в плазме, полученная величина К. будет отрицательной; это укажет на то, что вещество удерживается в плазме, а выделяется избыток воды. Понятие о положительном и отрицательном К. важно для характеристики осмо- и ионорегулирующей функции почек.
Применение в качестве тест-веществ радиоактивных изотопов существенно расширило возможности клиренс-тестов в клин, практике и повысило их клин, значимость. По кривой спада радиоактивности над сердцем определяют эффективный почечный плазмоток и кровоток. Вещества, К. которых используется для определения клубочковой фильтрации, но имеющие в молекуле радиоактивные изотопы (инулин- 131 I, ЭДТА- 51 Cr, ЭДТА- 169 Yb), позволяют производить исследование без сбора мочи, что дает возможность определить клубочковую фильтрацию при низком диурезе. Изотопная ренография позволяет оценивать функц, состояние почек при различных их заболеваниях, эвакуаторную функцию верхних мочевых путей; ее используют для наблюдения за состоянием и функцией трансплантированной почки (см. Ренография радиоизотопная).
Клиренс-тесты в гепатологии применяют для изучения поглотительновыделительной функции печени (см.). При этом в организм вводят вещества, поглощаемые печенью и выделяемые с желчью (билирубин, бромсульфалеин, азорубин-S, бенгальский розовый, вофавердин, уевердин и др.). Чаще используют бромсульфофталеиновую пробу (см.) и вофавердиновую пробу (см.).
Для определения печеночного паренхиматозного К. применяют бенгальский розовый, меченный 131I, который обладает выраженной гепатотропностью. Кривые К. обрабатывают при помощи экспоненциального уравнения, вычисляя полупериод элиминации, время максимального уровня излучения над печенью и время появления препарата в Кишечнике. При заболеваниях печени скорость и степень поглощения и степень поглощения и экскреции краски уменьшаются: при поражении полигональных клеток в большей мере страдает процесс поглощения, а при воспалении, и особенно нарушении проходимости желчных путей,— экскреторная функция. Особенно важно сопоставление показателей очищения от препарата крови и печени. В случае препятствия оттоку желчи наблюдается нормальное или малоизмененное убывание препарата из крови при замедленном выведении его из печени; одновременное нарушение поглощения бенгальского розового позволяет предполагать поражение паренхимы. С помощью клиренс-тестов представляется возможным выявление безжелтушных форм вирусного гепатита, прогностическая оценка восстановительного периода после острого вирусного гепатита, степени поражения и динамики процесса при хронических заболеваниях печени.
Для изучения регионарного кровотока используют метод так наз. тканевого клиренса — скорости элиминации изотопов 133Xe, 85Kr, альбумина, меченного 131I и др. из исследуемой ткани (органа), в к-рой создано депо препарата.
Перспектива применения клиренс-тестов в клин, исследованиях неуклонно расширяется. С их помощью изучают обмен ряда веществ, напр. альбумина, длительность жизни эритроцитов, продукцию билирубина, биол, цикл гормонов, скорость потребления профакторов и факторов свертывающей и противосвертывающей системы крови.
Определение плазматического К. находит применение при изучении фармакокинетики лекарственных препаратов, для изучения всасывания лекарств из желудочно-кишечного тракта, распределения их в организме, роли различных органов в их выделении или разрушении. Кроме того, по Клиренсу судят об эффективности очищения организма от эндогенных и экзогенных веществ при использовании таких методов лечения, как гемодиализ (см.), перитонеальный диализ (см.), гемосорбция (см. ), лимфосорбция (см.), плазмаферез (см.), обменное замещение крови.
Библиография: Гехмосорбция, под ред. Ю. М. Лопухина, М., 1977; Графнеттерова Й. и др. Значение плазматического клиренса в изучении кинетики антибиотиков, Антибиотики, т. 5, № 3, с. 56, 1960; Лопухин Ю. М. и Молоденков М. Н. Гемосорбция, М., 1978; Основы гепатологии, под ред. А. Ф. Блюгера, с. 116, Рига, 1975; Шюк О. Функциональное исследование почек, пер. с чешек., Прага, 1975, библиогр.; Ярошевский А. Я. Клиническая нефрология, Л., 1971; Koushanpour E. Renal physiology, Philadelphia, 1976.
Ю. В. Наточин, М. Е.Семендяева.
Клиренс лекарственных средств
Клиренс лекарственных средств [ править | править код ]
Клиренс — важнейший фармакокинетический параметр, позволяющий подобрать длительное лечение. Чтобы обеспечить нужный терапевтический эффект и свести к минимуму риск побочного действия, средняя сывороточная концентрация препарата в стационарном состоянии должна находиться в пределах терапевтического диапазона. Если биодоступность равна 100%, в стационарном состоянии скорость элиминации препарата равна скорости его поступления.
Скорость поступления = С1 х Ссредн, (1.1)
где скорость поступления — количество введенного препарата в единицу времени, С1 — суммарный клиренс, а Ссредн — средняя сывороточная концентрация препарата в стационарном состоянии. Если известна требуемая средняя сывороточная концентрация, скорость поступления можно рассчитать по клиренсу.
Важнейшая с клинической точки зрения особенность клиренса — он, как правило, не зависит от концентрации препарата. Дело в том, что системы, отвечающие за элиминацию большинства лекарственных средств (ферментные, транспортные), обычно не насыщаются, и абсолютная скорость элиминации линейно зависит от сывороточной концентрации препарата. Иными словами, элиминация подчиняется кинетике первого порядка — доля препарата, удаляемая за единицу времени, постоянна. Если же системы элиминации насыщаются, постоянна не доля, а количество препарата, удаляемое за единицу времени. При этом элиминация подчиняется кинетике нулевого порядка, а клиренс зависит от сывороточной концентрации препарата:
где Кm — концентрация препарата, при которой скорость элиминации составляет половину от максимальной, а Vm — максимальная скорость элиминации.
Это уравнение аналогично уравнению Михаэлиса— Ментен, выражающему соотношение между скоростью ферментативной реакции и концентрацией субстрата. Подобрать схему лечения препаратами, элиминация которых не подчиняется кинетике первого порядка (то есть клиренс зависит от сывороточной концентрации), гораздо труднее (см. ниже).
Понятие клиренса лекарственного средства аналогично понятию клиренса в физиологии почек. Так, клиренс креатинина равен отношению скорости экскреции креатинина с мочой к концентрации креатинина в плазме. В общем случае клиренс лекарственного средства равен отношению скорости элиминации вещества всеми органами к концентрации препарата в биологической жидкости.
Cl=Скорость элиминации/ С (1.3)
Если клиренс постоянен, скорость элиминации прямо пропорциональна концентрации лекарственного средства. Важно отметить, что клиренс отражает не количество элиминировавшегося препарата, а объем биологической жидкости (плазма или цельная кровь), полностью очищающийся отданного вещества за единицу времени. Можно рассчитать клиренс для плазмы или цельной крови, а также клиренс свободного препарата.
Элиминация лекарственных средств осуществляется почками, печенью и другими органами. Рассчитав клиренс для каждого органа как отношение скорости элиминации данным органом к концентрации препарата (например, в плазме) и просуммировав клиренсы для всех органов, получим суммарный клиренс.
Clпоч + Сlпеч + Сlпр = Сl(1.4)
где Сlпоч — почечный клиренс, Сlпеч — печеночный клиренс, Сlпр — клиренс для прочих органов (лекарственные средства могут метаболизироваться в других органах, выводиться с калом, потом, слюной).
В стационарном состоянии суммарный клиренс можно определить с помощью уравнения 1.1. При однократном введении препарата, биодоступность которого равна 100%, а элиминация подчиняется кинетике первого порядка, суммарный клиренс можно рассчитать на основании закона сохранения массы и интегрирования уравнения 1.3 по времени.
где ПФК — площадь под фармакокинетической кривой, описывающей зависимость сывороточной концентрации препарата от времени.
Примеры. Клиренс цефалексина (для плазмы) составляет 4,3 мл/мин/кг (Приложение II). У больного весом 70 кг клиренс цефалексина составит 300 мл/мин. Поскольку 90% препарата выводится с мочой в неизмененном виде, можно сказать, что за 1 мин почки очищают от цефалексина 270 мл крови. Если функция почек не меняется, клиренс постоянен, а скорость элиминации цефалексина зависит от сывороточной концентрации препарата (уравнение 1.3). Клиренс пропранолола (для цельной крови) составляет 16 мл/мин/кг (1120 мл/мин при весе 70 кг). Препарат элиминируется преимущественно печенью, то есть за 1 мин печень очищает от пропранолола 1120 мл крови. Клиренс не всегда соответствует плазмотоку (или кровотоку) через орган, отвечающий за элиминацию. Если препарат связывается с эритроцитами, скорость его доставки в этот орган существенно выше, чем можно предположить исходя из концентрации препарата в плазме. В стационарном состоянии соотношение клиренса для плазмы и цельной крови выглядит следующим образом:
где Сlп — клиренс для плазмы, Сlк — клиренс для цельной крови, Сп — концентрация препарата в плазме, Ск — концентрация препарата в цельной крови, Сэ — концентрация препарата в эритроцитах, Ht — гематокрит.
Таким образом, клиренс для цельной крови равен частному от деления клиренса для плазмы на отношение концентраций препарата в цельной крови и плазме. Это соотношение, в свою очередь, можно рассчитать, зная гематокрит (в норме около 0,45) и соотношение концентраций препарата в эритроцитах и плазме. В большинстве случаев клиренс для цельной крови меньше печеночного кровотока (если препарат элиминируется печенью) или суммы печеночного и почечного кровотока (если препарат элиминируется печенью и почками). Клиренс такролимуса, который метаболизируется преимущественно в печени, для плазмы составляет 2 л/мин; иными словами, он более чем вдвое превышает печеночный плазмоток и даже превосходит печеночный кровоток (1,5 л/мин). Однако поскольку такролимус в значительной степени связывается с эритроцитами, его клиренс для цельной крови равен всего 63 мл/мин. Следовательно, на самом деле такролимус удаляется из крови гораздо медленнее. Иногда рассчитанный для цельной крови клиренс препаратов, которые элиминируются путем метаболизма, превышает печеночный кровоток. Это означает, что препарат метаболизируется и вне печени. Так, клиренс эсмолола для цельной крови (11,9 л/мин) превышает сердечный выброс, поскольку препарат интенсивно метаболизируется эритроцитарными эстеразами.
Понятие клиренса очень важно и для оценки влияния различных физиологических и патологических состояний на элиминацию лекарственных средств отдельными органами. Скорость доставки препарата в орган равна произведению кровотока через этот орган (Q) на концентрацию препарата в артериальной крови (Са), а скорость удаления из органа — произведению кровотока через этот орган на концентрацию препарата в венозной крови (Q,). Разница между этими скоростями в стационарном состоянии и есть скорость элиминации данным органом:
Скорость элиминации = QxCa — QxCv = = Q х (Са — Cv). (1.7)
Разделив обе части этого уравнения на Са, получим клиренс препарата для данного органа (Сlорг).
Clopr = Q X ((Са-Cv)/Ca) = Q x E
Печеночный клиренс [ править | править код ]
В действительности ситуация может оказаться сложнее. Уравнение 1.8 не учитывает ни связывание лекарственных средств с компонентами крови и тканей, ни способность печени элиминировать лекарственные средства (вне зависимости от печеночного кровотока) — так называемый внутренний печеночный клиренс. Для лекарственных средств, элиминация которых подчиняется кинетике первого порядка, внутренний клиренс характеризует отношение констант, входящих в уравнение 1.2, Vm / Кm. В нескольких моделях, описывающих печеночную элиминацию, уравнение 1.8 было расширено с учетом связывания лекарственного средства с белками плазмы и внутреннего печеночного клиренса (Morgan and Smallwood, 1990). Согласно этим моделям, если способность печени метаболизировать препарат велика по сравнению со скоростью его доставки с кровью, клиренс примерно равен печеночному кровотоку. В противном случае клиренс зависит от концентрации свободного препарата в крови и внутреннего печеночного клиренса. С помощью таких моделей можно объяснить некоторые противоречивые результаты экспериментальных исследований на животных. Так, индукция микросомальных ферментов или заболевания печени могут приводить к изменению скорости метаболизма некоторых лекарственных средств in vitro, но суммарный клиренс in vivo при этом может не меняться. Это объясняется тем, что индукция микросомальных ферментов и заболевания печени приводят к изменению внутреннего печеночного клиренса, а клиренс препаратов с высоким коэффициентом экстракции ограничен только печеночным кровотоком и практически не зависит от внутреннего клиренса. Кроме того, при высоком коэффициенте экстракции на клиренс не влияет и связывание препарата с белками плазмы, которое может меняться, например, при различных патологических состояниях или конкуренции за участки связывания. Клиренс лекарственных средств с низким коэффициентом экстракции, напротив, чувствителен к изменению внутреннего печеночного клиренса и связывания с белками плазмы, но почти не зависит от печеночного кровотока (Wilkinson and Shand, 1975).
Почечный клиренс [ править | править код ]
Этот показатель отражает экскрецию лекарственного средства с мочой и позволяет оценить изменение фармакокинетики препарата при заболеваниях почек. Лекарственные средства выводятся почками путем клубочковой фильтрации, канальцевой секреции и канальцевой реабсорбции. Скорость фильтрации препарата зависит от СКФ и концентрации свободного препарата в плазме (препарат, связанный с белками плазмы, не проходит через клубочковый фильтр). Скорость канальцевой секреции определяется способностью транспортных систем канальцев секретировать препарат. Эта способность, в свою очередь, зависит от связывания препарата с белками плазмы, степени насыщения транспортных систем и скорости доставки препарата к канальцам. И наконец, лекарственное средство может реабсорбироваться из канальцев обратно в кровь. На почечный клиренс влияют те же факторы, что и на печеночный клиренс — связывание препарата с белками плазмы, почечный кровоток и внутренний почечный клиренс (последний, в свою очередь, зависит от числа функционирующих нефронов).
Что такое клиренс лекарства
Болюсное внутривенное (в/в) введение препаратов приводит к максимальной их концентрации в конце введения; затем с течением времени концентрация препарата в плазме снижается. Наиболее простой пример этого действия — моноэкспоненциальное снижение во времени. Важным параметром для описания такого снижения является период полу-выведения (Т1/2) — время, за которое выводится 50% препарата. После двух периодов полувыведения элиминируется 75% препарата, после трех периодов — 87,5% и т.д.
В некоторых случаях снижение концентрации препарата после его болюсного в/в введения является мультиэкспоненциальным. Общепринятое объяснение этому — лекарственный препарат не только элиминируется, но также подвергается более быстрому распределению в периферических тканях. Элиминация препарата характеризуется периодом полувыведения, а период полураспределения может быть получен из кривых.
Измерение концентрации лекарства в плазме сразу после болюсного в/в введения можно использовать для определения объема распределения препарата. Когда снижение концентрации в плазме является мультиэкспоненциальным, возможно наличие сложных объемов распределения. Эти объемы распределения полезны для корректировки дозы препарата в случае болезни, однако редко абсолютно соотносятся с каким-либо физическим объемом, таким как плазма или общий водный обьем. На самом деле у препаратов, которые сильно связаны с тканями (например, некоторые антидепрессанты), обьем распределения может превосходить общий обьем тела на порядок.
Препараты могут поступать в организм и другим путем, например per OS, сублингвально, чрескожно или внутримышечно (в/м). При таких способах введения существуют два отличия от в/в пути введения. Во-первых, концентрация в плазме четко указывает на фазу нарастания, в то время как препарат медленно поступает в плазму. Во-вторых, общее количество препарата, поступающего в системный кровоток, может быть меньше, чем при в/в введении. Относительное количество препарата, поступающее при любом пути введения, сравнимое с такой же дозой препарата, введенной в/в, называют биодоступностыо. Биодоступность может быть снижена, если препарат метаболизируется до поступления в кровоток или из-за того, что препарат не всасывается из места введения.
Клиренс — это наиболее распространенный показатель измерения элиминации препарата. Клиренс можно рассматривать как объем, очищенный от препарата за определенный период времени.
Клиренс может быть органоспецифичным (например, почечный, печеночный) или всего организма (клиренс — показатель скорости очищения плазмы крови, других сред или тканей организма, т.е. объем плазмы, полностью очищающийся от данного вещества за единицу времени).
При неоднократном введении уровень препарата достигает равновесия — состояния, при котором уровень введения соответствует уровню элиминации в любой период времени. Периодом полувыведения определяют не только время «исчезновения» препарата, но и время, за которое достигается равновесное состояние. Важно разделять равновесные концентрации в плазме, которые достигаются за 4 или 5 периодов полувыведения, и состоявшийся лекарственный эффект, который может занять более продолжительное время. У некоторых препаратов клинические эффекты проявляется сразу после взаимодействия с мишенью-молекулой, например у нитратов при стенокардии, у нитропруссида при снижении артериального давления, у симпатомиметиков при лечении шока.
В других случаях действие лекарственных препаратов соответствует определенной их концентрации в плазме, но с задержкой, чему есть несколько возможных объяснений. Во-первых, для достижения лекарственного эффекта требуется образование активных метаболитов. Во-вторых, необходимо время для преобразования эффекта на молекулярном уровне в конечную физиологическую точку, например, ингибирование синтеза витамин К-зависимых свертывающих факторов варфарином в результате приводит к повышению MHO, но развитие этого действия происходит при падении уровней факторов свертывания. В-третьих, для развития лекарственного эффекта иногда требуется проникновение препарата внутрь клетки или в другие участки тканей.
Одним из барьеров для такого проникновения является изменчивость в специфическом усвоении препарата и утечка транспортных белков, которые контролируют концентрацию препарата в клетке. Различия в проникновении в ткани также часто вызывает отсрочка во времени от момента введения амиодарона до развития его эффектов, тем не менее точные механизмы этого феномена остаются неясными, и транспорт препарата может быть с этим не связан.
СОДЕРЖАНИЕ
Определение
Его определение следует из дифференциального уравнения, которое описывает экспоненциальный распад и используется для моделирования функции почек и функции аппарата гемодиализа :
Он выводится из баланса масс.
Клиренс вещества иногда выражается как величина, обратная постоянной времени, которая описывает скорость его удаления из организма, деленную на его объем распределения (или общую воду в организме ).
Клиренс, период полураспада и объем распределения
Существует важная взаимосвязь между клиренсом, периодом полувыведения и объемом распределения. Константа скорости выведения лекарственного средства el эквивалентна полному клиренсу, деленному на объем распределения (el = Cltot / Vd) (обратите внимание на использование Cl, а не, не путать с el). Но el также эквивалентен ln2, деленному на период полувыведения t1 / 2 (Κel = ln2t1 / 2). Таким образом, Cltot = ln2 Vd / t1 / 2. Это означает, например, что увеличение общего клиренса приводит к уменьшению периода полувыведения, при условии, что объем распределения постоянен. Вывод этих уравнений можно найти, например, в «Фармакологии Рэнга и Дейла».
Эффект связывания с белками плазмы
Однако в других местах, кроме почек, где клиренс осуществляется мембранными транспортными белками, а не фильтрацией, обширное связывание с белками плазмы может увеличивать клиренс, поддерживая довольно постоянную концентрацию свободного вещества по всему капиллярному руслу, ингибируя уменьшение клиренса, вызванное пониженной концентрацией. свободного вещества через капилляр.