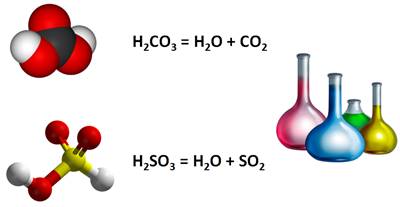Что такое кислоты в химии 8 класс
Урок 23. Понятие о кислотах
В уроке 23 «Понятие о кислотах» из курса «Химия для чайников» познакомимся со сложными веществами — кислотами; узнаем об индикаторах и как они помогают человеку.
В тексте нашего учебника вам уже неоднократно встречалось слово «кислота». Много раз, конечно, вы слышали это слово и в повседневной жизни. При приготовлении пищи используются уксусная и лимонная кислоты, в домашней аптечке есть борная кислота, в аккумуляторы автомашин заливают серную кислоту и т. д. Отметим, что и в быту, и в производственной деятельности людей используются в основном водные растворы кислот. Познакомимся поближе с этими веществами.
Состав кислот
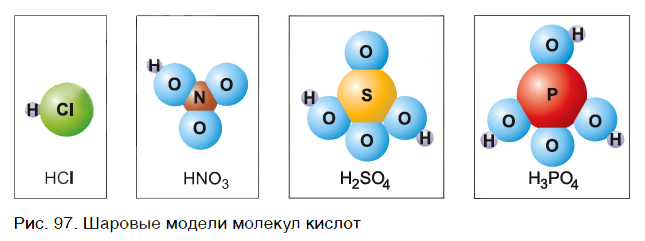
В большинстве случаев в состав молекул кислот входят только атомы неметаллов. На рисунке 97 представлены шаровые модели молекул некоторых кислот и их формулы. Что общего у этих молекул? Ответ прост — в них входят атомы водорода.
Обратим внимание, что в состав молекулы хлороводорода, кроме атома водорода Н, входит атом хлора Cl, молекулы азотной кислоты — группа атомов NO3, молекулы серной кислоты — SO4, молекулы фосфорной кислоты — PO4.
Атом Cl, группы атомов NO3, SO4, PO4, а также другие атомы и группы атомов в составе кислот называют кислотными остатками.
Кислоты — сложные вещества, в состав которых входят атомы водорода, способные замещаться атомами металлов, и кислотные остатки.
Кислотные остатки в молекулах кислот соединены с атомами водорода в соответствии со своей валентностью. Как можно ее определить? Водород всегда одновалентен. Значит, если кислотный остаток в молекуле кислоты соединен с одним атомом водорода, то его валентность равна единице, если с двумя атомами — двум, а с тремя — трем.
При написании формул кислот сначала пишут атомы водорода, а потом кислотные остатки.
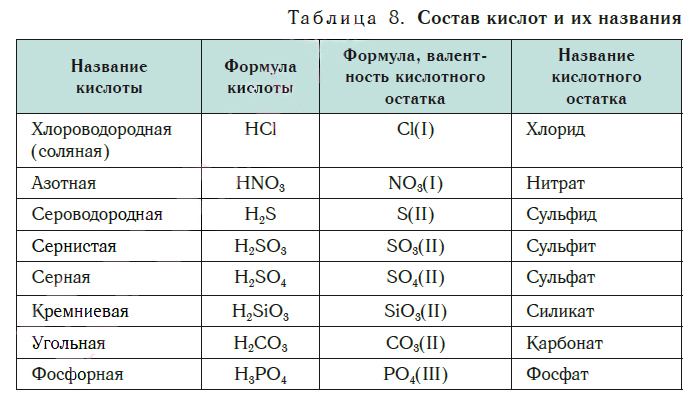
В таблице 8 представлены названия и формулы кислот, с которыми вы будете встречаться при изучении основ химии. Здесь же даны формулы кислотных остатков, которые входят в состав этих кислот, их валентность и названия.
При обычных условиях кислоты существуют в жидком и твердом агрегатных состояниях. Так, фосфорная кислота H3PO4 при комнатной температуре — твердое вещество. При этих же условиях серная кислота H2SO4 — это не имеющая запаха вязкая жидкость. Она почти в 2 раза тяжелее воды. Хлороводородная кислота HCl — раствор газа хлороводорода в воде. Она имеет еще и историческое название «соляная кислота». Раствор этой кислоты имеет характерный запах.
В большинстве случаев кислоты растворяются в воде. Исключение — кремниевая кислота H2SiO3. Водные растворы хлороводородной, серной и фосфорной кислот не имеют окраски. Безводная азотная кислота при хранении желтеет.
Поскольку в состав всех кислот входят атомы водорода, то кислоты обладают общими свойствами: 1) изменяют окраску некоторых органических веществ; 2) имеют кислый вкус (пробовать кислоты на вкус, как и любые другие вещества, запрещается — можно получить ожог полости рта!); 3) оказывают разъедающее действие на кожу человека, ткани, бумагу, древесину и другие материалы.
Меры предосторожности при работе с кислотами
Кислоты — едкие вещества. Попадание кислот на кожу или в глаза может привести к болезненным химическим ожогам. Обращаться с кислотами нужно очень осторожно. При работе с ними следует надевать специальные халаты, перчатки, очки. При попадании кислоты на кожу или в глаза ее необ ходимо немедленно смыть большим количеством воды, а затем пораженный участок промыть раствором питьевой соды. В случае необходимости следует обратиться в медпункт.
Понятие об индикаторах
Некоторые органические вещества изменяют свою окраску в присутствии кислот и ряда других веществ. Такие вещества называют индикаторами, что в переводе с латинского означает «указатель».
Индикаторы — это органические вещества, которые изменяют свою окраску в присутствии кислот и ряда других веществ.
На уроках химии для обнаружения в растворах кислот используют индикаторы лакмус, метиловый оранжевый (метилоранж), а также универсальный индикатор. Это полоска фильтровальной бумаги, пропитанная смесью индикаторов. Окраска индикаторов в воде показана на рисунке 98. Индикаторы изменяют свой цвет, если в растворе есть кислоты (рис. 99).
На заметку: В растворах кислот изменяют цвет сок краснокочанной капусты, вишни, черноплодной рябины, цветки фиалки и др.
Краткие выводы урока:
Надеюсь урок 23 «Понятие о кислотах» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Урок №47. Кислоты. Состав. Классификация. Номенклатура. Получение кислот
Классификация кислот
1. По числу атомов водорода: число атомов водорода (n) определяет основность кислот:
2. По составу:
а) Таблица кислородсодержащих кислот, кислотных остатков и соответствующих кислотных оксидов:
Кислотный остаток (А)
Соответствующий кислотный оксид
SO 3 оксид серы ( VI )
HMnO 4 марганцевая
MnO 4 (I) перманганат
Mn 2 O 7 оксид марганца ( VII )
SO 2 оксид серы ( IV )
PO 4 (III) ортофосфат
P 2 O 5 оксид фосфора ( V )
N 2 O 3 оксид азота ( III )
CO 2 оксид углерода ( IV )
SiO 2 оксид кремния (IV)
С l 2 O оксид хлора ( I)
С l 2 O 3 оксид хлора ( III)
НСlO 3 хлорноватая
С l 2 O 5 оксид хлора ( V)
С l 2 O 7 оксид хлора ( VII)
б) Таблица бескислородных кислот
Кислотный остаток (А)
HCl соляная, хлороводородная
H 2 S сероводородная
Физические свойства кислот
Способы получения кислот
HCl, HBr, HI, HF, H 2 S
1. Прямое взаимодействие неметаллов
1. Кислотный оксид + вода = кислота
2. Реакция обмена между солью и менее летучей кислотой
Кислоты. Химические свойства и способы получения
Перед изучением этого раздела рекомендую прочитать следующую статью:
Кислоты – сложные вещества, которые при взаимодействии с водой образуют в качестве катионов только ионы Н + (или Н3О + ).
Получение кислот
1. Взаимодействие кислотных оксидов с водой. При этом с водой реагируют при обычных условиях только те оксиды, которым соответствует кислородсодержащая растворимая кислота.
кислотный оксид + вода = кислота
При этом оксид кремния (IV) с водой не реагирует:
2. Взаимодействие неметаллов с водородом. Таким образом получают только бескислородные кислоты.
Неметалл + водород = бескислородная кислота
H2 0 + Cl2 0 → 2 H + Cl —
3. Электролиз растворов солей. Как правило, для получения кислот электролизу подвергают растворы солей, образованных кислотным остатком кислородсодержащих кислот. Более подробно этот вопрос рассмотрен в статье Электролиз.
4. Кислоты образуются при взаимодействии других кислот с солями. При этом более сильная кислота вытесняет менее сильную.
Например: карбонат кальция CaCO3 (нерастворимая соль угольной кислоты) может реагировать с более сильной серной кислотой.
5. Кислоты можно получить окислением оксидов, других кислот и неметаллов в водном растворе кислородом или другими окислителями.
Химические свойства кислот
1. В водных растворах кислоты диссоциируют на катионы водорода Н + и анионы кислотных остатков. При этом сильные кислоты диссоциируют почти полностью, а слабые кислоты диссоциируют частично.
HCl → H + + Cl –
Если говорить точнее, происходит протолиз воды, и в растворе образуются ионы гидроксония:
HCl + H2O → H3O + + Cl –
Многоосновные кислоты диссоциируют cтупенчато.
HSO3 – ↔ H + + SO3 2–
2. Кислоты изменяют окраску индикатора. Водный раствор кислот окрашивает лакмус в красный цвет, метилоранж в красный цвет. Фенолфталеин не изменяет окраску в присутствии кислот.
С нерастворимыми основаниями и соответствующими им оксидами взаимодействуют только растворимые кислоты.
нерастворимое основание + растворимая кислота = соль + вода
основный оксид + растворимая кислота = соль + вода
При этом гидроксид меди (II) не взаимодействует с нерастворимой кремниевой кислотой.
С сильными основаниями (щелочами) и соответствующими им оксидами реагируют любые кислотами.
щёлочь(избыток)+ кислота = средняя соль + вода
щёлочь + многоосновная кислота(избыток) = кислая соль + вода
При этом дигидрофосфаты образуются в избытке кислоты, либо при мольном соотношении (соотношении количеств веществ) реагентов 1:1.
При мольном соотношении количества щелочи и кислоты 1:2 образуются гидрофосфаты:
В избытке щелочи, либо при мольном соотношении количества щелочи и кислоты 3:1 образуется фосфат щелочного металла.
4. Растворимые кислоты взаимодействуют с амфотерными оксидами и гидроксидами.
Растворимая кислота + амфотерный оксид = соль + вода
Растворимая кислота + амфотерный гидроксид = соль + вода
5. Некоторые кислоты являются сильными восстановителями. Восстановителями являются кислоты, образованные неметаллами в минимальной или промежуточной степени окисления, которые могут повысить свою степень окисления (йодоводород HI, сернистая кислота H2SO3 и др.).
4H I — + 2 Cu +2 Cl2 → 4HCl + 2 Cu + I + I2 0
6. Кислоты взаимодействуют с солями.
Кислота1 + растворимая соль1 = соль2 + кислота2/оксид + вода
Ag + NO3 — + H + Cl — → Ag + Cl — ↓ + H + NO3 —
7. Кислоты взаимодействуют с кислыми и основными солями. При этом более сильные кислоты вытесняют менее сильные из кислых солей. Либо кислые соли реагируют с кислотами с образованием более кислых солей.
кислая соль1 + кислота1 = средняя соль2 + кислота2/оксид + вода
KHCO3 + HCl → KCl + CO2 + H2O
Ещё пример : гидрофосфат калия взаимодействует с фосфорной кислотой с образованием дигидрофосфата калия:
При взаимодействии основных солей с кислотами образуются средние соли. Более сильные кислоты также вытесняют менее сильные из солей.
Основные соли могут взаимодействовать с собственными кислотами. При этом вытеснения кислоты из соли не происходит, а просто образуются более средние соли.
Al (OH) Cl2 + HCl → AlCl3 + H2O
8. Кислоты взаимодействуют с металлами.
При этом протекает окислительно-восстановительная реакция. Однако минеральные кислоты и кислоты-окислители взаимодействуют по-разному.
К минеральным кислотам относятся соляная кислота HCl, разбавленная серная кислота H2SO4, фосфорная кислота H3PO4, плавиковая кислота HF, бромоводородная HBr и йодоводородная кислоты HI.
Такие кислоты взаимодействуют только с металлами, расположенными в ряду активности до водорода:
При взаимодействии минеральных кислот с металлами образуются соль и водород:
минеральная кислота + металл = соль + H2↑
Fe + 2 H + Cl → Fe +2 Cl2 + H2 0
Сероводородная кислота H2S, угольная H2CO3, сернистая H2SO3 и кремниевая H2SiO3 с металлами не взаимодействуют.
Кислоты-окислители (азотная кислота HNO3 любой концентрации и серная концентрированная кислота H2SO4(конц)) при взаимодействии с металлами водород не образуют, т.к. окислителем выступает не водород, а азот или сера. Продукты восстановления азотной или серной кислот бывают различными. Определять их лучше по специальным правилам. Эти правила подробно разобраны в статье Окислительно-восстановительные реакции. Я настоятельно рекомендую выучить их наизусть.
9. Некоторые кислоты разлагаются при нагревании.
Угольная H2CO3, сернистая H2SO3 и азотистая HNO2 кислоты разлагаются самопроизвольно, без нагревания:
Кремниевая H2SiO3, йодоводородная HI кислоты разлагаются при нагревании:
Азотная кислота HNO3 разлагается при нагревании или на свету:
Химические свойства кислот, их классификация и реакции
Общие свойства кислот. Классификация
Кислоты — класс сложных химических веществ, состоящих из атомов водорода и кислотных остатков.
В первую очередь кислоты делятся на:
Свойства карбоновых кислот подробно разбираются в статье Карбоновые кислоты (ссылка на статью)
В зависимости от количества атомов водорода, которые могут замещаться в химических реакциях различают:
Не смотря на то, что в уксусной кислоте четыре атома водорода, три из них принадлежат кислотному остатку и в реакциях замещения не участвуют. Соответственно, уксусная кислота — одновалентная.
Свойства неорганических кислот также зависят от наличия в их составе кислорода и делятся на
Растворы кислот способны диссоциировать и проводить электрический ток т.е. являются электролитами. В зависимости от степени диссоциации делятся на:
Химические свойства кислот
1. Диссоциация
При диссоциации кислот образуются катионы водорода и анионы кислотного остатка.
Многоосновные кислоты диссоциируют ступенчато.
НРО 2- 4 ↔ Н + + PО З- 4 (третья ступень)
2. Разложение
Кислородсодержащие кислоты разлагаются на оксиды и воду.
Бескислородные на простые вещества
3. Реакция с металлами
Кислоты реагируют лишь с теми металлами, что стоят в ряду активности до кислорода. В результате взаимодействия образуется соль и выделяется водород.
Найти ряд активности можно на последней странице электронного учебника «Химия 9 класс» под редакцией В. В. Еремина.
Бдительные ученики могут сказать: «Золото стоит в ряду активности металлов после водорода, а с „царской водкой“ реагирует. Как же так?»
Из всех правил есть исключения.
Поскольку в состав азотной кислоты входит азот со степенью окисления +5, а в состав серной — сера со степенью окисления +6, то с металлами реагируют не ионы водорода, а более сильные окислители. Образуется соль, но не происходит выделения водорода.
4. Реакции с основаниями
В результате образуются соль и вода, происходит выделение тепла.
Реакции такого типа называются реакциями нейтрализации. Простейшая реакция, которую можно провести на собственной кухне — гашение соды столовым уксусом или 9%раствором уксусной кислоты.
5. Реакции кислот с солями
Вспомним, когда мы разбирали ионные уравнения ( ссылка на статью), одним из условий протекания реакций было образование в ходе взаимодействия нерастворимой соли, выделение летучего газа или слабо диссоциирующего вещества — например, воды. Те же условия сохраняются и для реакций кислот с солями.
6. Реакция кислот с основными и амфотерными оксидами
В ходе реакции образуется соль и происходит выделение воды.
7. Восстановительные свойства бескислородных кислот
Если в окислительных реакциях первую скрипку играет водород, то в восстановительных реакциях основная роль принадлежит анионному остатку. В результате реакций образуются свободные галогены.
Физические свойства кислот
При нормальных условиях (Атмосферное давление = 760 мм рт. ст. Температура воздуха 273,15 K = 0°C) кислоты чаще жидкости, хотя встречаются и твердые вещества: например ортофосфорная H3PO4 или кремниевая H2SiO3.
Некоторые кислоты представляют собой растворы газов в воде: фтороводородная-HF, соляная-HCl, бромоводородная-HBr.
Кислотные свойства кислот в ряду HF → HCl → HBr → HI усиливаются.
Для некоторых кислот (соляная, серная, уксусная) характерен специфический запах.
Благодаря наличию ионов водорода в составе, кислоты обладают характерным кислым вкусом.
Химическая лаборатория не ресторан, и в целях безопасности существует жесткий запрет на опробование на вкус химических веществ.
Как же можно определить кислота в пробирке или нет?
В 1300 году был открыт лакмус, и с тех пор алхимикам и химикам не пришлось рисковать своим здоровьем, пробуя на вкус содержимое пробирок. Запомните, что лакмус в кислой среде краснеет.
Вторым широко используемым индикатором является фенолфталеин.
Простой мнемонический стишок поможет запомнить, как ведут себя индикаторы в разных средах.
Индикатор лакмус — красный
Кислоту укажет ясно.
Индикатор лакмус — синий,
Щёлочь здесь — не будь разиней,
Когда ж нейтральная среда,
Он фиолетовый всегда.
Фенолфталеиновый — в щелочах малиновый
Но несмотря на это в кислотах он без цвета.
Кислоты
Урок 21. Химия 8 класс
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности
Конспект урока «Кислоты»
Слово «кислота» каждый слышал в повседневной жизни. Каждый знает, что в лимонах – лимонная кислота, в яблоках – яблочная кислота, в листьях щавеля – щавелевая кислота. Кроме этого, такая муравьиная кислота присутствует в пчелином яде, а также помогает муравьям защищаться от врагов. При скисании виноградного сока образуется уксусная кислота, при скисании молока или квашении капусты – молочная кислота. Многие кислоты человек использует в своей жизни, например, уксусную кислоту, а такие кислоты, как соляная и серная широко используются в народном хозяйстве.
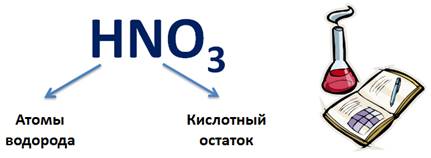
Кислоты – это сложные вещества, состоящие из атомов водорода и кислотного остатка. Атом водорода в кислотах всегда стоит на первом месте, все, что после водорода – кислотные остатки. Например, в HNO3, NO3 – кислотный остаток.
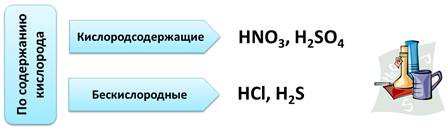
По содержанию кислорода в кислотах, кислоты делятся на кислородсодержащие, т.е. в этих кислотах присутствует кислород. Например, HNO3, H2SO4. Кислоты, в которых отсутствует кислород, называются бескислородными. К таким кислотам относятся HCl, H2S.
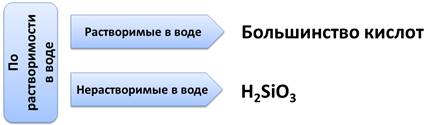
По растворимости в воде, кислоты делятся на растворимые в воде, к ним относится большинство кислот и нерастворимые в воде, к ним относится H2SiO3.
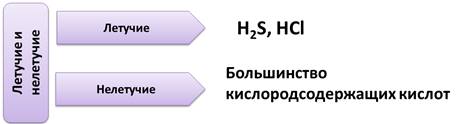
К летучим относятся такие кислоты, как H2S, HCl, к нелетучим – большинство кислородсодержащих кислоты.
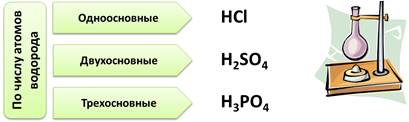
По числу атомов водорода в кислоте, кислоты делят на: одноосновные, в которых 1 атом водорода, например, HCl, двухосновные, в которых 2 атома водорода, например, H2SO4. Трехосновные кислоты – это кислоты, в которых 3 атома водорода, например, H3PO4.
Заряд атома водорода в кислотах всегда (+), а заряд кислотного остатка всегда отрицателен и численно равен числу атомов водорода в кислоте.
Для того чтобы написать структурные формулы кислородсодержащих кислот нужно помнить, что сначала нужно записать все гидроксид-ионы. А затем все остальные атомы кислорода связать с кислотообразующим элементом. Так, например, в серной кислоте – H2SO4 – 2 гидроксид-иона, а остальные 2 атома кислорода связываем с кислотообразующим элементом –серой – двумя черточками.
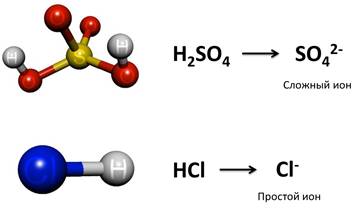
Давайте рассмотрим некоторые ионы. В кислоте H2SO4 заряд кислотного остатка – SO4 равен (2-), т.к. в этой кислоте 2 атома водорода. Кроме того, этот ион SO4 2- является сложным. В кислоте HCl заряд кислотного остатка – Cl, равен (-), т.к. в этой кислоте 1 атом водорода. Этот ион называется простым.
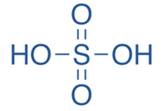
Серная кислота – H2SO4, бесцветная, маслянистая жидкость, не имеет запаха, вдвое тяжелее воды. Серная кислота поглощает влагу из воздуха и других газов, поэтому ее используют для осушения газов.
При разбавлении серной кислоты, следует кислоту вливать в воду, а не наоборот, т.к. при смешивании воды с кислотой, происходит сильное разогревание раствора, и вода, не успев смешаться с кислотой, может закипеть и выбросить брызги вверх. Поэтому кислоту следует вливать в воду тонкой струей и перемешивать.
Серная кислота обугливает древесину, ткани, кожу. Если в пробирку с серной кислотой поместить лучинку или сахар, то они обугливаются.
Ее применяют в производстве удобрений и красителей, взрывчатых веществ, медикаментов, моющих средств, очистке керосина, нефтяных масел. Она является электролитом в аккумуляторах.
Кислоты, как и основания можно различить с помощью индикаторов. Посмотрим таблицу и сравним, как изменяют свою окраску индикаторы в присутствии кислот. Лакмус становится красным, метиловый оранжевый тоже, а вот фенолфталеин окраску не изменяет. Поэтому лакмус и метиловый оранжевый – основные индикаторы, которые используют для распознавания кислот.
Окраска индикаторов в кислотах
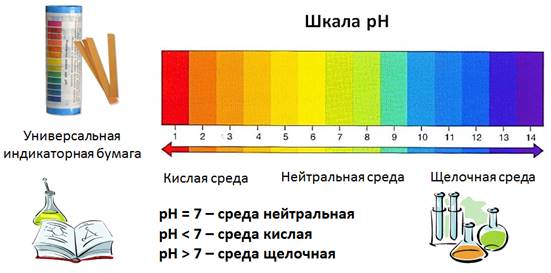
Но наиболее удобный и безопасный способ – это использование универсальной индикаторной бумаги, на которую нанесена смесь индикаторов. По изменению цвета полоски бумаги можно судить о характере среды: кислая она, щелочная или нейтральная. Кроме того, по интенсивности изменения окраски можно судить и о значительности кислотности или щёлочности, которая оценивается по специальной шкале. Эта шкала нанесена на упаковку полосок универсальной индикаторной бумаги. Она называется шкалой рН. Если рН = 7, то среда считается нейтральной, как в дистиллированной воде, если рН 7, то среда щелочная и чем больше эта величина, тем выше щёлочность раствора. Посмотрите на рисунок, как изменяется интенсивность окраски, чем среда более кислая, тем окраска более красная на универсальной индикаторной бумаге, чем среда более щелочная, тем окраска становится более синей.
Определение степени окисления атомов по формуле кислоты
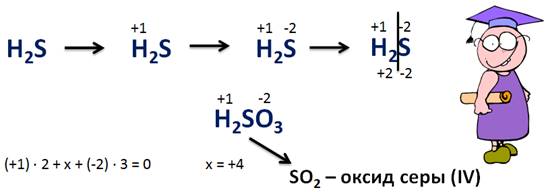
По формулам кислот попробуем определить степени окисления атомов химических элементов, входящих в состав кислоты. Например, в кислоте H2S степень окисления водорода (+1), это постоянно, а серы (-2), т.к. сумма степеней окисления должна ровняться 0. У водорода суммарная степень окисления – (+2), значит, у серы будет (-2), т.к. в составе кислоты 1 атом серы.
Давайте определим степени окисления всех элементов в сернистой кислоте – H2SO3. Как известно, степени окисления водорода и кислорода постоянны и соответственно равны (+1) и (-2). Найдем степень окисления серы, для этого составим уравнение, где х – это неизвестная степень окисления серы. (+1) · 2 + х + (-2) × 3 = 0. Ноль – суммарная степень окисления атомов всех элементов в соединении. Х = +4. Следовательно степень окисления серы в кислоте – (+4).
Зная степень окисления элемента-неметалла в кислоте, нетрудно определить, какой оксид ей соответствует. В нашей кислоте – это оксид SO2, т.е. оксид серы (IV), потому что в этом оксиде степень окисления серы тоже (+4).
Все кислоты имеют соответствующее название и формулу, а также кислотный остаток, который тоже имеет свое название. В таблице приведены некоторые из кислот.