Что такое кислотные остатки
Кислотный остаток
Кислотный остаток — это анион, который является второй частью формулы сложного химического соединения. Они способны замещать определенное количество атомов или групп атомов. Ни у одного кислотного остатка нет свободных реакциоспособных электронов. Как правило, кислотный остаток состоит из атомов неметаллов.
Таблица самых распространенных кислотных остатков
| Кислотный остаток | Валентность | Название | Тривиальное название кислоты |
|---|---|---|---|
| -Cl | I | хлорид | соляная кислота |
| -NO3 | I | нитрат | азотная кислота |
| -SO4 | II | сульфат | серная кислота |
| -SO3 | II | сульфит | сернистая кислота |
| -S | II | сульфид | сероводородная кислота |
| -SiO3 | II | силикат | кремниевая кислота |
| -CO3 | II | карбонат | угольная кислота |
| -PO4 | III | ортофосфат | ортофосфатная кислота |
| -NO2 | I | нитрит | нитритная кислота |
| -F | I | фторид | плавиковая кислота |
| -I | I | иодид | иодидная кислота |
| -Br | I | бромид | бромидная кислота |
Полезное
Смотреть что такое «Кислотный остаток» в других словарях:
кислотный остаток — — [http://slovarionline.ru/anglo russkiy slovar neftegazovoy promyishlennosti/] Тематики нефтегазовая промышленность EN acid residue … Справочник технического переводчика
кислотный остаток — rūgšties liekana statusas T sritis chemija apibrėžtis Rūgšties anijonas. atitikmenys: angl. acid residue rus. кислотный остаток … Chemijos terminų aiškinamasis žodynas
кислотный остаток — кислотный радикал … Cловарь химических синонимов I
кислотный радикал — кислотный остаток … Cловарь химических синонимов I
Эфиры сложные — (хим.) представляют собой сочетания спиртов с кислотами, происходящие путем выделения воды за счет водных остатков этих соединений. Названия [В немецкой химической литературе сложные Э. весьма целесообразно названы, по предложению Гмелина, особым … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Число координатное — химических соединений — Термин введен в науку А. Вернером, который предполагает, что ему удалось открыть закономерность, определяющую состав гидратов, аммиакатов (ср. Кобальтиаковые соединения), двойных (и простых, кислородсодержащих) солей и вообще неорганических и… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Анион — Анион отрицательно заряженный ион. Характеризуется величиной отрицательного электрического заряда; например, Cl− однозарядный анион, а SO42− двузарядный анион. В электрическом поле анионы перемещаются к положительному… … Википедия
диазосоединения — органические соединения общей формулы RN2 (алифатические диазосоединения; R алкил) или ArN2X (ароматические диазосоединения; Ar арил, Х гидроксильная группа или кислотный остаток), из которых наиболее важны последние соли диазония.… … Энциклопедический словарь
ртутьорганические соединения — содержат в молекуле атом ртути, непосредственно связанный с углеродом. Известны ртутьорганические соединения типа R2Hg и RHgX, где R органический радикал, Х галоген, ОН, кислотный остаток. Применяются в органическом синтезе, как фунгициды.… … Энциклопедический словарь
соли — продукты замещения атомов водорода кислоты на металл или групп ОН основания на кислотный остаток. При полном замещении образуются средние, или нормальные, соли (NaCl, K2SO4 и др.), при неполном замещении атомов Н кислые (напр., NaHCO3), неполном … Энциклопедический словарь
Урок 23. Понятие о кислотах
В уроке 23 «Понятие о кислотах» из курса «Химия для чайников» познакомимся со сложными веществами — кислотами; узнаем об индикаторах и как они помогают человеку.
В тексте нашего учебника вам уже неоднократно встречалось слово «кислота». Много раз, конечно, вы слышали это слово и в повседневной жизни. При приготовлении пищи используются уксусная и лимонная кислоты, в домашней аптечке есть борная кислота, в аккумуляторы автомашин заливают серную кислоту и т. д. Отметим, что и в быту, и в производственной деятельности людей используются в основном водные растворы кислот. Познакомимся поближе с этими веществами.
Состав кислот
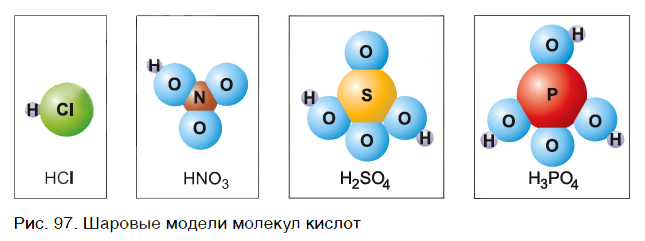
В большинстве случаев в состав молекул кислот входят только атомы неметаллов. На рисунке 97 представлены шаровые модели молекул некоторых кислот и их формулы. Что общего у этих молекул? Ответ прост — в них входят атомы водорода.
Обратим внимание, что в состав молекулы хлороводорода, кроме атома водорода Н, входит атом хлора Cl, молекулы азотной кислоты — группа атомов NO3, молекулы серной кислоты — SO4, молекулы фосфорной кислоты — PO4.
Атом Cl, группы атомов NO3, SO4, PO4, а также другие атомы и группы атомов в составе кислот называют кислотными остатками.
Кислоты — сложные вещества, в состав которых входят атомы водорода, способные замещаться атомами металлов, и кислотные остатки.
Кислотные остатки в молекулах кислот соединены с атомами водорода в соответствии со своей валентностью. Как можно ее определить? Водород всегда одновалентен. Значит, если кислотный остаток в молекуле кислоты соединен с одним атомом водорода, то его валентность равна единице, если с двумя атомами — двум, а с тремя — трем.
При написании формул кислот сначала пишут атомы водорода, а потом кислотные остатки.
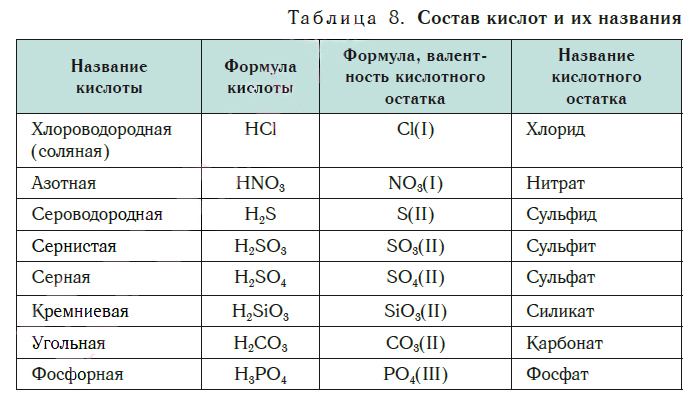
В таблице 8 представлены названия и формулы кислот, с которыми вы будете встречаться при изучении основ химии. Здесь же даны формулы кислотных остатков, которые входят в состав этих кислот, их валентность и названия.
При обычных условиях кислоты существуют в жидком и твердом агрегатных состояниях. Так, фосфорная кислота H3PO4 при комнатной температуре — твердое вещество. При этих же условиях серная кислота H2SO4 — это не имеющая запаха вязкая жидкость. Она почти в 2 раза тяжелее воды. Хлороводородная кислота HCl — раствор газа хлороводорода в воде. Она имеет еще и историческое название «соляная кислота». Раствор этой кислоты имеет характерный запах.
В большинстве случаев кислоты растворяются в воде. Исключение — кремниевая кислота H2SiO3. Водные растворы хлороводородной, серной и фосфорной кислот не имеют окраски. Безводная азотная кислота при хранении желтеет.
Поскольку в состав всех кислот входят атомы водорода, то кислоты обладают общими свойствами: 1) изменяют окраску некоторых органических веществ; 2) имеют кислый вкус (пробовать кислоты на вкус, как и любые другие вещества, запрещается — можно получить ожог полости рта!); 3) оказывают разъедающее действие на кожу человека, ткани, бумагу, древесину и другие материалы.
Меры предосторожности при работе с кислотами
Кислоты — едкие вещества. Попадание кислот на кожу или в глаза может привести к болезненным химическим ожогам. Обращаться с кислотами нужно очень осторожно. При работе с ними следует надевать специальные халаты, перчатки, очки. При попадании кислоты на кожу или в глаза ее необ ходимо немедленно смыть большим количеством воды, а затем пораженный участок промыть раствором питьевой соды. В случае необходимости следует обратиться в медпункт.
Понятие об индикаторах
Некоторые органические вещества изменяют свою окраску в присутствии кислот и ряда других веществ. Такие вещества называют индикаторами, что в переводе с латинского означает «указатель».
Индикаторы — это органические вещества, которые изменяют свою окраску в присутствии кислот и ряда других веществ.
На уроках химии для обнаружения в растворах кислот используют индикаторы лакмус, метиловый оранжевый (метилоранж), а также универсальный индикатор. Это полоска фильтровальной бумаги, пропитанная смесью индикаторов. Окраска индикаторов в воде показана на рисунке 98. Индикаторы изменяют свой цвет, если в растворе есть кислоты (рис. 99).
На заметку: В растворах кислот изменяют цвет сок краснокочанной капусты, вишни, черноплодной рябины, цветки фиалки и др.
Краткие выводы урока:
Надеюсь урок 23 «Понятие о кислотах» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Кислотный остаток
В электрическом поле анионы, будучи заряженными отрицательно, перемещаются к положительному электроду — аноду.
Содержание
Кислотный остаток [ | ]
Анион в сложном неорганическом соединении называется (но не всегда, например это неверно для воды или оксидов металлов) кислотным остатком. Анионы, например, можно выделить в формулах неорганических кислот и солей (Na2SO4, HNO3); в них они пишутся на втором месте (после катиона). Для почти всех кислотных остатков существует соответствующая кислота: например, SO4 2– — «остаток» серной кислоты, Cl – — соляной кислоты. Многие кислоты существуют только в растворах, например, угольная кислота, но её соли (карбонаты) известны. Некоторые кислоты (формулы которых можно искусственно выписать) не существуют (даже в растворах), но формально им приписываются соли, которые существуют и устойчивы. Например, это так для фосфид-иона (P 3– ), который дает соли (фосфиды), не имеющие существующей кислоты. Такие ионы не называются кислотными остатками. Таким образом, не всякий анион является кислотным остатком. А именно, к ним не относится ион кислорода в оксидах, гидроксильный ион в воде, или ионы в солях, не имеющие реально существующей прототипной кислоты. В последнем случае отнесение соединения к классу солей является традицией. Также традицией обусловлено не отнесение воды к классу кислот. То есть строго логически непротиворечивое определение кислоты, кислотного остатка и соли затруднительно.
Химические свойства кислот, их классификация и реакции
Общие свойства кислот. Классификация
Кислоты — класс сложных химических веществ, состоящих из атомов водорода и кислотных остатков.
В первую очередь кислоты делятся на:
Свойства карбоновых кислот подробно разбираются в статье Карбоновые кислоты (ссылка на статью)
В зависимости от количества атомов водорода, которые могут замещаться в химических реакциях различают:
Не смотря на то, что в уксусной кислоте четыре атома водорода, три из них принадлежат кислотному остатку и в реакциях замещения не участвуют. Соответственно, уксусная кислота — одновалентная.
Свойства неорганических кислот также зависят от наличия в их составе кислорода и делятся на
Растворы кислот способны диссоциировать и проводить электрический ток т.е. являются электролитами. В зависимости от степени диссоциации делятся на:
Химические свойства кислот
1. Диссоциация
При диссоциации кислот образуются катионы водорода и анионы кислотного остатка.
Многоосновные кислоты диссоциируют ступенчато.
НРО 2- 4 ↔ Н + + PО З- 4 (третья ступень)
2. Разложение
Кислородсодержащие кислоты разлагаются на оксиды и воду.
Бескислородные на простые вещества
3. Реакция с металлами
Кислоты реагируют лишь с теми металлами, что стоят в ряду активности до кислорода. В результате взаимодействия образуется соль и выделяется водород.
Найти ряд активности можно на последней странице электронного учебника «Химия 9 класс» под редакцией В. В. Еремина.
Бдительные ученики могут сказать: «Золото стоит в ряду активности металлов после водорода, а с „царской водкой“ реагирует. Как же так?»
Из всех правил есть исключения.
Поскольку в состав азотной кислоты входит азот со степенью окисления +5, а в состав серной — сера со степенью окисления +6, то с металлами реагируют не ионы водорода, а более сильные окислители. Образуется соль, но не происходит выделения водорода.
4. Реакции с основаниями
В результате образуются соль и вода, происходит выделение тепла.
Реакции такого типа называются реакциями нейтрализации. Простейшая реакция, которую можно провести на собственной кухне — гашение соды столовым уксусом или 9%раствором уксусной кислоты.
5. Реакции кислот с солями
Вспомним, когда мы разбирали ионные уравнения ( ссылка на статью), одним из условий протекания реакций было образование в ходе взаимодействия нерастворимой соли, выделение летучего газа или слабо диссоциирующего вещества — например, воды. Те же условия сохраняются и для реакций кислот с солями.
6. Реакция кислот с основными и амфотерными оксидами
В ходе реакции образуется соль и происходит выделение воды.
7. Восстановительные свойства бескислородных кислот
Если в окислительных реакциях первую скрипку играет водород, то в восстановительных реакциях основная роль принадлежит анионному остатку. В результате реакций образуются свободные галогены.
Физические свойства кислот
При нормальных условиях (Атмосферное давление = 760 мм рт. ст. Температура воздуха 273,15 K = 0°C) кислоты чаще жидкости, хотя встречаются и твердые вещества: например ортофосфорная H3PO4 или кремниевая H2SiO3.
Некоторые кислоты представляют собой растворы газов в воде: фтороводородная-HF, соляная-HCl, бромоводородная-HBr.
Кислотные свойства кислот в ряду HF → HCl → HBr → HI усиливаются.
Для некоторых кислот (соляная, серная, уксусная) характерен специфический запах.
Благодаря наличию ионов водорода в составе, кислоты обладают характерным кислым вкусом.
Химическая лаборатория не ресторан, и в целях безопасности существует жесткий запрет на опробование на вкус химических веществ.
Как же можно определить кислота в пробирке или нет?
В 1300 году был открыт лакмус, и с тех пор алхимикам и химикам не пришлось рисковать своим здоровьем, пробуя на вкус содержимое пробирок. Запомните, что лакмус в кислой среде краснеет.
Вторым широко используемым индикатором является фенолфталеин.
Простой мнемонический стишок поможет запомнить, как ведут себя индикаторы в разных средах.
Индикатор лакмус — красный
Кислоту укажет ясно.
Индикатор лакмус — синий,
Щёлочь здесь — не будь разиней,
Когда ж нейтральная среда,
Он фиолетовый всегда.
Фенолфталеиновый — в щелочах малиновый
Но несмотря на это в кислотах он без цвета.
Классы неорганических веществ. Гидроксиды, кислоты, соли
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Классы неорганических веществ
Все вещества делятся на простые (элементарные) и сложные. Простые вещества состоят из одного элемента, в состав сложных входит два или более элементов. Простые вещества, в свою очередь разделяются на металлы и неметаллы.
Металлы отличаются характерным «металлическим» блеском, ковкостью, тягучестью, могут прокатываться в листы или вытягиваться в проволоку, обладают хорошей теплопроводностью и электрической проводимостью. При комнатной температуре все металлы (кроме ртути) находятся в твердом состоянии.
Неметаллы не обладают характерным для металлов блеском, хрупки, очень плохо проводят теплоту и электричество. Некоторые из них при обычных условиях газообразны.
Сложные вещества делят на органические, неорганические и элементоорганические. Неорганическая химия охватывает химию всех элементов периодической системы. Свойства органических соединений существенно отличаются от свойств неорганических, а элементоорганические соединения, с учетом их специфики, занимают промежуточное положение. С классификацией органических и элементоорганических соединений удобнее познакомиться при изучении соответствующих разделов химии, посвященных этим соединениям.
Неорганические вещества разделяются на классы либо по составу (двухэлементные, или бинарные, соединения и многоэлементные соединения; кислородсодержащие, азотосодержащие и т.п.), либо по химическим свойствам, т.е. по функциям (кислотно-основным, окислительно-восстановительным и т.д.), которые эти вещества осуществляют в химических реакциях, – по их функциональным признакам.
К важнейшим бинарным соединениям относятся любые соединения только двух различных элементов. Например, бинарными соединениями азота и кислорода являются: N2O, NO, N2O3, NO2, N2O5; бинарные соединения меди и серы: Cu2S, CuS, CuS2. В формулах бинарных соединений металлы всегда предшествуют неметаллам: SnCl2, Al3N. Если бинарное соединение образовано двумя неметаллами, то на первом месте ставится символ того элемента, который располагается левее в следующей последовательности:
B, Si, C, As, P, H, Te, Se, S, I, Br, Cl, N, O, F.
Если бинарное соединение состоит из двух металлов, то первым указывается металл, располагающийся в большом периоде раньше (от начала периода). Если оба металла находятся в одной группе, то первым указывается элемент с большим порядковым номером.
Бинарные соединения подразделяются на классы в зависимости от типа неметалла (табл. 1.2.), а остальные бинарные соединения относят к соединениям между металлами – интерметаллидам.
Таблица 3. Классы бинарных соединений от типа неметалла
| Класс | Неметалл | Пример формулы соединения | Название |
| Галогениды | F, Cl, Br, I | NaCl | Хлорид натрия |
| Оксиды | O | FeO | Оксид железа (II) |
| Халькогениды | S, Se, Te | ZnS | Сульфид цинка |
| Пниктогениды | N, P, As | Li3N | Нитрид лития |
| Гидриды | H | CaH2 | Гидрид кальция |
| Карбиды | C | SiC | Карбид кремния |
| Силициды | Si | FeSi | Силицид железа |
| Бориды | B | Mg3B2 | Борид магния |
Их названия образуются из латинского корня названия неметалла с окончанием «ид» и русского названия менее электроотрицательного элемента в родительном падеже (табл. 3). Если менее электроотрицательный элемент может находиться в разных окислительных состояниях, то после его названия в скобках указывают римскими цифрами его степень окисления. Так, Cu2O – оксид меди (I), CuO- оксид меди (II), CO – оксид углерода (II), CO2 – оксид углерода (IV), SF6 – фторид серы (VI). Можно также вместо степени окисления указывать с помощью греческих числительных приставок (моно-, ди-, три-, тетра-, пента-, гекса- и т.д.) стехиометрический состав соединения: СО – монооксид углерода (приставку «моно» часто опускают), СО2 – диоксид углерода, SF6 – гексафторид серы, Fe3O4 – тетраоксид трижелеза. Для отдельных бинарных соединений сохраняют традиционные названия: Н2О – вода, NН3 – аммиак, РН3 – фосфин.
Оксиды.
Оксиды – сложные вещества, бинарные соединения, состоящие из двух элементов, один из которых является кислород. Атомы кислорода в оксидах связаны ионно или ковалентно с атомами электроположительного элемента и не связаны друг с другом. Например:
Оксиды образуют почти все химические элементы. При образовании названия к слову оксид добавляется название элемента в родительном падеже. Если элемент проявляет переменную степень окисления, то ему соответствует несколько оксидов. В таких случаях при названии оксидов указывается степень окисления римской цифрой в скобках: Fe +2 O –оксид железа (II), Fe +3 2 O3 – оксид железа (III), S +4 O2 – оксид серы (IV), S +6 О3– оксид серы (VI) и др.
По химическим свойствам оксиды можно разделить на солеобразующие (их большинство) и несолеобразующие (безразличные). Примером несолеобразующих оксидов могут служить такие, как NO, N2O. Они не образуют солей. Солеобразующие оксиды подразделяются на кислотные, основные и амфотерные.
К кислотным относят оксиды типичных неметаллов (SО3, N2O5, CO2, P2O5, Сl2O7), а также оксиды некоторых металлов в их высшей степени окисления (СrO3, V2O5, Mn2O7 и др.). Этим оксидам соответствуют кислоты.
Основные оксиды – это оксиды типичных металлов: Na2O, MgO, BaO, CuO, Fe2O3 и др. Им соответствуют гидроксиды (основания).
К амфотерным относятся оксиды некоторых металлов: ZnO, Al2O3, SnO, Сr2O3, РbО и др. Они обладают одновременно свойствами кислотных и основных оксидов. В данной работе амфотерные оксиды и гидроксиды не рассматриваются.
1.Большинство кислотных оксидов взаимодействуют с водой, образуя кислоты:
Оксид кремния (IV) SiO2, а так же кислотные оксиды некоторых металлов (WO3, MoO3) не взаимодействуют с водой. Из основных оксидов в воде растворимы только оксиды щелочных (Li2O, Na2O, K2O) и щелочноземельных металлов (СаО, SrO, BaO), при этом образуются соответствующие гидроксиды:
Оксиды остальных металлов с водой не реагируют и соответствующие им гидроксиды получают косвенным путем.
2. Кислотные оксиды взаимодействуют с гидроксидами и их растворами, образуя соль и воду:
Основные оксиды взаимодействуют с кислотами, также образуя соль и воду:
3.Взаимодействие кислотных оксидов с основными приводит к образованию солей:
Кислоты.
Кислоты – это электролиты, диссоциирующие в водных растворах с образованием только катионов водорода.
Кислоты по своему химическому составу могут быть кислородными (HNO3, HNO2, H2SO4, Н2СО3 и др.) бескислородными (Н2S, НСl, HF, HBr, HCN) и др. Названия кислородных кислот происходят от названия кислотообразователя (центрального атома). Например, Н2СО3 – угольная кислота.
В тех случаях, когда элемент в одной и той же степени окисления образует несколько кислородных кислот, отличающихся между собой количеством атомов водорода и кислорода, к названию кислот добавляются приставки: мета – (наименьшее количество атомов водорода и киcлорода): орто – (наибольшее количество атомов водорода и кислорода). Например, НРО3 – метафосфорная кислота, Н3РO4 – ортофосфорная кислота.
Некоторые кислотообразующие элементы при одной и той же степени окисления образуют несколько кислот, молекулы которых отличаются числом атомов кислотообразователя. Эти кислоты называются изополикислотами. В названии кислоты содержится приставка из русского числительного, показывающая число атомов кислотообразователя в ее молекуле. Например: Н2S2О7 – двусерная кислота; Н2B4O7 – четырехборная кислота; H4P2O7 – двуфосфорная кислота; Н2Сr2О7 – двухромовая кислота.
Таблица 4. Названия наиболее часто употребляемых кислот и кислотных остатков
| Формулы кислоты | Название кислоты | Формула остатка | Название кислотного остатка | ||
| Кислородные кислоты | |||||
| HNO2 | Азотистая | NO‾2 | Нитрит-ион | ||
| HNO3 | Азотная | NO‾3 | Нитрат-ион | ||
| НВО2 | Метаборная | BO‾2 | Метаборат-ион | ||
| Н3ВО3 | Ортоборная | ВО 3 ‾3 | Ортоборат-ион | ||
| H2SiO3 | Метакремневая | SiO 2‾ 3 | Метасиликат-ион | ||
| H2SiO4 | Ортокремневая | SiO 4‾ 4 | Ортосиликат-ион | ||
| H2MnO4 | Марганцовистая | MnO 2‾ 4 | Манганат-ион | ||
| HMnO4 | Марганцевая | MnO‾4 | Перманганат-ион | ||
| HAsO2 | Метамышьяковистая | AsO‾2 | Метаарсенит-ион | ||
| H3AsO4 | Ортомышьяковая | AsO 3 ‾4 | Ортоарсенит-ион | ||
| H2SO3 | Сернистая | SO 2‾ 3 | Сульфит-ион | ||
| HSO‾3 | Гидросульфит-ион | ||||
| H2SO4 | Серная | SO 2 ‾4 | Сульфат-ион | ||
| HSO‾4 | Гидросульфат-ион | ||||
| H2CO3 | Угольная | CO3 2‾ | Карбонат-ион | ||
| HCO‾3 | Гидрокарбонат-ион | ||||
| НРO3 | Метафосфорная | РО‾3 | Метафосфат-ион | ||
| Н3РO4 | Ортофосфорная | РО 3 ‾4 | Ортофосфат-ион | ||
| НРО 2‾ 4 | Гидроортофосфат-ион | ||||
| Н2РО‾4 | Дигидроортофосфат-ион | ||||
| HClO | Хлорноватистая | ClO‾ | Гипохлорит-ион | ||
| НсlО4 | Хлорная | СlO‾4 | Перхлорит-ион | ||
| Бескислородные кислоты | |||||
| НСl | Хлороводородная (соляная) | Хлорид-ион | |||
| HF | Фтороводородная (плавиковая) | F ‾ | Фторид-ион | ||
| НВг | Бромоводородная | Вг‾ | Бромид-ион | ||
| HI | Иодоводородная | I ‾ | Иодид-ион | ||
| H2S | сероводородная | S 2 ‾ | Сульфид-ион | ||
| HS‾ | Гидросульфид-ион | ||||
Названия бескислородных кислот образуются от названия неметалла – кислотообразователя с добавлением слова – водородная. Например: НСl – хлороводородная (соляная) кислота; H2S – сероводородная кислота.
Кроме того, кислоты подразделяются по числу водород-ионов, способных “отщепляться” при диссоциации, на одноосновные (НСl, НNО3, СН3СООН), двухосновные (Н2SО4, Н2СО3, H2S) и многоосновные (Н3РО4, Н3ВО3, Н4P2O7). Анион, который остается после отщепления от молекулы кислоты одного или более водород-иона называется кислотным остатком. Заряд кислотного остатка определяется числом отнятых водород-ионов.
Основность килоты зависит от количества кислотных остатков, соответствующих данной кислоте. Так, одноосновным кислотам соответствует один кислотный остаток:
Двух- и многоосновные кислоты диссоциируют ступенчато, т. е. их молекулы последовательно отщепляются по одному водород – иону, и этим кислотам соответствуют два или более кислотных остатка. Так, молекулы серной кислоты в первую очередь, диссоциируют по уравнению:
Отщепление второго водород – иона идет по уравнению:
Ортофосфорная кислота Н3 РО4 диссоциирует в три ступени и имеет три кислотных остатка:
Следует отметить, что для многоосновных кислот вторая и третья ступени
диссоциации протекают в гораздо меньшей степени, чем первая.
Ступенчатая диссоциация кислот подтверждается наличием кислых солей. Каждый кислотный остаток способен образовать соль с катионом металла, т. е. основность кислоты показывает, сколько солей соответствует данной кислоте.
HSO4 – – гидросульфат – ион
HPO4 2 – – гидроортофосфат – ион
H2PO4 – – дигидроортофосфат – ион
Получение кислот
2. Взаимодействие солей с кислотами (наиболее распространенный способ).
При помощи этих реакций можно получить более слабую или более летучую кислоту, чем исходная.
3. Взаимодействие некоторых неметаллов с водородом:
Водные растворы таких соединений являются кислотами.
Для всех кислот характерны следующие реакции.
1. Все кислоты взаимодействуют с гидроксидами (основаниями): H2SO4 + 2NaOH = Na2SO4 + 2Н2О;
Или в ионной форме:
2Н + + MgO = Mg 2+ + Н2О
3. Разбавление кислоты (кроме азотной и азотистой) реагируют с активными металлами, выделяя водород:
4.Кислоты вступают в реакцию обмена с солями, в результате чего образуется либо нерастворимая соль, либо слабая кислота, либо газ:
Гидроксиды.
Гидроксиды – это электролиты, которые при диссоциации в водных растворах образуют только анионы гидроксила. Например:
Количество гидроксид-ионов в молекуле гидроксида определяется степенью окисления металла. Международные названия оснований происходят от слова гидроксид с добавлением названия металла в родительном падеже. Если металл проявляет переменную степень окисления и может образовать два или три гидроксида, то при названии гидроксида указывается его степень окисления римской цифрой в скобках. Например:
NaOH – гидроксид натрия; Bа (ОН)2 – гидроксид бария ; Fe (ОН)2 – гидроксид железа (II); Fe (ОН)з – гидроксид железа (Ш); Sn (ОН)2 – гидроксид олов (II); Sn (ОН)4 – гидроксид олов (IV).
Гидроксиды, имеющие в составе молекул по два или более гидроксид-ионов называются многокислотными. Они диссоциируют ступенчато:
Ва (ОН) 2 ↔ ВаОН + + ОН‾
Ступенчатые диссоциации гидроксидов подтверждается наличием основных солей, в состав которых входят основные остатки, содержащие гидроксид-ионы. Каждый основной остаток способен образовать соль с кислотным остатком, т. е. кислотность гидроксида показывает, сколько типов солей может образовать данный гидроксид.
Основные остатки называются по названию металла с добавлением слова – ион. Например: Na + – натрий-ион, Ва 2+ – барий-ион. Если металл проявляет переменную степень окисления, то величина заряда его иона указывается римской цифрой в скобках. Например: Fe 2+ – железо (П)-ион; Fe 3+ – железо (Ш)-ион и т. д.
В случае сложных катионов к названию металла добавляются приставки гидроксо-, ди-гидроксо-, тригидроксо-, характеризующие в основном остатке наличие одного, двух или трех гидроксид-ионов. Например:
ВаОН + – гидроксобарий-ион;
FeOH 2+ – гидроксожелезо (Ш)-ион;
Fe(OH) + 2 – гидроксожелезо (Ш)-ион.
В основу классификации гидроксидов положена их растворимость в воде. Гидроксиды, растворимые в воде, называются щелочами. Это гидроксиды щелочных и щелочноземельных металлов: LiOH, NaOH, КОН, Са(ОН)2, Sr(ОН)2, Ва(ОН)2. В промышленности гидроксиды щелочных металлов получают электролизом расплавом солей этих металлов, а в лабораторных условиях – взаимодействием этих металлов или их оксидов с водой. Например:
Или в ионной форме:
Щелочи в растворах почти полностью диссоциируют на ионы. Они относятся к сильным электролитам и в ионных уравнениях записываются в виде ионов.
Большинство гидроксидов в воде практически не растворимы. Их получают действием щелочей на водные растворы соответствующих солей. Например:
FeCl3 + 3NaOH = ↓ Fe (ОН)3 + 3NaCl
Или в ионной форме:
Общие свойства класса гидроксидов (действие на индикаторы, взаимодействие с кислотами, солями, оксидами) обусловлены наличием в их растворах гидроксид-ионов. Наиболее характерными для гидроксидов являются следующие реакции:
1. Гидроксиды (растворимые и нерастворимые основания) реагируют с кислотами.
Или в ионной форме:
2. Щелочи реагируют с кислотными оксидами:
Или в ионной форме:
3. Щелочи реагируют с растворами солей металлов, образуя нерастворимые гидроксиды:
Или в ионной форме:
Соли.
Соли – это электролиты, образующие при диссоциации в водных растворах катионы основных остатков и анионы кислотных остатков.
Названия солей образуется из названия кислотных остатков (в именительном падеже) и названия основного остатка (в родительном). Например: NaCl – хлорид натрия, MgSO4 –сульфат магния, Fe (NO3)3 – нитрат железа (III), KHSO4 – гидросульфат калия, FeOHCl –хлорид гидроксожелеза (П), NaH2PO4 – дигидроортофосфат натрия.
Получение солей
Важнейшие способы получения солей рассмотрены при изложении основных химических свойств оксидов, кислот и гидроксидов. Отметим ряд других методов.
1. Взаимодействие между двумя солями. Реакции этого типа протекают до конца, если один из продуктов выпадает в осадок:
2. Взаимодействие металла с неметаллом. Таким путем получают соли бескислород-ных кислот:
3. Термическое разложение солей:
В зависимости от состава различают средние (нормальные) (КСl, MgSO4), кислые (КНСО3, NaHS), основные (FeOHCl2, MgOHNO3) соли.
Любую соль можно представить как продукт взаимодействия гидроксида и кислоты (реакция нейтрализации). Например:
В данной реакции участвует одинаковое количество гидроксид-ионов и водород-ионов (2ОН‾ и 2Н + ). Получается средняя соль Na2SO4 – сульфат натрия. Если гидроксида взять меньше, чем требуется для полной нейтрализации кислоты (т. е. водород–ионов), то получается кислая соль NaHSO4 – гидросульфат натрия:
Таким образом, кислые соли – продукты неполного замещения водорода кислоты на катионы металла. Они образуются только двух- и многоосновными кислотам (у этих кислот по два и более кислотных остатка). Так, например, ортофосфорная кислота может дать одну среднюю соль и две кислые соли (в зависимости от количества взятого гидроксида):
Или в ионной форме:
Одноосновные кислоты, которым соответствует только один кислотный остаток, не образуют кислых солей.
Кислые соли можно перевести в средние, добавляя в их растворы соответствующие гидроксиды:
Или в ионной форме:
Основные соли содержат в своем составе гидроксид–ионы исходного основания, не замещенные на кислотные остатки. Они образуются при взаимодействии кислоты с избытком гидроксида (основания). Например:
Или в ионной форме:
Основные соли образуются только многокислотными гидроксидами. Так, например, гидроксид железа (III) Fe(OH)3 при взаимодействии с кислотой может образовывать одну среднюю и две основные соли:
Однокислотные гидроксиды (NaOH, КОН) не образуют основных солей, так как этим гидроксидам соответствует только один основный остаток.
Перевод основных солей в средние осуществляют добавлением соответствующих кислот. Например:
Или в ионной форме:
MgOH + + H + ↔ Mg 2+ + H2O;
CuOH + + H + ↔ Cu 2+ + H2O
Все соли, за небольшим исключением HgCl2, CdCl2, относятся к сильным электролитам и в водных растворах полностью диссоциируются на катионы основных остатков и анионы кислотных остатков.
Диссоциация средних солей протекает полностью в одну стадию:
Кислые соли, подобно многоосновным кислотам, диссоциируют ступенчато:
Однако степень диссоциации на второй и третьей ступенях очень мала. Поэтому раствор кислой соли содержит лишь незначительное количество водород–ионов.
Основные соли – диссоциируют также ступенчато. Например:
Однако диссоциация на второй и третьей ступенях настолько мала, что гидроксид-ионов в растворах основных солей практически нет.