Что такое кек физиология
Что такое кек физиология
Азот в крови находится только в растворенном виде, содержание его составляет в среднем 1,2 об. %. Будучи физиологически инертным, азот не участвует в обменных процессах, и измерение его содержания для изучения внешнего дыхания практического значения не имеет.
Так как основной задачей системы внешнего дыхания является поддержание на уровне констант содержания кислорода и углекислоты в крови, определение показателей, характеризующих газы крови, представляет значительный интерес для оценки функционального состояния легких.
В практической работе представляется полезным определение содержания и парциального давления кислорода и углекислоты в артериальной крови, поскольку содержание этих газов в венозной крови различных органов и даже в смешанной венозной крови, получаемой при катетеризации легочной артерии, зависит не столько от функции внешнего дыхания, сколько от уровня обмена веществ и скорости кровотока (Comroe с соавт.). Кислород, особенно углекислота, являются важнейшими компонентами буферных систем крови, вследствие чего исследование газов крови и кислотно-щелочного равновесия тесно взаимосвязаны.
Основными показателями, характеризующими газовый состав артериальной крови, считаются кислородная емкость крови в об.%, содержание кислорода и углекислоты в об.%, парциальное давление (напряжение) кислорода и углекислоты в миллиметрах ртутного столба, артерио-венозная разница по кислороду и венозно-артериальная разница по углекислоте в об.%. степень насыщения крови кислородом в процентах.
Кислородная емкость крови — максимальное количество кислорода, которое может быть связано кровью. В среднем 1 г гемоглобина связывает около 1,35 см3 кислорода. Поэтому кислородная емкость крови зависит не от функции внешнего дыхания, а от содержания гемоглобина. Содержание кислорода в крови также зависит не только от эффективности вентиляции, диффузии и газообмена в легких, но и от содержания гемоглобина в крови.
Весьма чувствительными показателями считаются парциальное давление (напряжение) кислорода и углекислоты. Определение парциального давления С02 может быть проведено вместе с измерением рН крови по методу Аструпа. Что же касается измерения парциального давления кислорода крови, то методика его сложна и вследствие этого не получила распространения в клинической практике.
Наибольшее практическое значение вполне оправданно отводится определению степени насыщения крови кислородом, методика которого в настоящее время значительно усовершенствована, и это исследование получило широкое распространение в клинике торакальной хирургии.
Методы определения степени насыщения крови кислородом разделяются на газометрические (манометрические) и оксигемометрические (спектрофотометрические). К первым относятся методы Ван-Слайка и Баркрофта. Газометрический способ Ван-Слайка основывается на принципах И. М. Сеченова — извлечение газов из крови в вакууме — и Холдейна — вытеснение газов химическими реактивами.
Исследование газов крови на аппарате Ван-Слайка получило широкое распространение в клинической физиологии. К числу достоинств этого метода относится высокая точность результатов и возможность определения содержания кислорода и углекислоты. Однако длительность и трудоемкость исследования, необходимость относительно большого количества крови (1 мл), для чего требуется пункция артерии, ограничивают его применение в практической работе легочного хирурга, тем более, что определение наиболее важного показателя — степени насыщения крови кислородом — в настоящее время обычно производится с помощью оксигемометрии — метода, значительно более доступного и мало уступающего в точности.
Поэтому показания к применению определения газов крови методом Ван-Слайка в легочной хирургии значительно ограничены, хотя он еще не потерял значения в исследовательской работе.
— Вернуться в оглавление раздела «Пульмонология.»
Кислородная емкость крови (КЕК)



Кислородная емкость зависит от:
1) количества гемоглобина.
2) температуры крови (при нагревании крови снижается)
3) рН (при закислении снижается)
4) содержания СО2 ( при повышении снижается).
3.Рефлекторные влияния на дыхание с рецепторов легких, воздухоностных путей и дыхательных мышц. Хеморецепторы и их роль в регуляции дыхания(артериальные и центральные хеморецепторы).
Для нормальной работы дыхательных нейронов, правильного чередования вдоха – выдоха необходима импульсация:
1) с хеморецепторов центральных и периферических;
2) с механорецепторов:
а) ирритантных воздухоносных путей;
б) рецепторного растяжения легких.
3) с проприорецепторов дыхательных мышц.
Рефлексы с хеморецепторов.
Периферические или артериальные – в дуге аорты и каротидных синусах возбуждаются через 3 – 5с.
Аортальные при снижении РО2 до 80 – 20мм рт ст., вызывают учащение сердцебиений, гипоксический стимул.
Каротидные – при повышении СО2 (гиперкапнический стимул) и Н + (ацидотический стимул) – обеспечивают увеличение частоты дыхания.
Центральные (медуллярные) рецепторы обнаружены в продолговатом мозге. Реагируют на Н + и концентрацию СО2 во внеклеточной жидкости. Возбуждаются позже периферических, оказывают более сильное и длительное влияние на ДЦ, чем периферические каротидные.
> СО2, > Н2 увеличивают легочную вентиляцию за счет увеличения ЧД и ДО.
Рефлексы с механорецепторов.
Механорецепторы дыхательной системы выполняют 2 функции:
1) регуляция глубины и длительности вдоха, смена его выдохом;
2) обеспечивают защитные дыхательные рефлексы.
Роль рецепторов растяжения легких.
Они локализованы в гладкомышечном слое стенок трахеобронхиального дерева. Возбуждаются при растяжении дыхательных путей и легких при вдохе.
Афферентные сигналы идут по волокнам блуждающего нерва.
Итог возбуждения – торможение вдоха и его смена выдохом (рефлекс Геринга – Брейера).
Выключение информации с рецепторов растяжения приводит к углубленным, затянутым вдохам, как и при нарушении связей с пневмотоксическим центром. Если прекратить связь с рецепторами растяжения и ПТЦ, то дыхание останавливается на вдохе, иногда прерываясь короткими экспирациями – апнейзис.
Ирритантные рецепторы(механо и хемочувствительные) расположены в эпителиальном и субэпителиальном слоях стенок воздухоносных путей.
Ирритационные рецепторы возбуждаются:
1) резким изменением объема легких. Участвуют в формировании рефлекса на спадение бронхов – бронхокострикцию;
2) возбуждаются при неравномерной вентиляции легких – обеспечивает «вздохи» 3 раза в час для улучшения вентиляции и расправления легких;
3) возбуждаются при снижении растяжимости легочной ткани при бронхиальной астме, отеке легких, пневмотораксе, застое крови в малом круге кровообращения, вызывая характерную одышку и чувство жжения, першения в горле.
4) возбуждаются пылевыми частицами и накапливающейся слизью – защитные рефлексы. Если ирритантные рецепторы трахеи – кашель; бронхов увеличивается частота дыхания.
5) возбуждаются хеморецепторы при действии паров едких веществ (аммиак, эфир, табачный дым и т. д.).
6) есть J – рецепторы в интерстиции легких, реагируют на гистамин, простагландин – в ответ частое, поверхностное дыхание (тахипное).
Рефлексы с проприорецепторов дыхательных мышц.
В диафрагме их мало. Большое значение имеют проприорецепторы межреберных мышц и вспомогательные дыхательные мышцы:
1) возбуждаются если вдох или выдох затруднен, мышцы растянуты, в результате этого сокращение мышцы увеличивается (проприоцептивный рефлекс). Таким образом, автоматически регулируется сила сокращения дыхательных мышц при сужении бронхов, спазме голосовой щели, набухании слизистой дыхательных путей.
2) проприорецепторы дыхательных мышц возбуждаются при возбуждении γ – мотонейрона – например, произвольная регуляция дыхания.
Что такое кек физиология
4.1. Транспорт кислорода
В сложных механизмах транспорта газов кровью и газообмена в тканях важная роль отводится эритроцитам, ответственным за доставку О2 к различным органам и удаление образующегося в процессе метаболизма СО2.
Эритроцит – безъядерная клетка, лишенная митохондрий, основным источником энергии для эритроцита служит глюкоза, метаболизируемая в гексозомонофосфатном шунте или цикле Эмбдена-Мейергофа. Транспорт О2 обеспечивается в значительной мере гемоглобином, состоящим из белка глобина и гема. Последний представляет собой комплексное соединение железа и порфирина. Глобин представляет собой тетрамер полипептидной цепи. Hb A (HbA) – основной гемоглобин взрослых содержит 2 – альфа и 2 – бета – цепи, Hb A2 – содержит две альфа и две дельта цепи.
Гем состоит из иона железа, встроенного в порфириновое кольцо. Ион железа гема обратимо связывает одну молекулу О2. С одной молекулой Hb максимально связываются 4 молекулы О2 с образованием оксигемоглобина.
Гем может подвергаться не только оксигенации, но и истинному окислению, когда железо становится из двухвалентного трехвалентным. Окисленный гем носит название гематина, а молекула гемоглобина становится метгемоглобином. В крови человека метгемоглобин находится в незначительных количествах, его уровень резко возрастает при отравлениях. Метгемоглобин не способен отдавать кислород тканям.
В норме метгемоглобин составляет менее 3% общего Hb крови. Основная форма транспорта О2 – в виде оксигемоглобина. Кислород транспортируется артериальной кровью не только в связи с гемоглобином, но и в растворенном виде. Принимая во внимание тот факт, что 1 г Hb может связать 1,34 мл О2, кислородная емкость крови в среднем у взрослого человека составляет около 200 мл/л крови. Одним из показателей кислородного транспорта является насыщение артериальной крови О2(Sa O2), равного отношению О2, связанного с Hb, к кислородной емкости крови:
SaO2=O2, связанного с Hb/O2 емкость крови* 100%.
В соответствии с кривой диссоциации оксигемоглобина насыщение артериальной крови кислородом в среднем составляет 97%, в венозной крови – 75%.
PaO2 в артериальной крови около 100 мм. рт. ст., а в венозной – около 40 мм. рт. ст.
Количество растворенного кислорода в крови пропорционально парциальному давлению О2 и коэффициэнту его растворимости.
Последний для О2 составляет 0,0031/100 мл крови/ 1 мм. рт. ст.. Таким образом, 100 мл крови при PaO2, равном 100 мм. рт. ст., содержит менее 0,31 мл O2.
Диссоциация оксигемоглобина в тканях обусловлена главным образом химическими свойствами гемоглобина, а также рядом других факторов – температурой тела, рН среды, р СО2.
При понижении температуры тела наклон кривой диссоциации оксигемоглобина возрастает, а при ее повышении – снижается, и соответственно снижается сродство Hb к О2.
При снижении рН, т.е. при закислении среды, сродство гемоглобина к О2 уменьшается. Увеличение напряжения в крови СО2 также сопровождается снижением сродства Hb к О2 и уплощением кривой диссоциации оксигемоглобина.
Известно, что степень диссоциации оксигемоглобина определяется содержанием в эритроцитах некоторых фосфорорганических соединений, главным из которых является 2,3 – ДФГ (2,3 дифосфоглицерат), а также содержанием в эритроцитах катионов. В случаях развития алкалозов, поглощение О2 в легких увеличивается, но в то же время затрудняется отдача кислорода тканями. При ацидозах наблюдается обратная картина.
4.2.Утилизация кислорода тканями
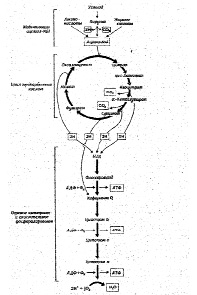
Тканевое или клеточное дыхание включает три стадии. На первой стадии пируват, аминокислоты и жирные кислоты окисляются до двухуглеродных фрагментов ацетильных групп, входящих в состав ацетилкофермента А. Последние на втором этапе окисления включаются в цикл лимонной кислоты, где происходит образование высокоэнергетических атомов водорода и высвобождение СО2 – конечного продукта окисления органических субстратов. На третьей стадии клеточного дыхания атомы водорода делятся на протоны (Н+) и «высокоэнергетические» электроны, передающиеся по дыхательной цепи на молекулярный О2 и восстанавливающие его до НО2. Перенос электронов сопряжен с запасом энергии в форме АТФ, т.е. с окислительным фосфорилированием (рис.6).
Касаясь патогенеза метаболических сдвигов, свойственных гипоксическим состояниям, следует отметить, что в организме человека более 90% всего потребляемого кислорода восстанавливается с участием цитохромоксидазы митохондрий, и лишь около 10% кислорода метаболизируется в тканях с участием оксигеназ: диоксигеназы и монооксигеназы.
Рис.6. Схема тканевого дыхания. Конечные продукты каждой стадии даны в рамке (Ленинджер А., 1999)
Наиболее многочисленны и сложны монооксигеназные реакции, протекающие в эндоплазматическом ретикулуме клеток при участии цитохрома Р-450 и обеспечивающие гидроксилирование субстрата (стероидных гормонов, лекарственных препаратов и различных др. соединений) и, как правило, его инактивацию.
Диоксигеназы катализируют реакции, в которых в молекулу органического субстрата включаются оба атома молекулы кислорода (например, реакция окисления катехола молекулярным кислородом с раскрытием кольца).
В реакциях, связанных с переносом электронов, т.е. в реакциях окисления-восстановления, где, как указывалось выше, используется более 90% потребляемого кислорода, атомы водорода, отщепленные дегидрогеназами от субстратов в цикле лимонной кислоты, передают свои электроны в цепь переноса электронов и превращаются также в Н +. Как известно, помимо 4 пар атомов водорода, поставляемых каждым оборотом цикла лимонной кислоты, образуются и другие атомы водорода, отщепленные дегидрогеназами от пирувата, жирных кислот и аминокислот в процессе их расщепления до Ацетил-СоА и других продуктов.
Таким образом, все атомы водорода, отщепляемые дегидрогеназами от субстратов, передают свои электроны в дыхательную цепь к конечному акцептору электронов – кислороду.
Скорость утилизации О2 в различных тканях различна. В среднем взрослый человек потребляет 250 мл О2 в 1 мин. Максимальное извлечение О2 из притекающей артериальной крови свойственно миокарду.
Кислород используется в клетках, в основном в метаболизме белков, жиров, углеводов, ксенобиотиков, в окислительно-восстановительных реакциях в различных субклеточных фракциях: в митохондриях, в эндоплазматическом ретикулуме, в реакциях липопероксидации, а также в межклеточном матриксе и в биологических жидкостях.
Коэффициент утилизации О2 в тканях равен отношению потребления О2 к интенсивности его доставки, широко варьирует в различных органах и тканях.
В условиях нормы минимальную потребность в О2 проявляют почки и селезенка, а максимальную потребность – кора головного мозга, миокард и скелетные мышцы, где коэффициент утилизации О2 колеблется от 0,4 до 0,6, а в миокарде до 0,7. При крайне интенсивной физической работе коэффициент утилизации О2 мышцами и миокардом может возрастать до 0,9.
Обмен дыхательных газов в тканях происходит в процессе свободной и облегченной диффузии. При этом О2 переносится по градиенту напряжения газа из эритроцитов и плазмы крови в окружающие ткани.
Одновременно происходит диффузия СО2 из тканей в кровь. На выход О2 из крови в ткани влияет диссоциация оксигемоглобина в эритроцитах, что обеспечивает так называемую облегченную диффузию О2. Интенсивность диффузионного потока О2 и СО2 определяется градиентом их напряжения между кровью и тканями, а также площадью газообмена, плотностью капилляров, распределением кровотока в микроциркуляторном русле. Интенсивность окислительных процессов в тканях определяется величиной критического напряжения О2 в митохондриях, которое в условиях нормы должно превосходить 0,1-1 мм рт. ст.
Соответствие доставки О2 к органам и тканям, возросшим потребностям в оксигенации обеспечивается на клеточном, органном уровнях за счет образования метаболитов изнашивания, а также при участии нервных, гормональных и гуморальных влияний.
Основная масса углекислого газа (СО2) образуется в организме как конечный продукт различных метаболических реакций и транспортируется к легким с кровью. Вдыхаемый воздух содержит лишь незначительное количество СО2.
Транспорт СО2 кровью осуществляется в 3-х состояниях: в виде аниона бикарбоната, в растворенной форме и в виде карбаминовых соединений.
СО2 хорошо растворяется в плазме крови и в артериальной крови, около 5% от общей двуокиси углерода содержится в крови в растворенной форме.
Третьей формой транспорта СО2 кровью являются карбаминовые соединения, образованные взаимодействием СО2 с концевыми группами белков крови преимущественно с гемоглобином:
Карбаминовые соединения составляют около 5% от общего количества СО2, транспортируемого кровью.
В оксигенированной артериальной крови напряжение СО2 составляет 40 мм. рт. ст., а в венозной крови Рv СО2 равно 46 мм. рт. ст.
4.4.Связывание гемоглобина с окисью углерода
Что такое кек физиология
10.1. Классификация гипоксических состояний
Гипоксия – типовой патологический процесс, характеризующийся снижением содержания кислорода в крови (гипоксемией) и тканях, развитием комплекса вторичных неспецифических метаболических и функциональных расстройств, а также реакцией адаптации.
Первая классификация гипоксических состояний была предложена Баркрофтом (1925), а затем дополнена и усовершенствована И.Р. Петровым (1949). Классификация И.Р. Петрова используется и в наше время. Согласно этой классификации различают гипоксии экзогенного и эндогенного происхождения.
В основе гипоксии экзогенного происхождения лежит недостаток кислорода во вдыхаемом воздухе, в связи с чем выделяют нормобарическую и гипобарическую гипоксию. К гипоксиям эндогенного происхождения относятся следующие типы:
а) дыхательная (респираторная); б) сердечно-сосудистая (циркуляторная); в) гемическая (кровяная); г) тканевая (гистотоксическая); д) смешанная.
По течению различают:
• молниеносную (в течение нескольких секунд, например, при разгерметизации летательных аппаратов на большой высоте);
• острую (которая развивается через несколько минут или в пределах часа в результате острой кровопотери, острой сердечной или дыхательной недостаточности, при отравлении угарным газом, цианидами, при шоке, коллапсе);
• подострую (она формируется в течение нескольких часов при попадании в организм метгемоглобинообразователей, таких как нитраты, бензол, а в ряде случаев в результате медленно нарастающей дыхательной или сердечной недостаточности;
• хроническую гипоксию, которая возникает при дыхательной и сердечной недостаточности и других формах патологии, а также при хронической анемии, пребывании в шахтах, колодцах, при работе в водолазных и защитных костюмах.
а) местную (локальную) гипоксию, развивающуюся при ишемии, венозной гиперемии, престазе и стазе в зоне воспаления;
б) общую (системную) гипоксию, которая наблюдается при гиповолемии, сердечной недостаточности, шоке, коллапсе, ДВС-синдроме, анемиях.
Известно, что наиболее устойчивыми к гипоксии являются кости, хрящи и сухожилия, которые сохраняют нормальную структуру и жизнеспособность в течение многих часов при полном прекращении снабжения кислородом. Поперечно-полосатые мышцы выдерживают гипоксию в течение 2 часов; почки, печень – 20-30 минут. Наиболее чувствительна к гипоксии кора головного мозга.
10.2. Общая характеристика этиологических и патогенетических факторов гипоксий экзогенного и эндогенного происхождения
Экзогенный тип гипоксии развивается при уменьшении парциального давления кислорода в воздухе, поступающем в организм. При нормальном барометрическом давлении говорят о нормобарической экзогенной гипоксии (примером может служить нахождение в замкнутых помещениях малого объема). При снижении барометрического давления развивается гипобарическая экзогенная гипоксия (последнее наблюдается при подъеме на высоту, где РО2 воздуха снижено примерно до 100 мм рт. ст. Установлено, что при снижении РО2 до 50 мм рт. ст. возникают тяжелые расстройства, несовместимые с жизнью).
В ответ на изменение показателей газового состава крови (гипоксемию и гиперкапнию) возбуждаются хеморецепторы аорты, каротидных клубочков, центральные хеморецепторы, что вызывает стимуляцию бульбарного дыхательного центра, развитие тахи- и гиперпное, газового алкалоза, увеличение числа функционирующих альвеол.
Эндогенные гипоксические состояния являются в большинстве случаев результатом патологических процессов и болезней, приводящих к нарушению газообмена в легких, недостаточному транспорту кислорода к органам или к нарушению его утилизации тканями.
Дыхательная (респираторная) гипоксия
Респираторная гипоксия возникает вследствие недостаточности газообмена в легких, которая может быть обусловлена следующими причинами: альвеолярной гиповентиляцией, сниженной перфузией кровью легких, нарушением диффузии кислорода через аэрогематический барьер, и соответственно, нарушением вентиляционно-перфузионного соотношения. Патогенетическую основу дыхательной гипоксии составляют снижение содержания оксигемоглобина, повышение концентрации восстановленного гемоглобина, гиперкапния и газовый ацидоз.
Гиповентиляция легких является результатом действия ряда патогенетических факторов:
а) нарушения биомеханических свойств дыхательного аппарата при обструктивных и рестриктивных формах патологии;
б) расстройств нервной и гуморальной регуляции вентиляции легких;
в) снижения перфузии легких кровью и нарушения диффузии О2 через аэрогематический барьер;
г) избыточного внутри- и внелегочного шунтирования венозной крови.
Циркуляторная (сердечно-сосудистая, гемодинамическая) гипоксия развивается при локальных, региональных и системных нарушениях гемодинамики. В зависимости от механизмов развития циркуляторной гипоксии можно выделить ишемическую и застойную формы. В основе циркуляторной гипоксии может лежать абсолютная недостаточность кровообращения или относительная при резком возрастании потребности тканей в кислородном обеспечении (при стрессорных ситуациях).
Генерализованная циркуляторная гипоксия возникает при сердечной недостаточности, шоке, коллапсе, обезвоживании организма, ДВС-синд-роме и т.д., причем, если нарушения гемодинамики возникают в большом круге кровообращения, насыщение крови кислородом в легких может быть нормальным, а нарушается его доставка к тканям в связи с развитием венозной гиперемии и застойных явлений в большом круге кровообращения. При нарушениях гемодинамики в сосудах малого круга кровообращения страдает оксигенация артериальной крови. Локальная циркуляторная гипоксия возникает в зоне тромбоза, эмболии, ишемии, венозной гиперемии в тех или иных органах и тканях.
Особое место занимает гипоксия, связанная с нарушением транспорта кислорода в клетки при снижении проницаемости мембран для О2. Последнее наблюдается при интерстициальном отеке легких, внутриклеточной гипергидратации.
Для циркуляторной гипоксии характерны: снижение РаО2, увеличение утилизации О2 тканями вследствие замедления кровотока и активации системы цитохром, возрастание уровня ионов водорода и углекислого газа в тканях. Нарушение газового состава крови приводит к рефлекторной активации дыхательного центра, развитию гиперпноэ, увеличению скорости диссоциации оксигемоглобина в тканях.
Гемический (кровяной) тип гипоксии возникает в результате уменьшения эффективной кислородной емкости крови и, следовательно, ее кислород транспортирующей функции. Транспорт кислорода от легких к тканям почти полностью осуществляется при участии Hb. Главными звеньями снижения кислородной емкости крови являются:
1) уменьшение содержания Нb в единице объема крови и в полном объеме, например, при выраженных анемиях, обусловленных нарушением костно-мозгового кроветворения различного генеза, при постгеморрагических и гемолитической анемиях.
2) нарушение транспортных свойств Нb, которое может быть обусловлено либо снижением способности Нb эритроцитов связывать кислород в капиллярах легких, либо транспортировать и отдавать оптимальное количество его в тканях, что наблюдается при наследственных и приобретенных гемоглобинопатиях.
Достаточно часто гемическая гипоксия наблюдается при отравлении окисью углерода («угарным газом»), так как окись углерода обладает чрезвычайно высоким сродством к гемоглобину, почти в 300 раз превосходя сродство к нему кислорода. При взаимодействии окиси углерода с гемоглобином крови образуется карбоксигемоглобин, лишенный способности транспортировать и отдавать кислород.
Окись углерода содержится в высокой концентрации в выхлопных газах двигателей внутреннего сгорания, в бытовом газе и т.д.
Выраженные нарушения жизнедеятельности организма развиваются при увеличении содержания в крови НbСО до 50% (от общей концентрации гемоглобина). Повышение его уровня до 70-75 % приводит к тяжелой гипоксемии и летальному исходу.
Карбоксигемоглобин имеет ярко-красный цвет, поэтому при его избыточном образовании в организме кожа и слизистые становятся красными. Устранение СО из вдыхаемого воздуха приводит к диссоциации НbСО, но этот процесс протекает медленно и занимает несколько часов.
Воздействие на организм ряда химических соединений (нитратов, нитритов, окисла азота, бензола, некоторых токсинов инфекционного происхождения, лекарственных средств: феназепама, амидопирина, сульфаниламидов, продуктов ПОЛ и т.д.) приводит к образованию метгемоглобина, который не способен переносить кислород, так как содержит окисную форму железа (Fe3+).
Окисная форма Fe3+ обычно находится в связи с гидроксилом (ОН-). МетНb имеет темно-коричневую окраску и, именно этот оттенок приобретают кровь и ткани организма. Процесс образования метНb носит обратимый характер, однако его восстановление в нормальный гемоглобин происходит относительно медленно (в течение нескольких часов), когда железо Нb вновь переходит в закисную форму. Образование метгемоглобина не только снижает кислородную емкость крови, но и уменьшает способность активного оксигемоглобина диссоциировать с отдачей кислорода тканям.
Тканевая (гистотоксическая) гипоксия развивается вследствие нарушения способности клеток поглощать кислород (при нормальной его доставке к клетке) или в связи с уменьшением эффективности биологического окисления в результате разобщения окисления и фосфорилирования.
Развитие тканевой гипоксии связывают со следующими патогенетическими факторами:
1. Нарушением активности ферментов биологического окисления в процессе:
а) специфического связывания активных центров фермента, например, цианидами и некоторыми антибиотиками;
б) связывания SН-групп белковой части фермента ионами тяжелых металлов (Аg2+, Нg2+, Сu2+), в результате чего образуются неактивные формы фермента;
в) конкурентного блокирования активного центра фермента веществами, имеющими структурную аналогию с естественным субстратом реакции (оксалаты, малонаты).
2. Нарушением синтеза ферментов, которое может возникать при дефиците витаминов В1 (тиамина), ВЗ (РР), никотиновой кислоты и др., а также при кахексии различного происхождения.
3. Отклонениями от оптимума физико-химических параметров внутренней среды организма: рН, температуры, концентрации электролитов и др. Эти изменения возникают при разнообразных заболеваниях и патологических состояниях (гипотермиях и гипертермиях, недостаточности почек, сердца и печени, анемиях) и снижают эффективность биологического окисления.
4. Дезинтеграцией биологических мембран, обусловленной воздействием патогенных факторов инфекционной и неинфекционной природы, сопровождающейся снижением степени сопряжения окисления и фосфорилирования, подавлением образования макроэргических соединений в дыхательной цепи. Способностью разобщать окислительное фосфорилирование и дыхание в митохондриях обладают: избыток ионов Н+ и Са2+, свободных жирных кислот, адреналина, тироксина и трийодтиронина, некоторых лекарственных веществ (дикумарина, грамицидина и др.). В этих условиях увеличиваются расход кислорода тканями. В случаях набухания митохондрий, разобщения окислительного фосфорилирования и дыхания большая часть энергии трансформируется в тепло и не используется для ресинтеза макроергов. Эффективность биологического окисления снижается.