Что такое изобары в химии
Изобары (в химии)
Смотреть что такое «Изобары (в химии)» в других словарях:
ИЗОБАРЫ — атомы, являющиеся разными хим. элементами, но обладающие одинаковым массовым числом, т.е. характеризующиеся разным числом протонов и нейтронов но одинаковой их суммой. В физ. химии И. линии на диаграммах, характеризующие разл. физ. состояние… … Геологическая энциклопедия
АЗЕОТРОПНЫЕ СМЕСИ — (азеотропы) (от греч. а приставка, означающая отрицание или отсутствие к. л. свойства, киплю и поворот, изменение), жидкие смеси, характеризующиеся равенством составов равновесных жидкой и паровой фаз. При их перегонке образуется конденсат того… … Химическая энциклопедия
Термодинамика химическая — раздел физической химии (См. Физическая химия), рассматривающий термодинамические явления в области химии, а также зависимости термодинамических свойств веществ от их состава и агрегатного состояния. Т. х. тесно связана с термохимией (См … Большая советская энциклопедия
Знаки химические — химические символы, сокращённые буквенные обозначения химических элементов. Современные З. х. (см. таблицу) состоят из первой буквы или первой и одной из следующих букв латинского названия элементов. В формулах химических (См.… … Большая советская энциклопедия
ЯДРО АТОМНОЕ — центральная массивная часть атома, состоящая из протонов и нейтронов. Масса Я. а. примерно в 4 х 103 раз больше массы всех входящих в состав атома электронов. Размеры Я. а. составляют 10 12 10 13 см. Электрич. заряд положителен и по абс. величине … Химическая энциклопедия
Равновесие химическое — состояние системы, в которой обратимо протекает одна или несколько реакций химических (См. Реакции химические), причём для каждой из них скорости прямой и обратной реакций равны, вследствие чего состав системы остаётся постоянным, пока… … Большая советская энциклопедия
ТЕПЛОВОЙ ЭФФЕКТ РЕАКЦИИ — теплота, выделенная или поглощенная термодинамич. системой при протекании в ней хим. р ции. Определяется при условии, что система не совершает никакой работы (кроме возможной работы расширения), а т ры реагентов и продуктов равны. Поскольку… … Химическая энциклопедия
Атмосферное давление — Эксперимент XVII века. Две металлические полусферы, между которыми откачали воздух, не смогли разделить две восьмёрки лошадей, которые одновременно тянули их в разные стороны. Атмосферное давл … Википедия
Изобар
Изоба́ры (в ед.ч. изоба́р; др.-греч. ισος, isos — «одинаковый» + βαρος, baros — «вес») — нуклиды, имеющие одинаковое массовое число; например, изобарами являются 40 Ar, 40 K, 40 Ca. Хотя массовое число (т. е. число нуклонов) A = N + Z в ядрах-изобарах одинаково, числа протонов Z и нейтронов N различаются: 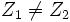
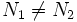
Те виды радиоактивного распада, которые не изменяют массовое число (бета-распад, двойной бета-распад, изомерный переход), переводят одно ядро-изобар в другое. Поскольку распады такого рода происходят в направлении уменьшения избытка массы, последовательность таких распадов заканчивается на ядре, представляющем энергетический минимум в данной изобарической цепочке (бета-стабильное ядро). Для ядер с чётным массовым числом таких локальных минимумов на изобарической цепочке может быть от 1 до 3, поскольку чётно-чётные ядра (Z и N чётны) благодаря энергии спаривания имеют бо́льшую энергию связи, чем нечётно-нечётные ядра с тем же массовым числом. Локальные минимумы отличаются зарядом ядра на 2 единицы (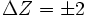
См. также
Полезное
Смотреть что такое «Изобар» в других словарях:
Изобар — Действующее вещество ›› Триамтерен* (Triamterene*) Латинское название Isobar Фармакологическая группа: Диуретики Нозологическая классификация (МКБ 10) ›› I10 I15 Болезни, характеризующиеся повышенным кровяным давлением Состав и форма выпуска 1… … Словарь медицинских препаратов
изобар — см. изобары. Толковый словарь иностранных слов Л. П. Крысина. М: Русский язык, 1998 … Словарь иностранных слов русского языка
изобар — нареч, кол во синонимов: 1 • изобара (2) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
изобар — (напр., радиоактивный, ядерный) [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN isobar … Справочник технического переводчика
изобар — izobaras statusas T sritis fizika atitikmenys: angl. isobar vok. Isobar, n rus. изобар, m pranc. isobare, m … Fizikos terminų žodynas
изобар — (2 м); мн. изоба/ры, Р. изоба/ров (в физике) … Орфографический словарь русского языка
изобар-аналоговый — изобар аналоговый … Орфографический словарь-справочник
изобар-аналоговый — изоба/р ана/логовый … Слитно. Раздельно. Через дефис.
Метод карт изобар — ► isobar chart technique Метод подсчета запасов нефти с помощью карт изобар. Основан на установлении зависимости между отбором нефти из пласта и средним пластовым давлением на разные даты разработки пласта. Регистрация отбора нефти (и газа) не… … Нефтегазовая микроэнциклопедия
Карта изобар — ► pressure chart Карта, показывающая распределение пластового динамического давления в разрабатываемой нефтяной залежи. Анализ карт изобар позволяет правильно ориентировать разработку залежи нефти путем ограничения и снижения отбора жидкости из… … Нефтегазовая микроэнциклопедия
Изотопы, изотоны, изобары.



Лекция 2. ФИЗИЧЕСКАЯ ХАРАКТЕРИСТИКА АТОМОВ. ЯВЛЕНИЕ РАДИОАКТИВНОСТИ И РАДИОАКТИВНЫЙ РАСПАД ЯДЕР.
1. Строение атома. Элементарные частицы.
2. Виды радиоактивного распада.
3. Закон радиоактивного распада.
Вопрос 1. Строение атома. Элементарные частицы
Окружающий нас мир построен из множества атомов различных элементов. Их размеры очень малы. Диаметр самого легкого атома водорода составляет одну стомиллионную часть сантиметра.
В 1911 году Э. Резерфорд предложил планетарную модель строения атома, которая была развита Н. Бором (1913). Согласно этой модели, в центре атома расположено ядро, имеющее положительный электрический заряд. Вокруг ядра перемещаются по эллиптическим орбитам электроны, образующие электронную оболочку атома.
Любой атом состоит из элементарных частиц: протонов, нейтронов и электронов, которые в свободном состоянии характеризуются такими физическими величинами, как масса, электрический заряд (или его отсутствие), устойчивость, скорость т.д. Массу ядер и элементарных частиц обычно выражают в атомных единицах массы (а.е.м.), за единицу принята 1\12массы атомы углерода ( 12 С).
Энергия выражается в электрон-вольтах (эВ), один электрон-вольт равен кинетической энергии, которую приобретает электрон (или любая элементарная частица вещества, имеющая заряд) при прохождении электрического поля с разностью потенциалов в один вольт.
Атомное ядро – центральная часть атома, в которой сосредоточена почти вся масса (99,9%). Атомное ядро состоит из двух типов элементарных частиц – протонов и нейтронов. Общее название их – нуклон. Протон и электрон относятся к так называемым устойчивым и стабильным частицам, нейтрон стабилен, лишь находясь в ядре.
Суммарное число протонов и нейтронов в ядре называют массовым числом и обозначают буквой А (или М). Так как заряд нейтрона равен нулю, а протон имеет элементарный положительный заряд +1, то заряд ядра равен числу находящихся в нем протонов, которое называется зарядовым числом (Z) или атомным номером. Число нейтронов в ядре равно разности между массовым А числом и атомным номером Z элемента: N = A-Z ( А ZX).
Электрический заряд (q) ядра равен произведению элементарного электрического заряда (е) на атомный номер (Z) химического элемента периодической системы Д.И. Менделеева:
q = Ze
Ядерные силы.
Для ядерных сил характерно свойство насыщения, которое заключается в том, что нуклон оказывается способным к ядерному взаимодействию одновременно только с незначительным числом соседних нуклон, что указывает на возможную природу ядерных сил, как сил обменного типа.
Основные свойства ядерных сил объясняются тем, что нуклоны обмениваются между собой частицами массой немногим более 200 электронных масс (X. Юкава, 1935г), такие частицы обнаружены экспериментально (1947) и названы π-мезонами или пионами (существуют положительные, отрицательные и нейтральные π-мезоны). Мезоны не являются составными частями протонов и нейтронов, а испускаются и поглощаются ими (подобно тому, как атомы испускают и поглощают кванты электромагнитного излучения), при этом протон, испустивший положительный пион, превращается в нейтрон, а нейтрон после захвата пиона превращается в протон. Все эти процессы обеспечивают сильное взаимодействие и тем самым устойчивость ядер.
Число протонов в ядре (атомный номер) для каждого элемента строго постоянно и соответствует порядковому номеру элемента (Z) таблицы Д.И. Менделеева. Так как каждый протон имеет положительный элементарный заряд электричества, то атомный номер элемента показывает и число положительных элементарных зарядов в ядре любого атома химического элемента. Порядковый номер элемента еще называют зарядовым числом. Число протонов в ядре определяет число электронов в оболочке атома (но не наоборот) и соответственно строение электронных оболочек и химические свойства элементов.
Нейтрон (n) – электрически нейтральная элементарная частица (отсутствует лишь в ядре легкого водорода), масса покоя которой равна 1,00898 а.е.м. или 939,57 МэВ. Масса нейтрона больше массы протона на две электронные массы. В атомном ядре нейтроны являются стабильными, их число (N) в ядре атома одного и того же элемента может колебаться, что дает в основном только физическую характеристику элемента [Белов А.Д., 1999].
Электроны двигаются вокруг ядра по орбиталям определенной формы и радиуса. Орбиты группируются в электронные слои (максимально может быть семь: K, L, M, N, O, P,Q). Наименьшее число электронов, которое может находиться на орбиталях одного слоя, определяется квантовым соотношением:
где n – главное квантовое число (в данном случае совпадает с номером слоя. Следовательно в К-слое (n=1) может находиться 2 электрона, в L-слое (n=2) – 8 электронов и так далее.
Основную роль во взаимодействии электронов с атомным ядром играют электромагнитные силы (силы кулоновского притяжения разноименных электрических зарядов). Чем ближе к ядру находится электрон, тем больше его потенциальная энергия (энергия связи с ядром) и меньше кинетическая энергия (энергия вращения электрона). Соответственно электроны с внешней орбиты (энергия связи около 1-2 эВ) сорвать легче, чем с внутренней.
Поскольку в природе всякая система стремится перейти в положение, при котором ее энергия будет наименьшей, то и атом из возбужденного состояния переходит первоначальное.
Возращение атома в обычное состояние сопровождается делением избыточной энергии. Переход электронов из внешних орбит на внутренние сопровождается рентгеновым излучением с длиной волны, характерной для каждого энергетического уровня данного атома (характеристическое рентгеновское излучение).
Переходы электронов в пределах внешних орбит дают оптический спектр, который состоит из ультрафиолетовых, световых и инфракрасных лучей.
При сильных электрических воздействиях электроны вырываются из атома и удаляются за его пределы.
Следовательно, на каждый положительный ион образуется один отрицательный ион, т. е. возникает пара ионов.
Процесс образования ионов из нейтральных атомов называется ионизацией. В обычных условиях атом в состоянии иона существует очень короткое время. Свободное место на орбите положительного иона заполняется свободным электроном, и атом вновь становится электрически нейтральной системой. Этот процесс носит название рекомбинации ионов (деионизации) и сопровождается выделением избыточной энергии в виде излучения.
Изотопы, изотоны, изобары.
Большинство элементов в природе представляет собой смесь разновидностей атомов, ядра которых содержат неодинаковое число нейтронов, т.е. различаются по массе.
Атомы, имеющие ядра с одинаковым числом протонов, но различающиеся по числу нейтронов, являются разновидностями одного и того же химического элемента и называются изотопами. Такие элементы имеют одинаковый номер в таблице Д.И. Менделеева, но разное массовое число ( 39 19К, 40 19К, 41 19К).
Атомные ядра разных элементов с равным числом нейтронов называют изотонами. Например 13 6С имеет шесть протонов и семь нейтронов, 14 7N имеет семь протонов и тоже семь нейтронов.
Атомные ядра, разных элементов с одинаковым массовым числом, но с разным атомным номером (т.е. состоящие из одинакового числа нуклонов при разном соотношении протонов и нейтронов) называются изобарами.
Разница между Изотопами, Изобарами и Изотонами
Ключевое различие между изотопами, изобарами и изотонами заключается в том, что Изотопы — это атомы с одинаковым числом протонов, но различным количеством нейтронов, Изобары — это атомы разных химических элементов, имеющие одинаковые значения атомной массы, а Изотоны — это атомы разных химических элементов, имеющих одинаковое количество нейтронов в атомном ядре.
Содержание
Что такое Изотопы?
Изотопы — это атомы с одинаковым количеством протонов, но с разным количеством нейтронов. Число протонов в атоме является атомным номером этого атома. Определенный химический элемент имеет фиксированное количество протонов. Следовательно, атомный номер атомов одного и того же химического элемента подобен друг другу.
Изотопы водорода
И зотопы являются атомами одного и того же химического элемента. Общее количество протонов и нейтронов известно как атомная масса. Изотопы имеют разные атомные массы.
Химическое поведение изотопов химического элемента идентично, но физические свойства отличаются друг от друга. Почти все химические элементы имеют изотопы. Известно 275 изотопов 81 стабильного химического элемента. Для конкретного химического элемента существуют стабильные изотопы, а также радиоактивные изотопы (нестабильные).
Что такое Изобары?
Изобары — это атомы разных химических элементов, имеющие одинаковые значения атомной массы. Атомная масса — это сумма протонов и нейтронов в ядре атома. Протон и нейтрон называются как нуклоном. Следовательно, изобары имеют одинаковое количество нуклонов.
Атомные номера этих изобар отличаются друг от друга, потому что разные химические элементы имеют разные атомные номера. Изобарное правило Йозефа Мэттауча гласит, что если два соседних элемента в периодической системе химических элементов имеют изотопы с одинаковым массовым числом, один из этих изотопов должен быть радиоактивным. Если существуют изобары трех последовательных элементов, то первый и последний изобары стабильны, а средний может подвергнуться радиоактивному распаду. Серия изобар представляет собой совокупность различных изотопов, имеющих одинаковую атомную массу.
Что такое Изотоны?
Изотоны — это атомы разных элементов, имеющие одинаковое количество нейтронов в атомном ядре. Изотоны имеют разные атомные номера (количество протонов в ядре отличается друг от друга), а также у них разные атомные массы.
В чем разница между Изотопами, Изобарами и Изотонами?
| Изотопы, изобары и изотоны | |
| Изотопы | Изотопы — это атомы с одинаковым количеством протонов, но с разным количеством нейтронов |
| Изобары | Изобары — это атомы разных химических элементов, имеющие одинаковые значения атомной массы |
| Изотоны | Изотоны — это атомы разных элементов, имеющие одинаковое количество нейтронов в атомном ядре |
| Атомный номер | |
| Изотопы | Изотопы имеют одинаковый атомный номер |
| Изобары | Изобары имеют разные атомные номера |
| Изотоны | Изотоны имеют разные атомные номера | Атомная масса |
| Изотопы | Изотопы имеют различную атомную массу |
| Изобары | Изобары имеют одинаковую атомную массу |
| Изотоны | Изотоны имеют разную атомную массу |
| Количество нейтронов | |
| Изотопы | Изотопы имеют разное количество нейтронов |
| Изобары | Изобары имеют разное количество нейтронов |
| Изотоны | Изотонизирует одинаковое количество нейтронов |
Заключение — Изотопы, Изобары и Изотоны
Изотопы, изобары и изотоны — это термины, используемые для описания взаимодействий между атомами различных химических элементов. Разница между изотопами, изобарами и изотонами заключается в том, что изотопы — это атомы с одинаковым числом протонов, но различным количеством нейтронов, изобары — это атомы разных химических элементов, имеющие одинаковые значения для атомной массы, а изотоны — это атомы разных элементов, имеющих одинаковое количество нейтронов в атомном ядре.
Изобары: характеристики, примеры и отличия от изотопов
Содержание:
В изобарыЭто те атомные частицы, которые имеют одинаковую массу, но происходят из разных химических элементов. Как следствие этого, можно сказать, что они состоят из разного количества протонов и нейтронов.
И протоны, и нейтроны находятся в ядрах своих атомов, но чистое количество нейтронов и протонов, присутствующих в каждом ядре, остается неизменным. Другими словами, разновидность изобары возникает, когда пара атомных ядер показывает одинаковое чистое количество нейтронов и протонов для каждой разновидности.
характеристики
Во-первых, этимология термина isobarus происходит от греческих слов isos (что означает «равный») и барош (что означает «вес»), что означает равенство весов между двумя ядерными видами.
Следует отметить, что изобары имеют определенное сходство с другими видами, ядра которых имеют совпадения, такими как изотоны, которые имеют одинаковое количество нейтронов, но с разными массами и атомными номерами, например пары 13 C и 14 Нет 36 S и 37 Cl.
Таким образом, нуклиды, возможно, различаются по количеству нейтронов или протонов или даже по количеству энергии, которой обладает структура их конгломерата.
Точно так же дочернее ядро возникает после процесса β-распада, и оно, в свою очередь, является изобарой родительского ядра, потому что количество нуклонов, присутствующих в ядре, остается неизменным, в отличие от того, что происходит при среднее значение распада α.
Важно помнить, что разные изобары имеют разные атомные номера, что подтверждает, что они являются разными химическими элементами.
Представление
Для обозначения различных нуклидов используется специальное обозначение, которое может быть представлено двумя способами: один состоит из названия химического элемента, за которым следует его массовое число, которые соединяются дефисом. Например: азот-14, ядро которого состоит из семи нейтронов и семи протонов.
Когда представлены эти нуклиды, атомный номер атома (Z) обычно опускается, потому что он не дает соответствующих дополнительных данных, поэтому его часто представляют как К ИКС.
Примеры
Использование выражения «изобары» для видов, известных как нуклиды, которые имеют одинаковое число нуклонов (равное массовое число), было предложено в конце 1910-х годов британским химиком Альфредом Уолтером Стюартом.
В этом порядке представлений можно наблюдать пример изобар в случае вида 14 C и 14 N: массовое число равно 14, это означает, что количество протонов и нейтронов у обоих видов разное.
В самом деле, этот атом углерода имеет атомный номер, равный 6, поэтому в его структуре 6 протонов, а в ядре, в свою очередь, 8 нейтронов. Таким образом, его массовое число равно 14 (6 + 8 = 14).
Со своей стороны, атом азота имеет атомный номер, равный 7, поэтому он состоит из 7 протонов, но в его ядре также есть 7 нейтронов. Его массовое число тоже 14 (7 + 7 = 14).
Вы также можете найти серию, в которой все атомы имеют массовое число, равное 40; это случай изобар: 40 AC, 40 K, 40 Ar, 40 Cl и 40 С.
Различия между изобарами и изотопами
Как объяснялось ранее, нуклиды описывают различные классы атомных ядер, которые существуют, в зависимости от количества протонов и нейтронов, которые они имеют.
Также среди этих типов нуклидов есть изобары и изотопы, которые будут дифференцированы ниже.
В случае изобар, как упоминалось ранее, они имеют одинаковое количество нуклонов, то есть одно и то же массовое число, где количество протонов, на которое один вид больше, чем другой, согласуется с числом нейтронов. которые в дефиците, поэтому общая сумма такая же. Однако его атомный номер другой.
В этом смысле виды изобар происходят из разных химических элементов, поэтому они расположены в разных местах периодической таблицы и имеют разные характеристики и специфические свойства.
С другой стороны, в случае изотопов происходит обратное, поскольку они имеют одинаковый атомный номер, но разную массу; то есть у них одинаковое количество протонов, но другое количество нейтронов внутри их атомных ядер.
Кроме того, изотопы представляют собой атомные разновидности, принадлежащие к одним и тем же элементам, поэтому они расположены в одном и том же пространстве периодической таблицы и имеют схожие характеристики и свойства.
Ссылки
Мигель Михура: биография, стиль, работы и фразы



