Что такое инверсия 9 хромосомы
Что такое инверсия 9 хромосомы
Хромосомные перестройки обычно не имеют фенотипического эффекта, если они сбалансированы, поскольку весь хромосомный материал присутствует, даже если он иначе упакован. Важно различать разницу между истинно сбалансированными перестройками и теми, которые цитогенетически представляются сбалансированными, но на молекулярном уровне не сбалансированы.
Более того, из-за высокой частоты в геноме CNP, увеличивающей и без того существующие различия в много миллионов пар оснований между геномами неродственных индивидуумов, понятие сбалансированности или несбалансированности отчасти произвольно и подлежит дальнейшему исследованию и уточнению.
Даже когда структурные перестройки истинно сбалансированы, они могут представлять угрозу последующим поколениям, поскольку носители могут иметь высокую частоту несбалансированных гамет и, следовательно, имеют повышенный риск аномального потомства с несбалансированными кариотипами; в зависимости от специфической перестройки, риск может колебаться от 1 до 20%.
Существует также возможность, что один из хромосомных разрывов повредит ген, вызвав мутацию. Это хорошо описаная причина Х-сцепленных болезней у женщин-носителей сбалансированных транслокаций Х-хромосомы и аутосом, такие транслокации могут быть путеводной нитью к уточнению позиции гена, ответственного за развитие болезни.
Инверсия хромосом
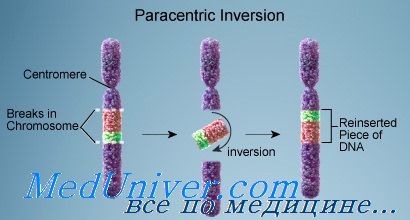
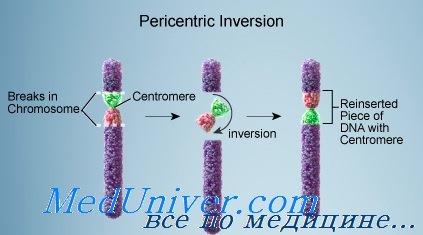
Инверсия появляется, когда в хромосоме происходят два разрыва, а сегмент между ними переворачивается. Инверсии бывают двух типов: парацентрические (не включающие центромеру), при которых оба разрыва происходят в одном плече; и перицентрические (включающие центромеру), при которых разрывы находятся в разных плечах. Поскольку парацентрические инверсии не изменяют соотношение плеч хромосомы, их можно выявить (если это вообще удастся) только при дифференциальной окраске или FISH-методом с локусспецифическими зондами.
Перицентрические инверсии цитогенетически выявить легче, поскольку они могут изменять соотношение плеч хромосом, а также расположение полос.
Инверсия обычно не вызывает аномалий фенотипа у носителей, поскольку относится к сбалансированным перестройкам. Ее медицинское значение — влияние на потомство; носитель любой инверсии попадает в группу риска по наличию аномальных гамет, приводящих к несбалансированному потомству, так как при инверсии при конъюгации хромосом в мейозе I формируется петля. Рекомбинация отчасти подавляется в пределах инверсионных петель, но если она происходит, то может вести к формированию несбалансированных гамет.
Формируются как гаметы со сбалансированным хромосомным набором (нормальным или с инверсией), так и гаметы с несбалансированными хромосомами в зависимости от позиции точек рекомбинации. Если инверсия парацентрическая, несбалансированные рекомбинантные хромосомы обычно ацентрические или дицентрические и не могут привести к жизнеспособному потомству, хотя есть и редкие исключения. Таким образом, на самом деле риск того, что носитель парацентрической инверсии будет иметь живорожденного ребенка с аномальным кариотипом, очень низкий.
Перицентрическая инверсия, со своей стороны, может привести к появлению несбалансированных гамет как с дупликацией, так и с делецией хромосомных сегментов. Удвоенный и потерянный сегменты — расположенные дистальнее инверсии. В целом риск для носителя перицентрической инверсии родить ребенка с несбалансированным кариотипом оценивают в 5-10%. Каждая перицентрическая инверсия, тем не менее, связана с конкретным риском.
Большие перицентрические инверсии с большей вероятностью, чем малые, приводят к жизнеспособному рекомбинантному потомству, так как в случае больших инверсий несбалансированные сегменты в рекомбинантном потомстве имеют меньший размер. Это положение иллюстрируют три хорошо изученных инверсии.
Перицентрическая инверсия хромосомы 3, происходящая от семейной пары из Ньюфаундленда, вступивших в брак в начале XIX в. — одна из немногих, для которой получено достаточно данных, чтобы оценить расхождение инвертированной хромосомы в потомстве носителей. Кариотип с inv(3) (p25q21) с тех пор был описан в ряде центров Северной Америки, в семьях, предки которых прослеживались до приморских провинций Канады.
Носители хромосомы inv(3) нормальны, но некоторые их дети имеют характерный аномальный фенотип, ассоциирующийся с рекомбинантной хромосомой 3, в которой отмечена дупликация дистального сегмента 3q21 и делеция дистального сегмента 3р25. Девять человек — носителей этой инверсии — имели 53 зарегистрированных беременности. Высокий риск аномального исхода беременности в группе (22/53, или больше 40%) указывает значение семейных хромосомных исследований для идентификации носителей, генетического консультирования и дородовой диагностики.
Другая перицентрическая инверсия, связанная с выраженным дупликационным или делеционным синдромом в рекомбинантных потомках, находится в хромосоме 8, inv(8) (p23.1q22.1) и первоначально обнаружена среди испанцев юго-запада США. Эмпирические исследования показали, что носители inv(8) имеют 6% риска родить ребенка с синдромом рекомбинантной хромосомы 8, летальным нарушением с серьезными сердечными аномалиями и умственным недоразвитием. В рекомбинантной хромосоме дублирован дистальный участок 8q22.1 и утерян дистальный участок 8р23.1.
Наиболее частая инверсия у человека — небольшая перицентрическая инверсия хромосомы 9, которую отмечают почти у 1% обследованных лабораториями цитогенетики. Кариотип inv(9)(pllql2) не имеет известных опасных эффектов у носителей и не дает значимого риска выкидыша или несбалансированного потомства; поэтому обычно считается вариантом нормы.
Дополнительно к цитогенетически видимым инверсиям геномными методами обнаруживают все большее количество малых инверсий. Полагают, что многие из них клинически благоприятны, без отрицательного влияния на потомство.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Что такое инверсия 9 хромосомы
Хромосомные аномалии могут быть числовыми (кариотип с аномальным числом хромосом в результате потери или добавления хромосомы) или структурными, под которыми понимают изменения структуры отдельных хромосом (потеря, перестройка или добавление хромосомных сегментов). Числовые и структурные аномалии могут сосуществовать в одной опухолевой клетке.
Клетка с нормальным комплектом из 46 структурно нормальных хромосом называется диплоидной. Клетки с 46 хромосомами, но с числовыми хромосомными аномалиями (например, потеря одной хромосомы и добавление другой) называются псевдодиплоидными. Аномальное число хромосом называется анеуплоидией, наличие более чем 46 хромосом — гипердиплоидией, менее 46 хромосом — гиподиплоидией.
Потеря одной копии хромосомы приводит к моносомии по этой хромосоме, потеря обеих копий — к нуллисомии, появление добавочной копии хромосомы — к трисомии по этой хромосоме, более редко встречающееся появление двух добавочных копий — к тетрасомии. Добавление и потеря хромосом обозначаются плюсом или минусом. Например, 45,XY,-7 — это кариотип мужской клетки с моносомией по хромосоме 7, а 47,ХХ,+8 — это кариотип женской клетки с трисомией по хромосоме 8.
Наиболее распространены приобретенные трисомии по хромосоме 8, которые встречаются при острых миелоидных лейкозах, миелодиспластических синдромах и бластном кризе хронического миелолейкоза. Другие трисомии при миелопролиферативных заболеваниях включают +4, +6, +9, +11, +13, +19, +21, при остром лимфобластном лейкозе — +4, +6, +10, +14, +17, +18, +20, +21 и +Х.
Числовые хромосомные аномалии особенно часто встречаются при остром лимфобластном лейкозе и имеют прогностическое значение (гипердиплоидия — благоприятное, гиподиплоидия — неблагоприятное). Наиболее распространенная при хроническом лимфолейкозе цитогенетическая аномалия — трисомия 12 связана с неблагоприятным прогнозом. При множественной миеломе различные варианты анеуплоидии выявлены в 90% случаев.
Структурные хромосомные аномалии
В опухолевых клетках больных онкогематологическими заболеваниями можно обнаружить большое разнообразие структурных аномалий, которые определяются точными терминами: делеции, изохромосомы, дицентрические и изодицентрические хромосомы, инверсии, кольцевые хромосомы, транслокации, инсерции, дупликации, дуплицированные мини-хромосомы и маркерные хромосомы.
Хромосомная делеция (del) — потеря хромосомного сегмента. Различают интерстициальные и терминальные делеции. При интерстициальной делеции утрачен внутренний хромосомный сегмент, а смежные с ним дистальный и проксимальный сегменты оказываются соединенными. Интерстициальная делеция del(5)(ql3q33) обозначает потерю участка длинного плеча хромосомы 5 между сегментами ql3 и q33.
При терминальной делеции отсутствует конец хромосомы, например, делеция del(7)(q22) означает утрату хромосомного материала от сегмента q22 длинного плеча хромосомы 7 до ее теломеры включительно. Вероятно, значение хромосомных делеции в развитии онкогематологических заболеваний определяется утратой генов-супрессоров опухолей.
Изохромосома (i) — структурно аномальная хромосома из двух идентичных плеч, ориентированных как зеркальное отражение одна другой. Изохромосомы могут быть моноцентрическими (содержащими одну центромеру) и дицентрическими или изодицентрическими (две центромеры). Например, изохромосома i(17q), которая часто встречается как вторичная цитогенетическая аномалия при бластном кризе хронического миелолейкоза, состоит из двух длинных плеч.
Важное следствие образования i(17q) заключается в потере короткого плеча 17р, в котором содержится ген-супрессор опухолей р53.
Инверсия (inv) — структурное хромосомное изменение, заключающееся в повороте хромосомного сегмента на 180°. Различают перицентрические и парацентрические инверсии. В перицентрической инверсии сегмент с измененной ориентацией содержит центромеру. В парацентрической инверсии инвертированный сегмент находится внутри короткого или длинного плеча хромосомы и не включает центромеру.
Перицентрическая инверсия inv(16)(pl3q22) часто выявляется при М4-варианте острого миелоидного лейкоза, a inv(3)(q21q26), обнаруженная при варианте М7, может служить примером парацентрической инверсии. Молекулярные последствия инверсий заключаются в перемещении генов в несвойственное им положение и изменении их регуляции.
Кольцевая хромосома (r — от англ. ring) — аномальная хромосома, оба плеча которой, короткое и длинное, разорваны, а точки разрывов соединились вместе, образовав замкнутую структуру (кольцо). Кольцевые хромосомы редко встречаются при онкогематологических заболеваниях.
Хромосомная транслокация (t) — обмен генетическим материалом между негомологичными хромосомами. Различают реципрокные и нереципрокные транслокации. При реципрокной транслокации происходит взаимный обмен фрагментами между двумя, реже тремя и более хромосомами, без потери генетического материала, в отличие от нереципрокных транслокаций. При онкогематологических заболеваниях описано большое число транслокаций, во многих случаях идентифицированы и связанные с ними молекулярные изменения и механизмы злокачественной трансформации.
Ассоциация определенных хромосомных транслокаций с отдельными формами злокачественных опухолей хорошо известна при гемобластозах. Транслокации при лейкозах и лимфомах человека либо активируют клеточные протоонкогены, либо приводят к формированию слитных, «химерных» генов, способствующих злокачественной трансформации гемопоэтических клеток. Молекулярно-генетический анализ точек разрывов показывает, что генетические транслокации изменяют структуру или регуляцию генов, имеющих важное значение для роста и/или дифференцировки соответствующего типа клеток.
В связи с этим они могут быть использованы для дифференциальной диагностики миелопролиферативных и лимфопролиферативных заболеваний.
Пример транслокации, активирующей клеточный протоонкоген в результате перемещения его под контроль регуляторного элемента другого гена, находящегося на другой хромосоме, — t(14;18)(q32;q21), закономерно выявляющаяся при фолликулярных неходжкинских лимфомах и имеющая патогенетическое значение. Точки разрывов хромосом находятся в сегментах q32 хромосомы 14 и q21 хромосомы 18; в результате происходит обмен хромосомными фрагментами между хромосомами 14 и 18 с переносом онкогена bcl-2 с хромосомы 18 на хромосому 14.
Это приводит к дисрегуляции и бесконтрольной экспрессии антиапоптозного гена bcl-2, накоплению долгоживущих центроцитов и способствует злокачественной трансформации.
Транслокация t(9;22)(q34;qll) является примером образования химерного гена bcr/abl, который сформирован при слиянии гена bcr из локуса 22qll и гена abl из локуса 9q34. Новый ген экспрессируется с образованием bcr/abl-мРНК и белка, обладающего повышенной тирозинкиназной активностью и способностью индуцировать неограниченную клеточную пролиферацию. Данная хромосомная перестройка выявляется у 95-97% больных хроническим миелолейкозом.
Пример комплексной транслокации с вовлечением трех хромосом — транслокация t(3;9;22)(ql3;q34;qll), которая происходит между локусами 3ql3, 9q34 и 22qll также с образованием химерного гена bcr/abl.
Дицентрическая хромосома (die) — структурно аномальная хромосома с двумя центромерами, которая является результатом реципрокной транслокации и содержит центромеры обеих вовлеченных в транслокацию хромосом. Дицентрическая хромосома dic(7;12)(pll;pll) встречается при остром лимфобластном лейкозе.
Добавление хромосомного материала (add — от англ. addition) — добавление хромосомного материала неизвестного происхождения, которое обозначается знаком плюс. Например, 14q+ означает присутствие дополнительного генетического материала неизвестного происхождения в длинном плече хромосомы 14.
Инсерция (ins — от англ. insertion) — наличие хромосомного сегмента в новом положении в той же самой или другой гомологичной хромосоме (встречается редко). Некоторые инсерции были описаны ранее как транслокации, например ins(3;3)(q26;q21q26) — инсерция сегмента, расположенного между локусами q21 и q26 хромосомы 3, в локус q26 другой хромосомы 3.
Дупликация (dup) — присутствие добавочной копии сегмента хромосомы рядом с первой копией с образованием тандема из двух копий дуплицированного сегмента. Примером может служить вторичная хромосомная аномалия dup(l)(pl2->q31) при остром лимфобластном лейкозе. В отличие от хромосомных дупликаций, молекулярная микродупликация, такая как дупликация части гена ALL1, может быть определена только молекулярными методами.
Дуплицированные мини-хромосомы (dmin) — маркерные хромосомы без центромер, которые обычно являются результатом генной амплификации. Эти мелкие сферические парные структуры, похожие на диплококков, чаще встречаются при солидных опухолях, нежели при гематологических.
Маркерные хромосомы (mar — от англ. marker) — термин используется для описания структурно аномальных хромосом, не имеющих идентификационных признаков. Кариотип может включать один или более маркеров. Присутствие одной маркерной хромосомы в кариотипе обозначается символом +mar, нескольких различных — +marl, +mar2, +mar3 и т. д., нескольких копий одного маркера — +marl x2, +marl хЗ и т. д.
Врожденные и приобретенные хромосомные изменения
Числовые и структурные хромосомные аномалии могут быть врожденными и приобретенными. Врожденные хромосомные аномалии присутствуют во всех или почти во всех клетках организма уже на самых ранних стадиях эмбриогенеза. Приобретенные хромосомные аномалии возникают в соматических клетках и обычно ассоциированы со злокачественной трансформацией. Врожденные хромосомные аномалии связаны с наследственными генетическими синдромами (например, трисомия по хромосоме 21 — с синдромом Дауна) или являются вариантом нормы.
Самая распространенная врожденная хромосомная аномалия, обнаруженная у фенотипически нормальных людей, — перицентрическая инверсия хромосомы 9 inv(9)(pllql3), встречающаяся у 1% популяции. Кариотип с врожденной (конституциональной) аномалией обозначается буквой с (constitutional) — например, кариотип клеток женщины с синдромом Дауна обозначается как 47,ХХ,+21с.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Хромосомная инверсия
Инверсия — хромосомная перестройка, при которой происходит поворот участка хромосомы на 180°. Инверсии являются сбалансированными внутрихромосомными перестройками. Различают парацентрические (инвертированный фрагмент лежит по одну сторону от центромеры) и перицентрические (центромера находится внутри инвертированного фрагмента) инверсии. Инверсии играют роль в эволюционном процессе, видообразовании и в нарушениях фертильности.
Инверсии, как правило, не влияют на фенотип носителя. Патологический фенотип при инверсии может формироваться, если разрыв находится в пределах гена, или если перестройка нарушает регуляцию гена. Гетерозигота по инверсии может иметь сниженную фертильность и вероятность рождения потомства с аномальным фенотипом из-за образования аберрантных рекомбинантных хромосом в мейозе.
Содержание
Гетерозиготные инверсии в мейозе
При прохождении мейоза в профазе I между гомологичными хромосомами происходит синапсис, после чего возможен кроссинговер и рекомбинация между ними. Гетерозиготность по инверсии осложняет поиск гомологичных последовательностей при синапсисе хромосом. Короткие гетерозиготные инверсии обычно испытывают трудности при синапсисе, но, как правило, в их случае запускается процесс так называемой синаптической подгонки (или синаптической пригонки), в результате которой на месте инверсии осуществляется негомологичный синапсис (гетеросинапсис), в котором существует запрет на рекомбинацию. Достаточно протяжённые гетерозиготные инверсии могут образовывать полноценный гомологичный синапсис за счёт формирования инверсионной петли, и, следовательно, в пределах инвертированного участка может произойти кроссинговер.
Таким образом, гетерозиготность по инверсии приводит к подавлению рекомбинации в пределах инверсии за счёт двух основных механизмов: из-за запрета рекомбинации в случае гетеросинапсиса и за счёт низкой вероятности появления рекомбинантных продуктов в потомстве вследствие генетической несбалансированности гамет.
Выявление инверсий
В настоящее время существует три основных подхода для выявления инверсий: с помощью классического генетического анализа, цитологически и на основе данных секвенирования полного генома. Наиболее распространённым является цитологический подход.
Цитологически инверсии впервые наблюдали на политенных хромосомах слюнных желез у дрозофил, и двукрылые по-прежнему являются наиболее удобным объектом для наблюдения инверсий. В других таксономических группах крупные инверсии можно выявить при помощи дифференциальной окраски метафазных хромосом. Известные полиморфные варианты инверсий можно анализировать при помощи флуоресцентной гибридизации in situ с использованием локус-специфических ДНК-проб.
Возникновение инверсий
Для возникновения инверсии необходимым условием является повреждение ДНК в виде двунитевого разрыва с последующей ошибкой репарации. Репарация двунитевого разрыва ДНК может проходить двумя способами: негомологичным соединением разрывов и гомологичной рекомбинацией. При репарации путём негомологичного соединения могут ошибочно соединиться два внутрихромосомных разрыва с разворотом участка между ними на 180°. При гомологичной рекомбинации может произойти неверный выбор последовательности ДНК, на основе которой идёт репарация повреждённой ДНК. Вместо аллельной гомологичной последовательности происходит ошибочный выбор паралогичной последовательности на этой же хромосоме. В последнем случае для формирования инверсии необходимо возникновение двунитевого разрыва ДНК в одной из двух повторяющихся последовательностей, находящихся на одной хромосоме в инвертированном положении по отношению друг к другу.
Двунитевые разрывы ДНК могут возникать вследствие воздействия экзогенными факторами, такими как ионизирующее излучение или химиотерапия, а также вследствие воздействия на ДНК эндогенно образующимися свободными радикалами.
Роль инверсий в видообразовании
Инверсии и половые хромосомы
Обозначение инверсий
В медицинской генетике для обозначения инверсий используют Международную систему по цитогенетической номенклатуре человека (The International System for Human Cytogenetic Nomenclature — ISCN). Запись inv(A)(p1;q2) обозначает инверсию в хромосоме А. Информация во вторых скобках даётся дополнительно для локализации точек разрыва внутри хромосомы А. Буква p означает короткое плечо хромосомы, буква q — длинное плечо, цифры после p и q относятся к нумерации хромосомных бэндов. Инверсии гетерохроматиновых районов хромосом 1, 9 и 16 предложено обозначать как 1ph, 9ph и 16ph соответственно.
Полиморфизм по инверсиям у человека
Инверсия пола 46 XX
OMIM 400045
Наша команда профессионалов ответит на ваши вопросы
46,ХХ инверсия пола характеризуется наличием мужского фенотипа (с полной или неполной маскулинизацией), наличием тестикулярной ткани при отсутствии в кариотипе Y-хромосомы. При этом данное нарушение формирования пола может быть обусловлено либо наличием синдрома «46,ХХ-мужчина» либо овотестикулярной формой нарушения формирования пола (истинный гермафродитизм). 46,ХХ инверсия пола может быть связана с наличием фрагмента Y-хромосомы и/или скрытого мозаицизма по Y-хромосоме (Y-позитивная форма) либо с аутосомными или Х-сцепленными мутациями (Y-негативная форма).
46,ХХ инверсия пола тип 1 (OMIM 400045)
В большинстве случаев ХХ-инверсия пола является результатом транслокации небольшого фрагмента короткого плеча Y-хромосомы, несущего ген SRY (OMIM 480000; Yp11.3), на Х-хромосому или аутосому. Нарушение формирования пола является врожденным состоянием, при котором наблюдается полное или частичное аномальное развитие и строение половых желез, внешних половых признаков, обусловленное аномалиями строения половых хромосом. У пациентов с истинным гермафродитизмом гистологически могут быть обнаружены как зрелые ткани яичников с фолликулами, так и яичек с семенными канальцами.
Ключевую роль в детерминации мужского пола и в дифференцировке яичек связана с геном SRY (Sex-determining region Y chromosome). Делеции или точковые мутации этого гена приводят к развитию «чистой» формы дисгенезии гонад при кариотипе 46,XY (синдром Свайера), тогда как его присутствие в геноме больных с 46,ХХ инверсией пола (синдром де ля Шапеля или синдром «46,ХХ-мужчина») обуславливает развитие по мужскому типу, а у больных с мозаицизмом по хромосоме Y, в том числе при синдроме Шерешевского-Тернера – с наличием и выраженностью маскулинизации и/или двойственного полового развития.
Ген SRY расположен на коротком плече Y-хромосомы в непосредственной близости к PAR1 региону, области гомологичной конъюгации хромосом Х и Y, происходящей в сперматогенезе. В процессе мейотического обмена между Х- и Y-хромосомами участок Y-хромосомы, содержащий ген SRY, может быть транслоцирован на Х-хромосому, что может привести к образованию сперматозоидов с перестроенными (дериватными) хромосомами: с Y-хромосомой, утратившей ген SRY, и Х-хромосомой, несущей этот ген. При оплодотворении такими гаметами яйцеклетки, соответственно, возможно рождение мужчин с кариотипом 46,ХХ с транслокацией гена SRY и женщин с кариотипом 46,XY, но с делецией гена SRY. Так, 85-90% больных с ХХ инверсией пола имеют в геноме небольшую часть короткого плеча Y-хромосомы, невидимую при стандартном цитогенетическом исследовании. Последовательности Y-хромосомы у таких больных транслоцированы, как правило, на Х-хромосому, реже на одну из аутосом, унаследованных от отца. Транслоцированный участок Y-хромосомы при этом содержит ген SRY. В редких случаях может встречаться скрытый мозаицизм по Y-несущему клону (например, 46,ХY), о чем свидетельствует наличие локусов SRY, AMGL и других Y-специфичных маркеров.
Для идентификации в геноме последовательностей Y-хромосомы, а также выявления делеции гена SRY, используется метод мультиплексной полимеразной цепной реакции (мПЦР), позволяющий исследовать наличия данного гена, а также гена амелогенина (AMG, AMELX), локализованного на коротком плече Х-хромосомы и его гомолога, локализованного на коротком плече Y-хромосомы (AMGL / AMELY). Для анализа наличия точковых мутаций гена SRY – прямое секвенирование его кодирующей последовательности.
С целью анализа количественных аномалий (анеуполидий) и некоторых структурных аномалий половых хромосом, а также гоносомного мозаицизма и химеризма, может быть использован метод количественной флюоресцентной ПЦР.
46,ХХ инверсия пола тип 2 (ОMIM 278850)
Данный тип ХХ-инверсии пола вызван дупликацией регуляторной области гена SOX9. Ген SOX9 располагается на длинном плече хромосомы 17 в локусе q24.3. Кодируемый геном белок является транскрипционным фактором, играющим важную роль в процессе эмбрионального развития. Особенно важен данный белок для развития скелета и репродуктивной системы. Дупликации локуса 17q24 приводит к увеличению числа копий гена SOX9, что у плодов с кариотипом 46,ХХ вызывает дифференцировку гонад по мужскому типу и развитие тестикул в отсутствие гена SRY и других генов Y-хромосомы (SRY-негативная ХХ-инверсия пола). При этом в большинстве случаев дупликаций гена SOX9 не происходит формирования нормальных тестикул, что ведет к овотестикулярной форме нарушения формирования пола (истинный гермафродитизм).
Точковые мутации в гене SOX9 у пациентов с кариотипом 46,ХХ и 46,ХY приводят к развитию кампомелической дисплазии (OMIM 114290) – заболеванию, которое влияет на развитие скелета и репродуктивной системы и часто является угрожающим жизни состоянием в период новорожденности. Пациенты с кариотипом 46,ХХ и точковыми мутациями в гене SOX9 имеют дисгенезию гонад без инверсии пола (фенотипически женщины), а у пациентов с кариотипом 46,XY дисгенезия гонад приводит к XY – инверсии пола или двойственному развитию половых органов.
В Центре Молекулярной Генетики проводится анализ ключевых генов, контролирующих дифференцировку пола: с помощью количественного метода MLPA проводится поиск делеций и дупликаций генов SRY и SOX9.
46,ХХ инверсия пола тип 3 (ОMIM 300833)
Данная форма ХХ-инверсии пола вызвана дупликацией гена SOX3 или делецией его негативно-регуляторной области. Ген SOX3 (sex determining region Y-box 3) является Х-сцепленным гомологом гена SRY, располагается на длинном плече Х-хромосомы в локусе Xq27.1 и подвержен Х-инактивации. Кодируемый им белок является членом семейства SOX (SRY-related HMG-box) – транскрипционных факторов, вовлеченных в контроль дифференцировки различных типов клеток, а также в регуляцию формирования головного мозга в ходе эмбрионального развития, развитие гипоталамо-гипофизарной системы. Он поддерживает недифференцированное состояние у нервных клеток, противодействуя влиянию факторов, стимулирующих их специализацию. Также наличие данного белка необходимо для инициирования формирования пола по мужскому типу. В дифференцирующихся тестикулах белок SOX3 поддерживает дифференцировку и развитие предшественников ‘поддерживающих клеток’ бипотенциальных (индифферентных) гонад в клетки Сертоли, а не в клетки гранулезы овариальной ткани.
Мутации, делеции или дупликации гена SOX3 являются причиной X-сцепленного гипопитуитаризма, некоторых форм аномалии развития нервной трубки (септо-оптической дисплазии), а также X-сцепленной умственной отсталости с изолированным дефицитом гормона роста. Дупликации Xq26-q27, включающие ген SOX3, являются одной из причин SRY-негативной ХХ-инверсии пола (46,ХХ тестикулярной и овотестикулярной форм нарушения формирования пола). Описано несколько случаев ХХ-инверсии пола, вызванных микродупликациями и микроделециями в локусе Xq27.1. При этом спектр фенотипических проявлений (от бесплодия при нормальном мужском фенотипе до аномалий развития пола, микроцефалии с задержкой умственного развития) зависел от локализации и размера перестройки.