Что такое интраназальное введение препарата
В то же время при интраназальном введении лекарственных препаратов существуют и некоторые проблемы. В их числе отличия физиологических процессов в полости носа у различных людей, наличие выраженных защитных механизмов, развитие местных осложнений и низкая биодоступность препаратов, приводящая к необходимости использования специальных «усилителей абсорбции», которые в свою очередь могут повреждать слизистые оболочки полости носа.
Поэтому при разработке интраназального метода введения определенного препарата крайне важное значение имеет детальное изучение его механизмов действия, а также физико-химических характеристик самого лекарственного вещества. Так, например, безопасность интраназального применения местных противовоспалительных средств подтверждена исследованиями и опытом их клинического применения, в то же время слишком мало данных имеется о местных эффектах препаратов системного действия, вводимых интраназально.
Низкая биодоступность лекарственных средств при интраназальном введении связана с функционированием особого семейства из 25 протеинов, входящих в состав слизистой оболочки полости носа и контролирующих транспорт всех молекулярных и клеточных объектов, проникающих через слизистую.
Для увеличения интраназальной абсорбции препаратов компания Nastech предложила использовать недавно открытые нетоксичные субстанции, которые связываются с белками слизистой оболочки по принципу рецепторного взаимодействия и открывают транспортные каналы. При этом биодоступность препаратов повышается на 30-50%, что в 3-6 раз превышает эффективность применения традиционных «усилителей абсорбции». Вторым путем к решению проблемы низкой биодоступности является разработка новых рецептур лекарственных препаратов и технических средств для интраназального введения.
Важнейшей особенностью интраназального введения лекарственных средств является возможность их проникновения непосредственно в ЦНС. Ученые полагают, что транспорт лекарственных средств из полости носа в ЦНС осуществляется без участия слизистой, экстрацеллюлярным путем по ходу тройничного и обонятельного нервов. Уже через 10-15 минут химические агенты, введенные интраназально, обнаруживаются в мозге. Данный факт привлекает всеобщее внимание, поскольку обеспечивает революционно новые возможности в лечении заболеваний ЦНС. Теоретически лекарственные препараты проникают в головной мозг только из обонятельной области, где существует возможность экстра- и интрацеллюлярного проникновения препаратов через эпителиальный барьер и попадания их не в кровоток, а непосредственно к оболочкам мозга.
В проведенных ранее экспериментах на животных были получены обнадеживающие результаты, однако экстраполировать эти данные на интраназальное применение препаратов у человека следует с большой осторожностью, поскольку имеются выраженные различия в распределении слизистого секрета, несущего препарат, внутри носовой полости у человека и животных. В частности, у человека непосредственно к обонятельной области поступает слишком малое количество лекарственного вещества и не достигаются нужные его концентрации. Более того, возможность непосредственного транспорта лекарственного средства в ЦНС можно оценить лишь в эксперименте с использованием препаратов, не проникающих в кровоток и с ним в структуры мозга. Однако, даже при доказанной возможности непосредственного воздействия на ЦНС при интраназальном введении препаратов у человека для их доставки в обонятельную область придется применять специальное эндоскопическое оборудование, поскольку обычные спреи не позволяют добиться достаточно высокой концентрации лекарственного вещества в данной области.
Таким образом, интраназальное введение лекарственных препаратов таит в себе большие возможности. Уже сейчас в разработке находится в два раза больше лекарственных форм для интраназального применения, чем для внутривенного введения.
Sniffing out profit
Scrip Magazine July/August, 2003.
интраназальное введение, усилитель абсорбции, интраназально, экстрацеллюлярный интрацеллюлярный путь, тройничный обонятельный нерв
Сводка по вакцинам для интраназального введения
Высококонтагиозный коронавирус SARS-CoV-2, вызывающий тяжелый острый респираторный синдром, поражает дыхательные пути, а одним из способов его передачи является воздушно-капельный (аэрозольный). Следовательно, непривитым людям рекомендовано носить маски в общественных местах, соблюдать карантинные мероприятия при наличии симптомов и социальное дистанцирование. Несмотря на эти меры предосторожности, миллионы людей умирают. Поскольку волны пандемии следуют одна за одной, тема актуальности вакцин вновь занимает первые полосы газет. Кроме того, скорость разработки вакцинных препаратов на основе информационной (матричной) РНК (мРНК) возрастает. Однако, учитывая тропность вируса к тканям дыхательных путей, удивительно, что только семь из почти 100 вакцин против SARS-CoV-2, которые в настоящее время проходят клинические испытания, предназначены для интраназального введения. К преимуществам вакцин для интраназального введения относятся:
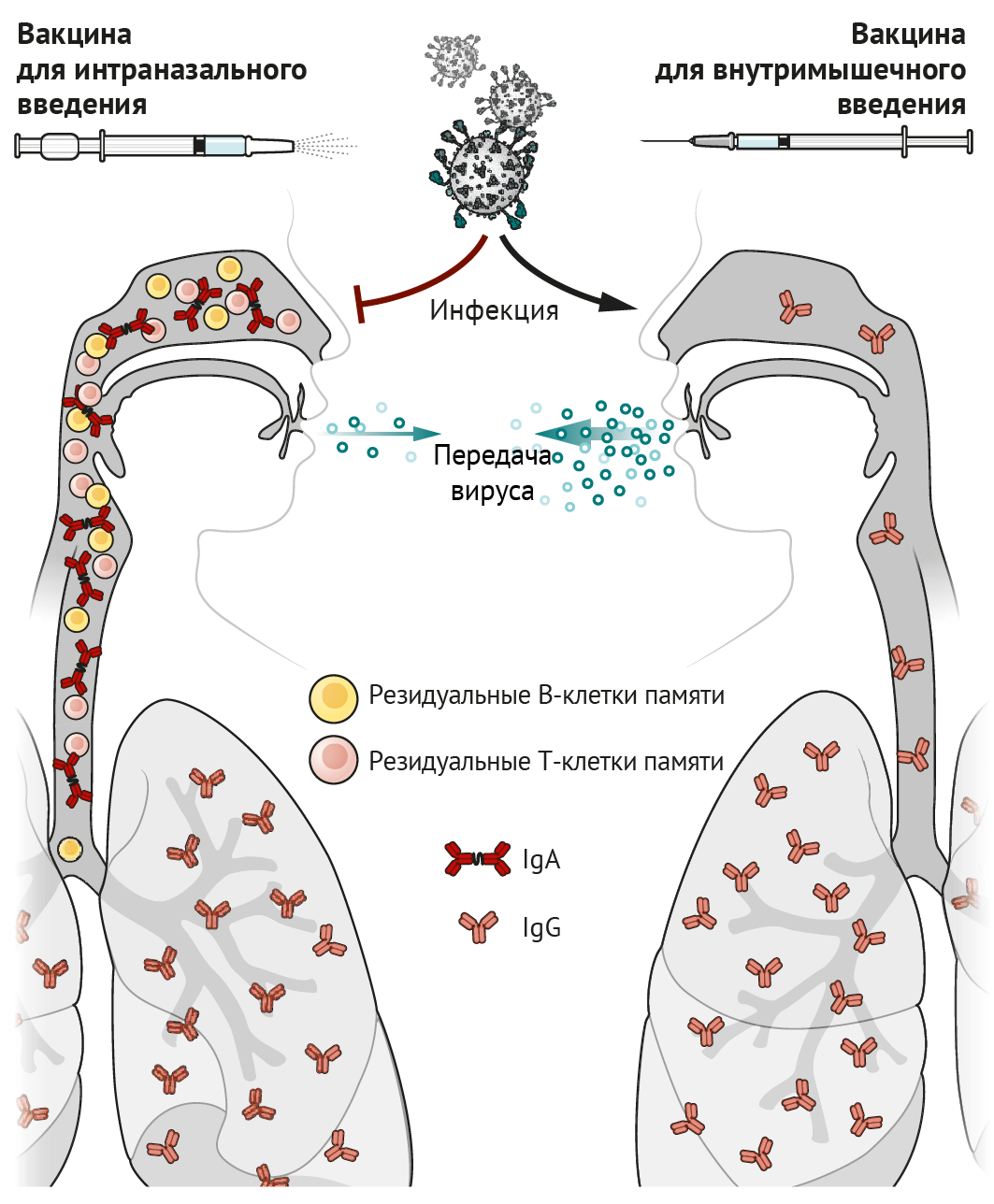
Идея о том, что интраназальная вакцинация преимущественно защищает дыхательные пути, не нова: еще в 1960-е гг. велись разработки живой аттенуированной вакцины против гриппа (ЖАВПГ), которая была одобрена Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA). Иммунологам давно известно, что инфекция верхних дыхательных путей (ВДП) или вакцинация стимулируют антительный ответ (в виде иммуноглобулина A [IgA]) как в сыворотке, так и в жидких средах тканей ВДП. Внутримышечные вакцины преимущественно стимулируют выделение IgG (накапливается в сыворотке). IgA играет важную роль в ВДП и носовых ходах, где происходит его активный транспорт через эпителий и высвобождение в просвет дыхательных путей в виде димера, связанного с секреторным компонентом, посредством чего формируется стабилизирующая конфигурация, позволяющая более эффективно нейтрализовать вирусы, такие как SARS-CoV-2 [1]. Напротив, IgG проникает через бронхиальное дерево в легочную ткань и защищает нижние доли легкого посредством пассивной транссудации через тонкий альвеолярный эпителий [2]. Возможно, IgG, выявленный в ВДП и носовых проходах, попадает в них из нижних отделов легких посредством мукоцилиарного транспорта. Однако высокая степень иммунной защиты носовых ходов с помощью IgG может быть достигнута только при высоких концентрациях данных антител в сыворотке крови [2]. Таким образом, вакцины, вводимые внутримышечно, стимулирующие высокие титры сывороточного IgG, могут снижать вирусную нагрузку в легких и носовых ходах.
CD8+ Т-лимфоциты являются еще одним важным компонентом противовирусного иммунитета; они уничтожают непосредственно инфицированные вирусом клетки, тем самым снижая репликацию вируса и ускоряя восстановление клеток и тканей от вирусной нагрузки. Некоторые активированные CD8+ Т-лимфоциты трансформируются в клетки памяти, которые сами по себе не могут предотвратить инфицирование, но способствуют запуску быстрых реакций в ответ на вторжение патогена и стимулируют эффекторные клетки. Примечательно, что В- и Т-клетки, стимулированные вакцинацией слизистой оболочки интраназальным способом или непосредственно инфекцией, экспрессируют рецепторы, способствующие закреплению на участках слизистой оболочки клеток, способных длительно функционировать и секретировать антитела; или благодаря этим рецепторам Т- и В-клетки могут существовать в качестве резидуальных клеток памяти. Резидуальные В- и Т-клетки памяти в легких и носовых ходах — незаменимые компоненты формирования иммунного ответа, они первыми реагируют на вторжение инфекции и необходимы для быстрого очищения тканей от вируса [3, 4]. Размещение резидуальных клеток памяти в дыхательных путях необходимо для того, чтобы оказался возможным их быстрый контакт с антигеном в данной области [3, 5]. Именно это означает, что способ введения вакцин, предназначенных для задействования резидуальных клеток памяти в процессе иммунного ответа в дыхательных путях, должен быть интраназальным.
По сравнению с вакцинами, вводимыми внутримышечно, интраназальные вакцины формируют две дополнительных линии «обороны»: индуцированный вакциной синтез IgA и резидуальные В- и Т-клетки памяти в слизистой оболочке дыхательных путей, создающие эффективный барьер для инфекционных агентов в этих областях. Даже в случае развития инфекции (например, вирусной или вызывающей перекрестные реакции с тканями макроорганизма) резидуальные В- и Т-клетки памяти, которые раньше сталкиваются с антигеном и реагируют значительно быстрее, чем циркулирующие по кровотоку клетки памяти, препятствуют репликации вируса и уменьшают его распространение по организму, а также, соответственно, снижают трансмиссивность инфекции (см. рисунок).
Таблица 1 | Вакцины против SARS-CoV-2 для интраназального введения, проходящие клинические испытания
Результаты доклинических испытаний вакцин на основе аденовирусных векторов, экспрессирующих шипиковый белок SARS-CoV-2 или его рецептор-связывающий домен (РСД), свидетельствуют о том, что интраназальное введение индуцирует длительный вирус-нейтрализующий антительный ответ (в виде сывороточных IgG), а также выделение антиген-специфических IgA и реакцию CD8+ Т-клеток дыхательных путей [6–8]. Более того, как интраназальное, так и внутримышечное введение вакцин на основе аденовирусных векторов предотвращает развитие пневмонии и истощения в модели инфекции. Однако животные, вакцинированные внутримышечным путем, продолжают выделять вирус из ВДП, тогда как у животных, вакцинированных интраназальным способом, наблюдается сниженная репликация и выделение вируса как из легких, так и из носовых ходов [8].
Аденовирусы — естественные патогены человека, и большинство взрослых людей подвергаются воздействию одного или нескольких штаммов, следовательно, у них могут оказаться антивирусные антитела, способные снизить эффективность вакцины (т. н. отрицательный перекрестный эффект). Однако интраназальная противогриппозная вакцина на основе вектора Ad5 (NasoVAX), вводимая в высоких дозах, работает аналогичным образом как у серопозитивных, так и серонегативных по наличию Ad5 людей [9]; возможно, это происходит по причине того, что вводимый объем вакцины способствует снижению локальных концентраций антител. Тем не менее, пытаясь избежать любого потенциального отрицательного воздействия вакцины, некоторые разработчики используют редкие штаммы аденовирусов человека или аденовирусов шимпанзе, с которыми большинство людей в популяции не сталкивалось.
В этой связи вакцина против SARS-CoV-2 на основе гриппозного вектора из университета Гонконга в процессе своей разработки может столкнуться с определенными препятствиями. Удаление гена вируса гриппа, кодирующего неструктурный белок 1 (NS1), в значительной степени ослабляет вектор (вирулентность самого вируса гриппа) и позволяет разработчикам заменить NS1 на РСД шипикового белка SARS-CoV-2. Как и вакцины на основе аденовирусного вектора, эта вакцина также должна вызывать синтез IgA к РСД на слизистых оболочках, а резидуальные клетки памяти также должны размещаться в дыхательных путях. Однако отрицательные перекрестные реакции со стороны уже существующих антител против гриппозного вектора могут снизить эффективность вакцины. Аналогичным образом, компания Meissa Vaccines разработала вектор из живого аттенуированного респираторно-синцитиального вируса (РСВ); в нем рецепторные белки F и G РСВ были заменены на шипиковый белок SARS-CoV-2. При интраназальном введении такой химерный вирус должен вызывать иммунные реакции в слизистой оболочке. Необходимо отметить, что существует предположение, согласно которому изменение поверхностных белков изменит клеточную тропность вируса, а также его иммуногенность. Уже существующие антитела против РСВ теоретически не должны мешать развитию иммунного ответа вследствие вакцинации, но уже существующие антитела против шипикового белка могут снизить его интенсивность.
Показателями эффективности живых аттенуированных интраназальных вакцин против SARS-CoV-2 также должны стать способность вызывать антительный ответ (в виде IgA) слизистых оболочек и формирование популяции резидуальных клеток памяти в ВДП. В отличие от векторных вакцин, экспрессирующих только шипиковый белок или РСД, живой аттенуированный вирус SARS-CoV-2 обладает преимуществом в экспрессии и потенциальной стимуляции иммунного ответа против всех вирусных белков, тем самым формируя иммунитет широкого спектра действия, который теоретически способен обеспечивать определенный уровень иммунной защиты против различных вариантов штаммов SARS-CoV-2. Хотя современные молекулярные методы минимизируют риск реверсии, живые аттенуированные вирусы сохраняют репликативную способность и противопоказаны детям младше 2 лет, людям старше 49 лет или лицам с ослабленным иммунитетом, поэтому живые аттенуированные вирусы SARS-CoV-2 и РСВ, экспрессирующий шипиковый белок, также могут столкнуться с пристальным изучением их потенциальной возможности вызывать побочные симптомы со стороны нервной системы [10].
При разработке живых аттенуированных вакцин необходимо обязательно брать в расчет опыт применения ЖАВПГ в прошлом. У детей чаще применяют интраназальный способ введения ЖАВПГ, нежели внутримышечный [11]. Вероятно, это отражает иммунологическую наивность детей (большинство из них за жизнь еще не сталкивалось с вирусом гриппа). Следовательно, отсутствует иммунный барьер для инфекции, провоцируемой ЖАВПГ в носовых ходах, и введение вакцины оказывается эффективным, приводя к формированию устойчивого антительного ответа (IgA) в слизистой оболочке и появлению резидуальных клеток памяти в ВДП. ЖАВПГ, вводимая интраназально, также эффективна у взрослых, но не в той же степени, что вакцина, введенная внутримышечно [11], отчасти потому что инфекция гриппа в анамнезе привела к формированию базового уровня иммунитета, который еще больше снижает вирулентность вируса в ЖАВПГ. Следовательно, живые аттенуированные вакцины против SARS-CoV-2 могут привести к формированию надежной защиты у наивных людей, но у людей, переболевших COVID-19 в анамнезе, может быть достаточная степень иммунной защиты для нейтрализации вакцины, что ставит под сомнение ее эффективность даже в качестве средства ревакцинации.
Только одна из интраназальных вакцин, проходящих клинические испытания, является инертной — это кубинская вакцина CIBG-669, в составе которой присутствует РСД, связанный с коровым антигеном вируса гепатита B (является мощным стимулятором Т-лимфоцитов). Поскольку инертные вакцины не зависят от наличия инфекции в анамнезе или экспрессии генов, иммуногенность таких препаратов не может быть нейтрализована уже существующими антителами. Однако растворимые белки в составе вакцин при попадании на слизистые ВДП, не приводят к нарушению целостности эпителия (что необходимо для эффективного развития иммунного ответа). Вместо этого они должны переноситься сквозь эпителиальный барьер специализированными микроскладчатыми клетками (M-клетки) [12], способными доставлять антигены к иммунокомпетентным клеткам под слоем эпителия.
Примечательно, что в списке интраназальных вакцин отсутствуют вакцины, в составе которых находится мРНК, инкапсулированная в липидный слой. МРНК-вакцины, вводимые внутримышечно, приводят к образованию высоких титров сывороточного IgG против антигенов, кодируемых мРНК. Исследования на животных моделях (грызуны) свидетельствуют, что вакцины, содержащие мРНК, также эффективны при интраназальном введении [13]. Однако важно различать интраназальную вакцинацию и назальную вакцинацию. Грызунам часто дают наркоз для интраназальной вакцинации, чтобы животные медленно и глубоко дышали, вследствие чего вакцинный биоматериал в полной мере попадает в легкие. В результате большая часть литературы (включая некоторые цитируемые здесь источники) об интраназальной вакцинации грызунов на самом деле относится к внутрилегочной вакцинации, которая может обеспечить более полную защиту, чем строго назальная вакцинация. Тем не менее, резидуальные клетки памяти из носовых ходов могут предотвратить попадание вируса в легкие [4]. Учитывая, что доставка вакцины непосредственно в нижние дыхательные пути может вызывать воспаление или привести к обострению таких состояний, как бронхиальная астма или хроническая обструктивная болезнь легких (ХОБЛ), введение интраназальных вакцин людям обычно осуществляют таким образом, чтобы предотвратить непосредственное попадание антигена в легкие.
Липидный состав имеет решающее значение для стабильности мРНК вакцины, для прицельного воздействия иммунокомпетентных клеток и высвобождения мРНК в цитозоль. Таким образом, успешность применения интраназальных мРНК-вакцин в будущем, вероятно, будет зависеть от разработки липидных наночастиц, на которые смогут воздействовать соответствующие типы клеток в носовых ходах. В отличие от вирусов и вирусных векторов, на поверхности липидных наночастиц нет белков, и теоретически они не должны нейтрализоваться антителами. Благодаря этому, тот же состав, что и при первом введении, может быть применен для ревакцинации. Однако сохраняется вероятность развития побочных эффектов, таких как повышенная усталость и недомогание, часто связанных с введением вакцин на основе мРНК. Следовательно, при разработке интраназальных вакцин, содержащих мРНК, важно учитывать эти аспекты во избежание побочных эффектов и повышенной реактогенности.
В конечном счете, цель вакцинации — стимуляция иммунитета на длительное время. Однако продолжительность антительного ответа (по антителам сыворотки) значительно варьируется в зависимости от недостаточно изученных свойств антигенов, инициирующих иммунную реакцию [14]. Антительный ответ в слизистой оболочке считается краткосрочным, однако его фактическая продолжительность зависит от того, как часто иммунокомпетентные клетки встречают определенный антиген. Аналогично, циркулирующие Т-клетки иммунной памяти самообновляются и сохраняются на длительные периоды времени, тогда как популяция Т-клеток памяти, находящаяся в легких, исчезает относительно быстро: в большей степени это касается CD8+ Т-клеток, чем CD4+ Т-клеток. Таким образом, действие интраназальных вакцин должно вносить равновесие между функционированием местного иммунитета в дыхательных путях и длительностью системного иммунитета. Однако эффективные стратегии вакцинации не должны ограничиваться одним путем введения. Действительно, клетки памяти, стимулированные вакциной, введенной внутримышечно, могут быть доставлены внутрь слизистой путем интраназальной ревакцинации слизистой оболочки [15]. Таким образом, идеальная стратегия вакцинации может быть следующей:
Местное введение лекарственных препаратов при воспалительных заболеваниях верхних дыхательных путей
При лечении воспалительных заболеваний верхних дыхательных путей местному введению лекарственных препаратов придается большое значение. Дело в том, что препараты, во-первых, воздействуют непосредственно на очаг воспаления, во-вторых, создается оптимальна
При лечении воспалительных заболеваний верхних дыхательных путей местному введению лекарственных препаратов придается большое значение. Дело в том, что препараты, во-первых, воздействуют непосредственно на очаг воспаления, во-вторых, создается оптимальная концентрация необходимого лекарственного средства в очаге воспаления и, в-третьих, отсутствует системное поражение.
Необходимо учитывать, что высокая эффективность местного лечения зависит от широты спектра антибактериальной активности используемого препарата. При этом должен отсутствовать риск прямой или перекрестной резистенции и побочных реакций организма на данное лекарство.
В тех случаях, когда речь идет об общем инфекционном заболевании, местное лечение не должно исключать проведение комплексных процедур.
На слизистую оболочку верхних дыхательных путей прекрасно воздействуют различные лекарственные препараты, которые, кроме того, после всасывания в кровь действуют на весь организм. Также при использовании порошков, капель, растворов и ингаляций необходимо помнить, что слизистая оболочка имеет богатейший рецепторный аппарат, и его раздражение оказывает влияние как на организм в целом, так и на отдельные его органы.
Выбор лекарственного препарата и способ его местного введения зависят от того, по какой причине и на какой именно отдел верхних дыхательных путей необходимо оказать лечебное воздействие. Например, вдувание порошка обычно производят на определенный участок слизистой полости носа или ротоглотки.
Местное воздействие лекарственного препарата на слизистую оболочку полости носа не должно подавлять ее физиологические функции (выделительную, мукоциллиарный клиренс) и раздражать слизистую. Чтобы этого избежать, необходимо контролировать концентрацию препарата и его дозировки.
Воздействие на слизистую оболочку верхних дыхательных путей различными лекарственными препаратами призвано уничтожить (нейтрализовать) патогенную флору, попавшую в верхние дыхательные пути, восстановить двигательную функцию мерцательного эпителия, восстановить или, наоборот, подавить выделительную функцию железистых клеток слизистой оболочки, ликвидировать отек слизистой оболочки, а самое главное — восстановить нормальное функционирование слизистой оболочки верхних дыхательных путей. При этом необходимо учитывать длительность действия препарата на слизистую оболочку верхних дыхательных путей и частоту его использования.
Исходя из этого, необходимо подбирать лекарственные препараты таким образом, чтобы они нормализовали одни функции и не оказывали отрицательного влияния на другие.
Поэтому нужно учитывать, что порошок обычно «сушит» слизистую оболочку полости носа, блокирует серозные клетки и подавляет двигательную функцию мерцательного эпителия.
Промывание полости носа лекарственными растворами очищает слизистую оболочку полости носа от образовавшихся на ней гнойных корочек и тем самым создает условия для лучшего всасывания оболочкой лекарственных веществ.
Используя капли для носа, следует учитывать, что препарат эффективен только тогда, когда действует на большой участок оболочки полости носа. Этого можно достигнуть только при наклоне головы сначала в одну, а затем в другую сторону, а не при запрокидывании головы назад, когда капли стекают по нижнему носовому ходу в носоглотку.
Капли могут быть водорастворимыми или масляными. Самой природой слизистая оболочка носа не предназначена для воздействия на нее каплями и порошками. Более физиологичным является использование аэрозолей во время ингаляции.
Эффективность применения ингаляционной терапии не вызывает никакого сомнения. Она оказывает непосредственное воздействие лекарственными веществами на слизистую оболочку верхних дыхательных путей. При всасывании слизистой оболочкой лекарственных веществ во время ингаляции оказывается воздействие на весь организм. Ингаляции проводятся для того, чтобы воздействовать на саму оболочку верхних дыхательных путей, ввести в организм (кровь) лекарственные вещества через слизистую оболочку дыхательных путей.
Для достижения этих целей сами ингаляторы должны быть, во-первых, такими, чтобы ингалируемое лекарственное вещество попадало именно в те отделы дыхательных путей, на которые необходимо оказать воздействие (полость носа, околоносовые пазухи, глотка, гортань, трахея, бронхи, альвеолы). Во-вторых, необходимо, чтобы лекарство повлияло непосредственно на слизистую оболочку дыхательных путей (увлажняло ее, улучшало функцию мерцательного эпителия и очищало слизистую оболочку от пылевых частиц, сухих корочек, слизи, устраняло или хотя бы уменьшало отек слизистой оболочки, устраняло ее воспаление и т. д.).
В-третьих, лекарственный препарат через слизистую оболочку дыхательных путей и через альвеолы должен проникать непосредственно в кровь и оказывать общий лечебный эффект на организм.
При этом ингалируемое лекарственное вещество должно быть в виде аэрозоля. Чем меньше будут аэрозольные частицы лекарственного вещества, тем глубже они проникнут в дыхательные пути и тем больший оздоровительный эффект окажут (табл.).
 |
| Таблица. Величина аэрозольных частиц, оседающих в различных отделах дыхательных путей |
Получить такие мельчайшие частицы можно при воздействии высокочастотным ультразвуковым генератором на водорастворимые лекарственные вещества.
Учитывая все вышесказанное, прибор, ингалирующий лекарственные вещества, должен быть универсальным. Добиться этого довольно сложно. Решением могут стать ультразвуковой и компрессорный ингаляторы. Они позволяют нам воздействовать на необходимый отдел дыхательных путей, а также использовать различные препараты для лечения (воздействуя только на слизистую оболочку или на весь организм через кровь).
Эти приборы предназначены для индивидуального пользования. Они могут применяться не только в больнице, но и дома, а также в дорожных условиях, так как работают в том числе и от аккумулятора автомобиля.
Подобные ингаляторы удобны в использовании, потому что не требуют специального обучения и посторонней помощи при проведении ингаляции. Еще одно преимущество этих ингаляторов в том, что они позволяют экономно, дозировано расходовать лекарственные препараты.
Непосредственно в оториноларингологии при лечении заболеваний носа и околоносовых пазух (риниты, синуситы) используются индивидуальные ингаляторы. Для этого применяется насадка к ингалятору для носа. Вдох осуществляется через нос. Аэрозольные частицы лекарственного вещества при этом вступают в контакт не только со слизистой оболочкой полости носа, но и через функционирующие естественные отверстия проникают в околоносовые пазухи (верхнечелюстные, лобные и клиновидные) и также воздействуют на слизистую оболочку указанных пазух.
Для воздействия на слизистую оболочку ротоглотки (при фарингитах, тонзиллитах), гортани (при ларингитах) вдыхание аэрозолей осуществляется через загубник.
Когда необходимо воздействовать на слизистую оболочку полости носа и ротоглотки одновременно, используется специальная маска.
При проведении ингаляции каждый оториноларинголог должен четко представлять себе цель, которую он преследует, проводя данное лечение. Воздействует ли он только на слизистую оболочку дыхательных путей (смягчение слизистой оболочки, улучшение отхождения слизи, улучшение функции мерцательного эпителия, снятие воспалительного отека) или вводит в кровь через слизистую оболочку дыхательных путей различные лекарственные препараты. В зависимости от целей, это могут быть ингаляции со щелочными растворами, масляными растворами, растворами лекарственных трав, антибиотиков, антибактериальных препаратов, протеолитических ферментов, муколитиков, кровоостанавливающих средств.
В США, Великобритании, Франции, Германии, Индии препараты на растительной основе применяются чаще, чем лекарственные средства на химической основе. В этих странах крупные фармацевтические фирмы выращивают лекарственные травы в экологически чистых зонах, собирают их в определенное время года и суток, перерабатывают их специальным способом. Самые популярные и эффективные препараты этих фирм теперь можно купить и в российских аптеках.
Препараты на растительной основе являются прекрасной альтернативой синтетическим лекарственным препаратам, которые способны вызывать побочные действия.
Очевидно, что во время ингаляций лекарственными препаратами предпочтение должно отдаваться препаратам на растительной основе. Среди них следует выделить эфирные масла, которые обладают ярко выраженными антисептическими, антивирусными, бактерицидными и противовоспалительными свойствами. Они способны выводить из организма токсины. Среди множества эфирных масел, применяемых в медицине при лечении простудных заболеваний, наиболее часто используются мятное, эвкалиптовое, можжевеловое, пихтовое и гвоздичное масла.
Применение эфирных масел для ингаляций более эффективно, так как их мельчайшие частицы равномерно распределяются по всей слизистой оболочке дыхательных путей (полости носа, гортани, трахеи и бронхов), через естественные отверстия они также проникают в околоносовые пазухи (верхнечелюстные, лобные), оказывая там свое лечебное воздействие.
Необходимо учитывать, что вдыхаемые эфирные масла раздражают рецепторы обонятельного анализатора и, в зависимости от состава, могут влиять на самочувствие, настроение, работу сердечно-сосудистой системы.
Кроме того, следует иметь в виду, что эфирные масла можно использовать самостоятельно, без специального ингалятора, путем вдыхания их непосредственно из флакона или при нанесении нескольких капель масла на носовой платок.
Наиболее эффективно действует комбинация нескольких эфирных масел, обладающих различными взаимодополняющими свойствами, которые одновременно воздействуют на слизистую оболочку верхних дыхательных путей, оказывая на нее бактерицидное и противовоспалительное действие, а через нервные рецепторы влияют на различные органы и системы организма.
Итак, при местном введении лекарственных препаратов для лечения воспалительных заболеваний верхних дыхательных путей предпочтение следует отдавать ингаляционной терапии (желательно с использованием ультразвуковых ингаляторов) и вдыханию ароматических эфирных масел.
Р. Г. Анютин, доктор медицинских наук, профессор
МГМСУ, Москва