Что такое ингибитор тирозинкиназы
Что такое ингибитор тирозинкиназы
Открытие системы внутриклеточной передачи внешнего сигнала обеспечило возможность разработки нового поколения противораковых препаратов. Эти препараты блокируют белковый синтез в цепочке передачи сигнала и клеточное деление. Оба процесса жизненно важны для нормальной клетки. Для передачи внешнего сигнала в клетке существует много альтернативных путей.
Поэтому действие препарата на опухоль будет зависеть от того, в какой степени в опухолевых клетках реализуется тот или иной путь его передачи.
Ростовые факторы и их рецептор. Рецепторы тирозинкиназ (RTK). Действие RTK схематически представлено на рисунке ниже. К числу лигандов, запускающих систему передачи сигнала, относятся эпителиальный ростовой фактор (EGF), трансформирующий ростовой фактор-а (TGF-а), ростовой фактор эндотелия сосудов (VEGF) и их рецепторы HER 1-4. Существует два подхода к разработке лекарственных средств:
• получение моноклональных антител, которые связываются с ростовыми факторами или с клеточными рецепторами, тем самым блокируя передачу сигнала;
• поиск соединений, способных связываться с киназой, или с критическими компонентами системы реализации сигнала. Один из наиболее удачных примеров использования моноклональных антител — разработка препарата Трастузумаб (Герцептина). Он представляет собой моноклональные антитела человека, которые блокируют HER-2. Показано, что препарат В последнее время в клиническую практику вошло несколько низкомолекулярных ингибиторов тирозинкиназ.
Они проявляют некоторую, хотя и не абсолютную, специфичность к какой-либо определенной киназе. С-abl представляет собой цитоплазматическую тирозинкиназу, которая в результате транслокации 9;22, происходящей при хроническом миелобластном лейкозе, образует ковалентно-связанный комплекс с bcr. Функционирование комплекса bcr/abl является существенным фатором, ответственным за рост лейкозных клеток. Иматиниб представляет собой соединение, которое блокирует функции комплекса.
Препарат оказывает высокий и продолжительный противоопухолевый эффект у больных хроническим миелобластным лейкозом. Кроме того, он подавляет гиперэкспрессию c-KIT тирозинкиназы, которая происходит в клетках опухолей стромы желудочно-кишечного тракта, и используется как основное терапевтическое средство для лечения больных с этими опухолями.
Гефитиниб блокирует EGF-рецептор тирозинкиназы. Препарат проявляет активность у 10% больных с распространенным немелкоклеточным раком легкого и у 50% больных со стабилизировавшимся опухолевым процессом. Рандомизированные испытания препарата, назначаемого совместно с химиотерапевтическими средствами, не показали увеличения выживаемости больных. Гефитиниб оказывает токсическое действие на легкие (что может приводить к снижению выживаемости), вызывает кожную сыпь и диарею.
Эрлотиниб представляет собой ингибитор EGF-рецептора тирозинкиназы, который применяется перорально, и эффективен при распространенном немелкоклеточном раке легкого. В настоящее время исследуется возможность его применения в схемах комбинированой терапии этого и других видов рака. Препарат оказывает токсический эффект на роговицу и сердечную деятельность, а также вызывает появление сыпи и диарею.
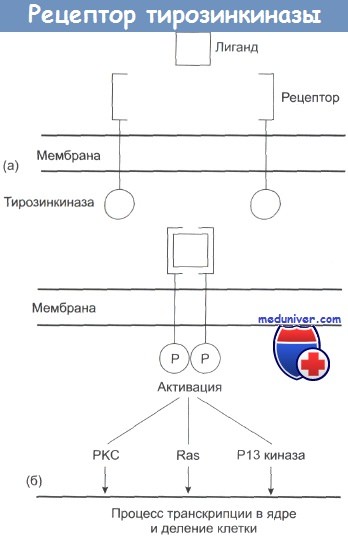
(а) Рецептор расположен на наружной, а тирозинкиназа — на внутренней стороне клеточной мембраны,
(б) Присоединение лиганда приводит к димеризации и к активации тирозинкиназы за счет ее фосфорилирования (Р).
Этот процесс приводит к активации протеинкиназы С (РКС), Ras и Р13 киназы, которые запускают процесс транскрипции и синтез ДНК.
Ингибиторы RAS в химиотерапии
Активация онкогена ras является существенным фактором злокачественного роста. До активации белки семейства ras должны модифицироваться при участии фермента фарнезилтрансферазы.
В модельных экспериментах ингибиторы этого фермента проявляют противоопухолевое действие.
Ингибиторы протеинкиназы С (РКС) в химиотерапии
Известно много изоформ этого фермента. Первым соединением, испытанным в клинике, был бриостатин. Он проявил небольшую эффективность. Основной токсический эффект препарата — развитие миалгии. В настоящее время его испытывают при комбинированном применении. Стауроспорин действует на каталитический центр РСК и на первой фазе клинических испытаний препарат проявил противоопухолевую активность.
В плазме крови это соединение и его производные связываются с кислыми гликопротеинами, что увеличивает срок его выведения из организма. В настоящее время соединения проходят испытания при совместном применении со стандартными противоопухолевыми препаратами.
Ингибиторы циклинзависимых киназ (CDKs) в химиотерапии
Циклинзависимые киназы являются важным компонентом механизма регуляции клеточного цикла. В настоящее время различные ингибиторы киназ проходят первую фазу клинических испытаний. Наиболее полно исследован флавопиридол, который оказался эффективным по отношению к различным опухолям. Токсические проявления включают миалгию и диарею. Испытываются также другие средства.
Ингибиторы металлопротеаз в химиотерапии
Металлопротеазы клеточного матрикса представляют собой секретируемые ферменты, участвующие в прохождении клеток через соединительную ткань. Они секретируются в неактивной форме и при активации расщепляются. Активность этих ферментов регулируется тканевыми ингибиторами металлопротеаз. Вероятно, эти ферменты играют важную роль в локальном росте опухолей и в их метастазировании. Наиболее полно исследованным соединением этого типа является маримистат.
На 2-й стадии испытаний этот агент предотвращал увеличение уровня опухолевых маркеров, однако при более обширных исследованиях целесообразность его применения в клинике не подтвердилась. Основным токсическим осложнением при применении маримистата является миалгия.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Резистентность к ингибиторам тирозинкиназы EGFR:
проблема и пути ее решения
Рак легкого был и остается самой частой причиной смерти от злокачественных заболеваний в мире, при этом немелкоклеточный рак легкого (НМРЛ) регистрируется в 85% случаев [1]. Химиотерапия, составляющая основу лечения НМРЛ, не всегда демонстрирует достаточную эффективность в отношении данного заболевания [2]. Препараты нового класса, ингибиторы тирозинкиназы (ИТК) EGFR, целью которых являются рецепторы эпидермального фактора роста (EGFR), в частности, препарат гефитиниб, и в клинических испытаниях, и на практике показали многообещающие результаты [3]. Чувствительность к ним определяется наличием в опухолевых клетках соматических мутаций в гене EGFR, представляющих собой небольшие делеции аминокислот 747-750 или точечные мутации (наиболее часто в виде замены лейцина на аргинин в кодоне 858 (L858R)) [4]. Было показано, что применение ИТК у пациентов с подтвержденной мутацией в гене EGFR ассоциируется с увеличением частоты объективных ответов, а также способствует повышению продолжительности жизни без прогрессирования [5]. Тем не менее, успех терапии ИТК НМРЛ с мутацией в гене EGFR в подавляющем большинстве случаев носит временный характер: как правило, после года терапии заболевание начинает прогрессировать [6].
Понятие первичной и приобретенной резистентности
Устойчивость, или резистентность к воздействию химиотерапевтических лекарственных средств, является одним из основных ограничений для лечения онкологических заболеваний, в том числе и немелкоклеточного рака легких (НМРЛ). Опухоли могут демонстрировать как резистентность de novo, то есть первичную, так и вторичную, приобретенную устойчивость.
Первичная резистентность имеет место в случаях, когда некоторые присущие раковым клеткам первичные характеристики обусловливают ее устойчивость к данному классу лекарственных препаратов.
Так, около 25% пациентов с НМРЛ с мутациями EGFR в опухолевых клетках не отвечают на терапию ИТК (по сравнению с 90% среди всех больных НМРЛ) [6]. Известно, что некоторые мутации EGFR, расположенные в экзонах 18-21, ассоциируются с первичной резистентностью к ИТК. Например, небольшие инсерции или дупликации в экзоне 20 (такие как D770_N771, NPG, SVQ и другие), которые наблюдаются в 5% случаев НМРЛ, менее чувствительны к ИТК, чем опухоли с мутациями в экзоне 19 и L858R [7].
Первичная резистентность к ИТК может также быть результатом и более редких мутаций в EGFR, которые встречаются наряду с мутациями, ответственными за чувствительность к лекарственным препаратам.
Приобретенная резистентность возникает в случаях, когда первично чувствительные к лекарственному препарату опухолевые клетки становятся устойчивыми к терапии уже во время лечения [8].
Причины приобретенной резистентности к ИТК EGFR
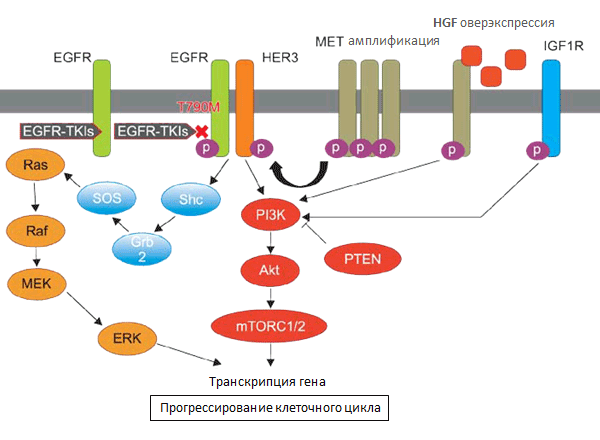
Одной из наиболее распространенных причин приобретенной устойчивости к ИТК является вторичная мутация в экзоне 20, которая заключается в замещении метионина на треонин в положении 790 (Т790М) в домене киназы. Мутации Т790М в EGFR регистрируются более чем в 50% опухолей с приобретенной резистентностью к ИТК [9]. Наряду с Т790М приобретенная устойчивость может быть ассоциирована с другими вторичными мутациями, в том числе L747S (экзон 19) [10], D761Y (экзон 19) [11] и Т854А (экзон 21 в петле активации) [12].
Примерно в 20% случаев вторичной устойчивости к терапии ИТК ее причиной является амплификация онкогена МЕТ, при этом не имеет значения, существует ли мутация Т790М, или нет [13]. Рецептор тирозинкиназы МЕТ мутирует или избыточно экспрессируется при многих опухолях, в том числе НМРЛ. МЕТ образуется главным образом на клетках эпителиального происхождения и активируется его лигандом, фактором роста гепатоцитов (HGF), отвечая за запуск ряда внутриклеточных сигнальных каскадов [14]. МЕТ и HGF необходимы для эмбрионального развития, так как они участвуют в обнаружении дефектов в эпителиально-мезенхимальном переходе во время органогенеза [15]. Кроме того, они играют важную роль в клеточной пролиферации, ангиогенезе, миграции и инвазии клеток, а также морфогенной дифференциации и тканевой организации.
Функция МЕТ в опухолях человека может быть повышена за счет амплификации этого рецептора, что приводит к серьезным изменениям, в том числе, пролиферации опухолевых клеток, снижению апоптоза, ангиогенезу, изменению функции цитоскелета и метастазированию, а также развитию устойчивости к ИТК.
Опухоли примерно 40% пациентов с приобретенной резистентностью к ИТК не имеют вторичной мутации Т790М или амплификации МЕТ. Существуют данные, подтверждающие роль тирозиновой протеинкиназы EGFR/ErbB, которая кодируется геном ERBB2, HER2 в развитии резистентности к ИТК. Так, в работе Ken Takezawa [16] продемонстрировано, что в 12% случаев приобретенной устойчивости была зафиксирована амплификация HER2 (по сравнению с 1% у пациентов с нелеченной аденокарциномой легких).
Известны случаи, когда у больных с изначально диагностированной аденокарциномой с мутацией EGFR и развившейся приобретенной резистентностью к ИТК во время рецидива был выявлен мелкоклеточный рак легкого (МРЛ) [17]. До сих пор остается неизвестным, вызвана ли трансформация НМРЛ в МРЛ наличием в первичной опухоли компонента мелкоклеточного рака, или процесс ассоциирован с трансдифференциацией аденокарциномы.
In vitro была показана связь между эпителиально-мезенхемальным переходом (ЕМП) и устойчивостью к ИТК EGFR [18]. Более того, данные исследований свидетельствуют, что ЕМП можно выявить и в опухоли пациента [19]. С приобретенной резистентностью может быть ассоциировано и усиление сигнализации от рецептора инсулин-подобного фактора роста (IGF1R), хотя эта связь была продемонстрирована только в модели in vitro с использованием линии клеток, экспрессирующей высокий уровни «дикого» типа EGFR [20]. Следует подчеркнуть, что в механизме развития приобретенной резистентности к ИТК EGFR остается немало белых пятен, и активные исследовательские работы в этой области продолжаются. Одним из наиболее изученных на сегодняшний день механизмов формирования резистентности является самый распространенный – вторичная мутация Т790М.
Сегодня известны по крайней мере два молекулярных механизма, объясняющие, каким образом мутация Т790М придает опухоли лекарственную устойчивость. Во-первых, замена метионина на треонин в положении 790 приводит к изменению связывания препарата в кармане АТФ EGFR. Во-вторых, мутация Т790М значительно увеличивает афинность АТФ к EGFR-L858R, практически восстанавливая сродство АТФ до уровня «дикого» типа EGFR. Это восстановление закрывает терапевтическое окно, возникающее вследствие сниженной афинности АТФ к онкогенным мутациям, которые обычно более легко ингибируются по сравнению с диким EGFR [21]. Развитие приобретенной устойчивости вследствие мутации Т790М может происходить двумя путями. В первом случае замещение метионина на треонин в Т790М в опухолевых клетках отсутствует изначально и развивается de novo в одной или более клональной популяции на фоне лечения ИТК EGFR. Во второй модели замещение существует в cis вследствие первичной активирующей мутации у небольшой популяции и «проявляется» в присутствии ИТК EGFR.
Биохимические исследования свойств Т790М показали, что у пациентов с приобретенной резистентностью на фоне вторичной мутации усиливается активность киназы к первично активированным аллелям EGFR, что, возможно, способствует повышению онкогенности [22]. Однако, несмотря на это, больные с мутацией Т790М могут демонстрировать достаточно медленные темпы прогрессирования заболевания [23]. Более того, даже после прекращения терапии ИТК в некоторых случаях регистрируется положительная динамика в развитии заболевания [24]. Это указывает на то, что часть опухолевых клеток все-таки остается чувствительной к ингибированию EGFR. В подтверждение этой теории сообщается о множественных повторных ответах на терапию ИТК после короткого перерыва в таргетной терапии [24]. Добавим, что точный механизм подобного явления до сих пор остается невыясненным.
Возможности лечения НМРЛ у пациентов с приобретенной резистентностью
Учитывая актуальность проблемы резистентности к ИТК, альтернативная длительная стратегия терапии НМРЛ с мутацией EGFR должна учитывать необходимость предотвращения или хотя бы увеличения времени до развития устойчивости. Один из подходов к рационализации терапии заключается в изучении влияния различных стратегий дозирования с использованием уже существующих ИТК. В его пользу говорит недостаточно углубленное изучение оптимальных режимов дозирования для опухолей с мутацией EGFR. Математическое моделирование показывает, что различные схемы дозировки могут положительно влиять на развитие устойчивости (пролонгировать резистентность) без ущерба для эффективности [25].
При уже имеющейся вторичной резистентности к ИТК целесообразно назначение дополнительной терапии, ориентированной на подавление механизма лекарственной устойчивости.
Как минимум две возможности комбинирования терапии ИТК предложены на сегодняшний день, и в первую очередь, при помощи препаратов группы ингибиторов сигнальной трансдукции. Эта схема может применяться при лечении опухолей с подтвержденной мутацией EGFR наряду с избыточной экспрессией и/или аномальной активацией другого фактора роста или рецепторной системы (например, IGFR-I). В таких случаях комбинация ИТК с ингибиторами сигнальной трансдукции (например, PI3K) может обеспечить более длительный ответ на терапию. Практическая проблема состоит в том, что ингибиторы PI3K имеют целый ряд токсических побочных эффектов из-за существенной роли PI3K в физиологических процессах.
Вторая возможность преодолеть или пролонгировать развитие приобретенной резистентности к ИТК состоит в их комбинации с таргетными антиангиогенными препаратами. Этот способ представляется перспективным как минимум по двум причинам. В первую очередь, его применение сопряжено с феноменом «двойного удара», при котором выживаемость пациентов обусловлена элиминацией эндотелиальных клеток в дополнение к непосредственной антиопухолевой активности ИТК. К тому же снижение порога выживаемости опухолевых клеток вследствие ингибирования EGFR может способствовать повышению восприимчивости опухоли к антиангиогенной терапии [26]. Таким образом, комбинирование ИТК и антиангиогенных препаратов может повышать эффективность терапии, уменьшая вероятность выживания и экспансии резистентных популяций опухолевых клеток.
Успех комплексной терапии резистентности к ИТК зависит от возможности быстро определить механизм устойчивости. С этой целью пациенты с НМРЛ и мутацией EGFR в опухолевых клетках, у которых терапия ИТК была эффективной, при развитии лекарственной резистентности должны подвергнуться повторной биопсии или определению циркулирующей опухолевой ДНК в плазме с целью точного анализа механизма устойчивости.
Проведение повторных биопсий затруднено вследствие инвазивности процедуры, а также вероятности внутриопухолевой гетерогенности, которая может привести к получению некорректного результата [27]. Исследования показывают, что геномные изменения в солидных опухолях могут быть охарактеризованы с помощью массивного параллельного секвенирования циркулирующих внеопухолевых молекул ДНК, высвобожденных из опухолевых клеток. Этот сравнительно экономичный и быстрый метод, получивший название неинвазивной жидкостной биопсии, может значительно облегчить анализ механизма резистентности [28].
Неинвазивным методом – выделением опухолевой ДНК [29], а также циркулирующих опухолевых клеток из плазмы [30] – может быть успешно выявлена мутация Т790М. Неинвазивный анализ приобретенной резистентности путем выделения ДНК в плазме результативен и при других механизмах развития резистентности [31].
Молекулярно-генетическое тестирование в плазме, с помощью которого можно определить и качественное, и количественное содержание мутаций, сопряженных с резистентностью к ИТК, позволяет дать оценку эффективности терапии ИТК и течению заболевания. Так, в российском исследовании Д.Д. Сакаевой и М.Г. Гордиева [32], анализировавшем динамику мутаций в гене EGFR в цоДНК при распространенном немелкоклеточном раке легкого на фоне терапии гефитинибом, было показано, что объективный ответ на терапию коррелировал с исчезновением активирующих мутаций EGFR в плазме. Повторное же появление в плазме крови активирующих мутаций EGFR и/или Т790М являлось одним из предикторов прогрессии НМРЛ.
Осимертиниб: таргетная терапия Т790М-позитивного НМРЛ
Высокая частота активирующих мутаций, сопряженных с резистентностью к ИТК EGFR, обусловила активизацию поиска новых таргетных препаратов, которые помогли бы решить проблему устойчивости. Определенно самым значимым достижением в терапии Т790М-позитивного НМРЛ последних лет стало создание первого ИТК третьего поколения, действующего как на активирующую мутацию, так и на мутацию вторичной резистентности Т790М в гене EGFR, – осимертиниба. Осенью 2017 года препарат Тагриссо ® (осимертиниб) был зарегистрирован в РФ для терапии местнораспространенного или метастатического НМРЛ с мутацией Т790М в гене EGFR.
Осимертиниб представляет собой необратимый ингибитор ТК EGFR, эффективный при наличии сенсибилизирующих мутаций гена EGFR и мутации Т790М, связанной с развитием резистентности к ИТК [33]. Препарат селективно действует на клетки как с активирующими мутациями гена EGFR (мутация L858R в 21-м экзоне, делеции в 19 экзоне), так и с мутацией резистентности Т790М, являющейся основной причиной резистентности к ИТК EGFR 1-2 поколений.
Осимертиниб отличается высокой активностью и ингибирующим действием в отношении EGFR во всех клинически значимых линиях НМРЛ, несущих сенсибилизирующие мутации EGFR и мутацию резистентности Т790М, что приводит к подавлению клеточного роста [33]. При этом препарат демонстрирует низкую активность в отношении клеточных линий, имеющих дикий тип EGFR (IC50 461-650 наномоль для различных клеточных линий).
По сути, появление нового эффективного таргетного препарата для пациентов с прогрессирующим НМРЛ означает изменения в алгоритмах диагностики и терапии заболевания. Пациентам с прогрессированием на фоне терапии ИТК EGFR показано проведение повторного молекулярно-генетического тестирования для определения молекулярного профиля опухоли и выбора дальнейшей тактики терапии. Так, в руководстве Европейского общества медицинской онкологии (ESMO) и Всеобщей национальной онкологической сети (NCCN) по диагностике, лечению и наблюдению больных раком легкого указано, что для пациентов с клиническим прогрессированием на фоне предыдущего лечения ингибиторами тирозинкиназ EGFR 1-2 поколений и подтвержденной мутацией Т790М должно быть предложено лечение осимертинибом в дозе 80 мг в сутки [35, 36].
Отечественные клинические рекомендации и руководства по лекарственному лечению злокачественных опухолей АОР рекомендуют проведение таргетной терапии осимертинибом до прогрессирования в качестве 2-й линии НМРЛ после прогрессирования на фоне приема ингибитора тирозинкиназы EGFR в случае выявления мутации Т790М в гене рецептора эпидермального фактора роста (EGFR) [37].
Вывод
Ингибиторы ТК, как препараты молекулярной таргетной терапии, открыли новые перспективы в лечении НМРЛ с активирующими мутациями EGFR. Однако генетическая нестабильность опухолевых клеток приводит к развитию приобретенной резистентности к ИТК. Преодоление устойчивости опухоли – серьезный вызов, который стоит перед современными учеными. Определенные положительные результаты в борьбе с лекарственной устойчивостью, которые продемонстрировали новые стратегии дозирования, а также комбинированная терапия, позволяют смотреть в будущее с некоторой долей оптимизма.
Место тирозинкиназных ингибиторов во второй линии терапии метастатического почечно-клеточного рака
Симпозиум на эту тему состоялcя на Петербургском международном онкологическом форуме «Белые ночи» в июне 2020 г. и проходил в формате онлайн. Специалисты разбирались, какие препараты наиболее действенны в терапии метастатического почечно-клеточного рака, чем руководствуются зарубежные и отечественные профессиональные ассоциации, включив их в свои рекомендации.
Обзор существующих опций среди тирозинкиназных ингибиторов. Зачем нужны новые ТКИ?
История применения тирозинкиназных ингибиторов (ТКИ) в лечении пациентов с метастатическим раком почки относительно непродолжительная – около 15 лет. Начиная с 2015 г. возникло новое поколение ингибиторов тирозинкиназ, и у препаратов появились другие мишени. Конечно же, применение ингибиторов тирозинкиназ почки явилось важной вехой в лечении метастатического рака и позволило увеличить выживаемость пациентов практически в два раза по сравнению с теми показателями, что были в эру цитокиновой терапии. Тогда медиана общей выживаемости (ОВ) во всей популяции пациентов не превышала 12 месяцев. Применение ингибиторов тирозинкиназ позволило увеличить ее до 24 месяцев. Тем не менее у большинства пациентов постепенно развивается устойчивость к первой линии терапии ингибиторами тирозинкиназ. Медиана выживаемости без прогрессирования (ВБП) у ранее не леченных пациентов составляет около 11 месяцев. Кроме этого, у 10% больных наблюдается резистентность к антиангиогенной VGFR-таргетной терапии первой линии с самого начала. Она обусловлена активизацией новых сигнальных путей, позволяющей опухолевым клеткам выжить при ингибировании VGFR-таргетного пути. Среди них сигнальные пути, связанные с увеличением инвазии, метастазиро ванием опухоли, фактором роста гепатоцитов MET, инсулиноподобным фактором роста. Важную роль играет эпителиально-мезенхимальный переход опухолевых клеток. Кроме того, приобретает значение активизация сигнального пути mTOR, которая также позволяет клеткам выжить. Иммунные механизмы тоже играют свою роль. Мы знаем, что даже при успешном лечении ингибиторами тирозинкиназы происходит высвобождение различных цитокинов вследствие большой гибели опухолевых клеток.
Эти цитокины в свою очередь создают провоспалительное опухолевое окружение, привлекающее различные иммунные клетки, в том числе и те, что подавляют иммунные ответы. Механизмов резистентности много, но подходы в ее преодолении заключаются в том, чтобы воздействовать как раз на другие мишени, на другие сигнальные пути. По сравнению с ингибиторами тирозинкиназ первого поколения (акситинибом, пазопанибом, сорафенибом, сунитинибом) кабозантиниб воздействует не только на рецептор сосудисто-эндотелиального фактора роста, но и на мишени AХL и MET, которые находятся как на клетках эндотелия, так и на опухолевых клетках. Еще один ингибитор новых тирозинкиназ – ленватиниб помимо VEGFR ингибирует PDGFR, фактор роста фибробластов, с чем тоже связывают эффективность лечения уже после прогрессирования пациентов на ингибиторах тирозинкиназ первого поколения.
Другим путем преодоления лекарственной резистентности является применение комбинаций (или монотерапии) ингибиторов контрольных точек. Это уже совершенно другой механизм действия – растормаживание собственных T-лимфоцитов.
Основной мишенью ингибиторов тирозинкиназ первого поколения, таких как сорафениб, сунитиниб, пазопаниб, акситиниб, ленватиниб, является VEGFR. А у кабозантиниба прибавляются две важные мишени AXL и MET. Именно с ними, возможно, связано развитие резистентности. По мере лечения пациентов сунитинибом увеличивается экспрессия AXL и MET, что, возможно, является причиной развития резистентности к первой линии анти-VEGFR таргетной терапии. Кроме этого, было замечено, что высокий уровень экспрессии MET и AXL ассоциирован с худшими показателями как канцер-специфической, так и общей выживаемости.
Кабозантиниб как раз воздействует не только на VEGFR, но и на мишени MET и AXL, тем самым преодолевая резистентность, которая развивается при применении ингибиторов первого поколения и эффективно воздействует на опухолевые клетки.
В регистрационном исследовании III фазы METEOR кабозантиниб исследовался у пациентов, которые получили одну и более линий анти-VEGFR таргетной терапии и прогрессировали. Препарат применялся в стандартной дозировке (60 мг перорально ежедневно) и сравнивался со стандартом того времени во второй линии терапии ингибитором mTOR эверолимусом (10 мг в сутки). Конечной точкой исследования было определение ВБП. Вторичные конечные точки включали ОВ, частоту ответов и безопасность лечения.
Приблизительно треть пациентов получали две и более линий ингибиторов тирозинкиназ. В основном это были пазопаниб, сунитиниб, акситиниб, сорафениб. 5% пациентов даже получали анти-PD-L1-препараты. Кабозантиниб продемонстрировал преимущество по сравнению с эверолимусом в эффективности и ВБП: достоверное уменьшение риска прогрессии и достоверное увеличение ОВ – снижение риска смерти от рака почки на 30% при приблизительно двухлетнем наблюдении. Кроме того, при применении кабозантиниба практически в шесть раз была выше частота объективного ответа на лечение − 17% по сравнению с 3% в группе пациентов, которые получали эверолимус. Если говорить о безопасности кабозантиниба, то не было отмечено каких-то новых побочных эффектов, нехарактерных для ингибиторов тирозинкиназ. Среди нежелательных явлений (НЯ) в основном диарея, гипертензия, слабость, ладонно-подошвенный синдром, анемия, гастроинтестинальные явления. Но если мы посмотрим на частоту нежелательных явлений 3-й и 4-й степени, отмеченных более чем у 5% больных, то этот процент относительно небольшой: диарея – у 13% из них, гипертензия – у 15%, слабость – у 11%, ладонно-подошвенный синдром – у 8%. Это наиболее часто встречающие ся НЯ, с которыми можно бороться, учитывая высокую эффективность кабозантиниба.
Кабозантиниб и первое поколение ТКИ: данные клинических исследований и место в рекомендациях
Как отметил А.К. Носов, предыдущий докладчик наглядно и убедительно показал: молекулярный механизм действия кабозантиниба на сегодняшний день более совершенный и продвинутый. Он может блокировать дополнительные пути, за счет которых как раз и развивается резистентность. Плюс препарат дает дополнительные возможности для воздействия на опухолевые клетки. Носов сказал, что в своем докладе он покажет, насколько кабозантиниб предпочтительнее в сравнении с ранними ингибиторами тирозинкиназ в клинической практике.
В России прямых серьезных исследований препарата нет. Тем не менее клиническая база достаточна для того, чтобы говорить о преимуществах кабозантиниба. Ранние ингибиторы тирозинкиназ в чем-то уступают новым препаратам и сходят с арены, хотя все-таки для битором mTOR эверолимусом (10 мг в сутки). Конечной точкой исследования было определение ВБП. Вторичные конечные точки включали ОВ, частоту ответов и безопасность лечения.
Приблизительно треть пациентов получали две и более линий ингибиторов тирозинкиназ. В основном это были пазопаниб, сунитиниб, акситиниб, сорафениб. 5% пациентов даже получали анти-PD-L1-препараты. Кабозантиниб продемонстрировал преимущество по сравнению с эверолимусом в эффективности и ВБП: достоверное уменьшение риска прогрессии и достоверное увеличение ОВ – снижение риска смерти от рака почки на 30% при приблизительно двухлетнем наблюдении. Кроме того, при применении кабозантиниба практически в шесть раз была выше частота объективного ответа на лечение − 17% по сравнению с 3% в группе пациентов, которые получали эверолимус. Если говорить о безопасности кабозантиниба, то не было отмечено каких-то новых побочных эффектов, нехарактерных для ингибиторов тирозинкиназ. Среди нежелательных явлений (НЯ) в основном диарея, гипертензия, слабость, ладон но-подошвенный синдром, анемия, гастроинтестинальные явления. Но если мы посмотрим на частоту нежелательных явлений 3-й и 4-й степени, отмеченных более чем у 5% больных, то этот процент относительно небольшой: диарея – у 13% из них, гипертензия – у 15%, слабость – у 11%, ладонно-подошвенный синдром – у 8%. Это наиболее часто встречающиеся НЯ, с которыми можно бороться, учитывая высокую эффективность кабозантиниба. них еще остается место, особенно для больных с хорошим прогнозом. И вполне возможно, что эти препараты для своей категории больных могут быть весьма актуальны.
Тем более если появятся предикторы, которые будут определять группы больных. Первый препарат, который появился в клинической практике отечественных онкологов, – это сорафениб. Регистрационное исследование TARGET впервые продемонстрировало, что новый лекарственный препарат более эффективен, нежели цитокиновая терапия, для пациентов с метастатическим почечным светлоклеточным вариантом рака. Половина пациентов была с благоприятным прогнозом, половина – с промежуточным. Продемонстрировано достоверное различие по безрецидивной выживаемости между сорафенибом и плацебо во второй линии лечения после цитокинов. К сожалению, не было достоверных различий по ОВ, хотя кривые имели тенденцию к расхождению. Важно отметить, что, действительно, сорафениб во второй линии был оценен только после цитокинов.
Для оценки эффективности после других тирозинкиназ в больших рандомизированных исследованиях прямых сравнений проведено не было. И даже в исследованиях SWITCH и SWITCH II больных, которые получали сорафениб во второй линии после сунитиниба и после пазопаниба, достаточно мало – всего 76–86 пациентов. Но именно эта последовательность показала чрезвычайно низкую безрецидивную выживаемость – 2,8 и 2,1 месяца, что наглядно демонстрирует низкую эффективность подобной последовательности и нецелесообразность применения сорафениба во второй линии после тирозинкиназ.
Наверное, именно эти данные нашли свое отражение в показаниях к применению. В Российской Федерации и Соединенных Штатах Америки они достаточно общие, европейские более детализированы – сорафениб показан только для пациентов с распространенным почечно-клеточным раком после прогрессии на предшествующей терапии цитокинами. Конечно, сегодня даже в нашей стране таких пациентов уже практически нет, но тем не менее для второй линии лечения подобные показания зарегистрированы в европейских инструкциях.
При сетевом метаанализе кабозантиниба с другими опциями второй линии терапии рассматривались различные препараты, в том числе ингибиторы mTOR. Было включено и исследование TARGET с сорафенибом. В этом метаанализе было показано, что сорафениб имеет худшие показатели безрецидивной выживаемости среди всех представленных препаратов. И в сравнении с ним, конечно, однозначное преимущество у кабозантиниба.
Таким образом, понятно, что на сегодняшний день сорафениб во второй линии терапии не конкурирует с кабозантинибом. И выбор здесь однозначный. Второй препарат из ранних ингибиторов тирозинкиназ − это сунитиниб. Первые исследования эффективности сунитиниба, проведенные Motzer, во II фазе продемонстрировали достаточно высокую частоту ответов и выживаемость без прогрессирования 8,7 месяца, что является достаточно высоким показателем для того времени.
Прямое сравнение сунитиниба с интерфероном-альфа, проведенное в регистрационном исследовании, продемонстрировало преимущество ВБП для группы пациентов, получающих сунитиниб. Видно определенное расхождение кривых по уровню ОВ без явных достоверных различий. Та же самая картина и при оценке исследований сунитиниба во второй линии. Третья фаза – только исследование SWITCH. И несколько большая эффективность – 5,4 месяца безрецидивной выживаемости в последовательности сорафениб – сунитиниб по сравнению с обратной комбинацией. Но тем не менее она уступает исследованию Motzer во второй линии после цитокинов и показывает достаточно низкие показатели выживаемости для этих пациентов.
И вот CABOSUN – прямое сравнение препаратов II фазы у пациентов с метастатическим почечно-клеточным раком и распространенным почечно-клеточным раком в первой линии терапии. В исследование включались пациенты с промежуточным и плохим прогнозом по критериям IMDC, с наличием измеримого опухолевого очага, ECOG составлял от 0 до 2. Также включались пациенты и с наличием костных метастазов. Пациенты рандомизировались на группы кабозантиниба (60 мг ежедневно) и сунитиниба (50 мг по схеме 4/2 недели). Оценивалась ВБП как первичная конечная точка и вторичные конечные точки: ОВ, частота ответа и безопасность. В этом исследовании было продемонстрировано преимущество кабозантиниба по безрецидивной выживаемости. Достоверные различия таковы: 8,6 месяца для пациентов, получающих кабозантиниб, и 5,3 месяца для пациентов, получающих сунитиниб. Продемонстрировано снижение риска прогрессирования на 52%. Однако кривые не разошлись при оценке ОВ, снижение риска смерти составило 20%. 26 месяцев – ОВ для пациентов, получавших кабозантиниб, и 21 месяц – для пациентов, получавших сунитиниб. Таким образом, мы видим значительные преимущества кабозантиниба как по первичной оценочной точке, так и по дополнительным точкам, в том числе по частоте объективного ответа (33% для группы кабозантиниба и 12% для группы сунитиниба). И по уровню стабилизации заболевания, и по частоте контроля над заболеванием кабозантиниб также имел определенное преимущество.
Токсичность достаточно привычна для ингибиторов тирозинкиназ. У кабозантиниба и сунитиниба отличия незначительны, даже при оценке НЯ 3-й степени тяжести. Все эти эффекты уже нашли отражение в сегодняшних рекомендациях. Мы видим, что кабозантиниб рекомендован всеми международными организациями для терапии второй линии, тогда как сунитиниб − только после цитокинов у пациентов с метастатическим раком почки.
И последний ингибитор тирозинкиназ – это пазопаниб, у которого есть прямое сравнение с сунитинибом (исследование COMPARZ). В него включались пациенты с метастатическим распространенным почечно-клеточным раком, с отсутствием предшествующей системной терапии, то есть сравнение проводилось в первой линии. Первичной точкой была ВБП. Также оценивались ОВ, частота ответов, безопасность и качество жизни. Препараты продемонстрировали одинаковую онкологическую эффективность как по ВБП, так и по ОВ. Кривые практически не разошлись.
Таким образом, эффективность обоих препаратов одинакова. При большом метаанализе использования ингибиторов тирозинкиназ у больных с метастатическим раком почки в первой линии было продемонстрировано абсолютное преимущество по ВБП и ОВ в пользу кабозантиниба по сравнению со всеми ингибиторами тирозинкиназ, такими как сунитиниб, пазопаниб и сорафениб. Таким образом, кабозантиниб обеспечивает значительно более длительную ВБП по сравнению с другими ингибиторами тирозинкиназ и численно более длительную ОВ.
Это нашло отражение в рекомендациях и в отношении пазопаниба. Его применение возможно только во второй линии после цитокинов. Но при этом нет убедительных исследований, демонстрирующих применение пазопаниба во второй линии терапии после ингибиторов тирозинкиназ, кроме ретроспективных и исследований II фазы.
При этом если посмотреть ВБП, то она достаточно низкая. В частности, в исследовании SWITCH II подобных больных (с чередованием сорафениб + пазопаниб) было 106, ВБП на данной комбинации составила три месяца, что не достоверно отличалось от показателя при обратной комбинации. По европейским рекомендациям, применение пазопаниба во второй линии возможно только после терапии цитокинами. В исследовании RELACS собраны данные клинической практики в Австрии. Оно продемонстрировало, что ВБП в комбинации «сунитиниб + пазопаниб» и наоборот была худшей по сравнению с другими комбинациями как с ингибиторами mTOR, так и с акситинибом.
Таким образом, применение пазопаниба также имеет худшую эффективность по сравнению с кабозантинибом. Это нашло отражение в сегодняшних российских рекомендациях. Кабозантиниб может использоваться в первой линии как альтернативный режим при плохом и промежуточном прогнозе. И основное место этого препарата – во второй линии терапии после ингибиторов тирозинкиназ.
Кабозантиниб и современные представители ТКИ: данные клинических исследований и место в рекомендациях
Докладчик сравнил кабозантиниб и новые препараты ингибиторов тирозинкиназы. Это достаточно условное деление на старые и новые препараты, сказал Алексеев, но тем не менее два препарата (акситиниб, ленватиниб) относятся к семейству мультикиназных, высокоселективных ингибиторов тирозинкиназы нового поколения.
Акситиниб был зарегистрирован первым. Исследовали эффективность лечения препаратом в протоколе AXIS. В него включали больных с метастатическим почечно-клеточным раком, которые уже получили первую линию терапии и прогрессировали. Им в качестве препарата первой линии терапии допускалось использование как сунитиниба, так и комбинации (бевацизумаба и интерферонов), темсиролимуса и цитокинов. Рандомизировали больных на две группы. В одной группе больные получали акситиниб в дозе 5 мг два раза в день, с возможностью эскалации дозы под контролем артериальной гипертензии. (У акситиниба такая опция предусмотрена – эскалация дозы.) В контрольной группе пациенты получали сорафениб в стандартной дозировке 400 мг два раза в день.
Первичная конечная точка исследования – ВБП. А вторичные – ОВ, частота ответа, безопасность и качество жизни. Каких больных включали в это исследование? По классификации MSKCC, примерно равное число больных было в группах благоприятного, промежуточного и плохого прогнозов. По классификации IMDC, которая как раз и разработана для больных, получающих таргетную терапию, только 10% пациентов были в группе плохого прогноза, большая часть (62–65%) – в группе промежуточного и чуть менее 20% − в группе хорошего прогноза. В первой линии терапии ингибитор тирозинкиназы (сунитиниб) получили только 54% больных в каждой группе, по 35% пациентов получили цитокины, 8% − бевацизумаб, интерфероны и 3% − темсиролимус. То есть популяция пациентов была очень неоднородная по агенту, который назначался в первой линии терапии.
В этом протоколе акситиниб по сравнению с сорафенибом продемонстрировал увеличение статистически достоверной медианы ВБП на два месяца. Однако ОВ не отличалась.
Но первичной точкой исследования была ВБП. И на этом основании препарат был зарегистрирован. Надо сказать, что акситиниб существенно выиграл у сорафениба по частоте объективных ответов: у акситиниба в два раза чаще (19,4%) наблюдался объективный ответ по сравнению с сорафенибом. Что касается переносимости, то примерно одинаковый спектр побочных эффектов и нежелательных явлений был у акситиниба и сорафениба. Хотя частота нежелательных явлений была несколько выше при применении акситиниба. Наиболее характерные – диарея, гипертензия, астенизация и желудочно-кишечные расстройства. Для акситиниба больше были выражены гипертензия, астенизация, диарея, а для сорафениба – ладонно-подошвенный синдром. Если посмотреть на подгруппы больных в зависимости от того, что пациенты получали в первой линии терапии, то видно, что наибольший выигрыш от акситиниба по сравнению с сорафенибом у пациентов, которым назначили в первой линии цитокины. Медиана периода до прогрессии была в два раза больше у больных, которые получали акситиниб после цитокинов, чем у тех, которые получали после цитокинов сорафениб. А вот если взять больных, в первой линии получавших сунитиниб, то различия не такие значимые. Они статистически достоверные, но всего лишь 1,4 месяца – различие в медиане ВБП в пользу акситиниба.
Опять же ОВ не отличалась ни в группе больных, которые в первой линии получали сунитиниб, ни в группе пациентов, которые в первой линии получали цитокины.
Интересно, что если пациенты отвечали на терапию сунитинибом первой линии, то сорафениб у них работал лучше, чем акситиниб. Если они не отвечали на сунитиниб, то акситиниб работал лучше по ВБП. Да и по ОВ та же тенденция: сорафениб давал показания лучшей выживаемости, если пациенты отвечали на терапию первой линии.
Акситиниб был зарегистрирован после исследования AXIS, потому что первичная точка увеличения ВПБ была достигнута во всех странах в качестве второй линии терапии после прогрессирования на фоне сунитиниба или цитокиновой иммунотерапии.
Какой выигрыш и какой проигрыш имеет акситиниб по сравнению с кабозантинибом? В сравнительном анализе исследований III фазы кабозантиниб имеет преимущество перед всеми другими препаратами, которые рассматривались в исследованиях III фазы. Но наибольшее преимущество, конечно, он имеет перед плацебо и сорафенибом. А перед акситинибом он имеет преимущество даже большее, чем перед эверолимусом. Понятно, что прямые сравнения рандомизированных исследований не всегда корректны, потому что, хотя дизайн исследования одинаковый, все равно популяция пациентов несколько разнородна и прогностически может быть непохожей. Но тем не менее преимущество кабозантиниба перед акситинибом существенно и даже более значительно, чем перед эверолимусом. С эверолимусом кабозантиниб сравнивался непосредственно.
Если мы посмотрим, как работали эти препараты после сунитиниба, наиболее часто применяемого ингибитора тирозинкиназы в первой линии терапии, то акситиниб давал медиану ВБП всего лишь 4,8 месяца, а кабозантиниб – 9,1 месяца. То есть преимущество было почти в два раза.
Контроль над заболеванием, то есть частота объективного ответа и стабилизации, был также выше с кабозантинибом в исследовании METEOR по сравнению с акситинибом в исследовании AXIS. Однако ввиду токсичности лечения несколько чаще отменяли кабозантиниб (13%). Для сравнения: акситиниб – 8%. Но учитывая, что кабозан тиниб показал преимущество не только в ВБП, но и в ОВ, он с наивысшим уровнем доказательности сегодня рекомендуется как препарат выбора для второй линии терапии и Европейским обществом онкологов, и Европейской ассоциацией урологов, и NCCN, и нашими отечественными рекомендациями. В то время как акситиниб, который показал только увеличение ВБП, но не изменил ОВ, рекомендован как альтернативный режим во второй линии терапии.
Отечественные рекомендации сформулированы так: во второй линии терапии препаратами выбора являются кабозантиниб и ниволумаб, а возможными опциями, альтернативными схемами лечения – акситиниб и комбинация ленватиниба с эверолимусом. Комбинация пришла в нашу практику несколько позже и особым путем, потому что III фазы исследования не было. Зарегистрирована комбинация по результатам исследования II фазы, которая включала всего 153 человека, в каждой группе – 51 человек. Такая регистрация нечасто бывает, но комбинация показала действительно впечатляющие результаты в отношении медианы ВБП, она составила 14,6 месяца. На тот момент это был самый высокий показатель не только во второй, но и в первой линии. Но, конечно, полностью экстраполировать результаты лечения 51 пациента на данные, полученные в крупных рандомизированных исследованиях III фазы, некорректно.
Кроме того, медиана ОВ в отличие от ВБП при назначении ленватиниба с эверолимусом по сравнению с другими препаратами не увеличивается. Она была 25,5 месяца. Кстати, это была вторичная точка. В том же протоколе проводились оценки исследователей и независимых экспертов. По подсчетам вторых, медиана ВБП была меньше на два месяца, чем у исследователей, и частота объективных ответов на 8% меньше. То есть оценка была несколько завышена исследователями, что неудивительно для протокола II фазы.
Надо сказать, что комбинация ленватиниба с эверолимусом обладает наибольшей токсичностью из всех методов лечения метастатического рака почки, потому что здесь на спектр токсичности, свойственный ингибиторам тирозинкиназ, накладываются еще НЯ, присущие эверолимусу. Наиболее частые НЯ у больных на лечении комбинацией – диарея, астенизация, желудочно-кишечные проявления, артериальная гипертензия, метаболические нарушения, анемия, стоматит, потеря веса.
Если сравнить исследование, в котором изучали комбинацию ленватиниба с эверолимусом, и данные исследования METEOR, то видно, что лечение кабозантинибом несколько дольше, чем лечение ленватинибом с эверолимусом.
Частота всех нежелательных явлений была одинакова, 3-я и 4-я степени НЯ тоже сравнимы. Но серьезные нежелательные явления чаще все-таки наблюдались при применении комбинации ленватиниба с эверолимусом. И отмена терапии вследствие токсичности при применении комбинации происходила в два раза чаще по сравнению с больными, которые получали кабозантиниб. В большинстве случаев приходится снижать дозу ленватиниба. В 71% случаев потребовалось снижение дозы ленватиниба и в 62% – снижение дозы кабозантиниба. Поэтому эта комбинация тоже относится к альтернативным схемам в тех случаях, когда по каким-то причинам мы не можем назначить кабозантиниб, ниволумаб. Современные отечественные рекомендации об этом и говорят.
Итог симпозиума подвел В.Б. Матвеев. Рекомендации зарубежных профессиональных ассоциаций говорят, что кабозантиниб является одним из предпочтительных режимов у пациентов во второй линии терапии метастатического рака почки по сравнению с акситинибом и комбинацией «ленватиниб + эверолимус», которые рекомендованы как альтернативные режимы. Также во второй линии терапии можно назначить ниволумаб. Здесь степень доказательности одинакова. А другие препараты (эверолимус, пазо паниб, сунитиниб) могут применяться в качестве второй линии терапии у каких-то отдельных пациентов.
Рекомендации российские таковы: после антиангиогенной терапии также рекомендуется назначение ниволумаба либо кабозантиниба. Ленватиниб с эверолимусом и акситиниб остаются альтернативными режимами, а ингибиторы mTOR эверолимус, сунитиниб, пазопаниб существуют только как опции для отдельных пациентов.
Кабозантиниб позволяет, с одной стороны, преодолеть резистентность первой линии терапии, в которой использовались ингибиторы тирозинкиназ, с другой стороны, увеличить выживаемость пациентов с минимальным числом нежелательных явлений и вполне контролируемой токсичностью. Это универсальный препарат второй линии терапии. НОП [2030]