Что такое дистрофия стромы
Дистрофии роговицы глаза
Дистрофии роговицы представляют собой большую группу наследственных заболеваний роговой оболочки, которые приводят к снижению ее прозрачности (помутнению). Как правило, заболевание поражает оба глаза, оно неизменно прогрессирует, при этом признаки воспаления могут отсутствовать. Чаще всего дистрофия роговицы диагностируется у пациентов в возрасте от 9 до 40 лет.
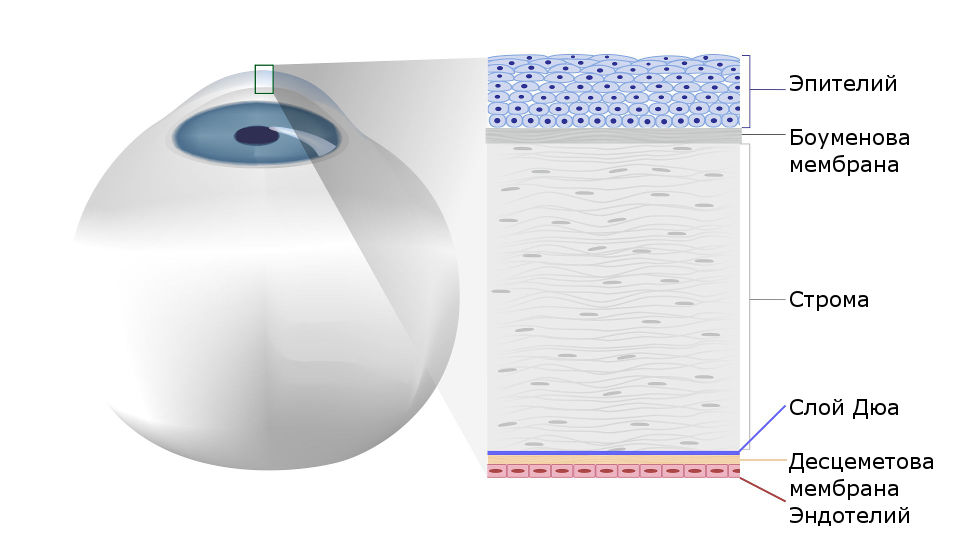
Строение роговицы
Рис.1 Строение роговицы глаза человека
Под боуменовой оболочкой находится строма (ее объем составляет до 95% объема всей роговицы). Строму составляют особые клетки – кератоциты, расположенные в строгом порядке, благодаря чему обеспечивается прозрачность роговой оболочки.
Самая прочная ткань роговой оболочки, прилегающая к строме – десцеметовая оболочка – представляет собой плотную мембрану, также выполняющую защитную функцию.
Виды дистрофий
В зависимости от расположения в структуре роговицы врожденного повреждения дистрофии роговицы могут быть следующими:
Несмотря на то, что дистрофии роговицы представлены множеством видов, все они имеют подобные симптомы и требуют подобных методов лечения. Основное их отличие заключается в закладке каждой конкретной дистрофии в определенном гене человека, что можно определить только путем проведения сложного генетического анализа. Некоторые отличия офтальмолог может определить с помощью микроскопа.
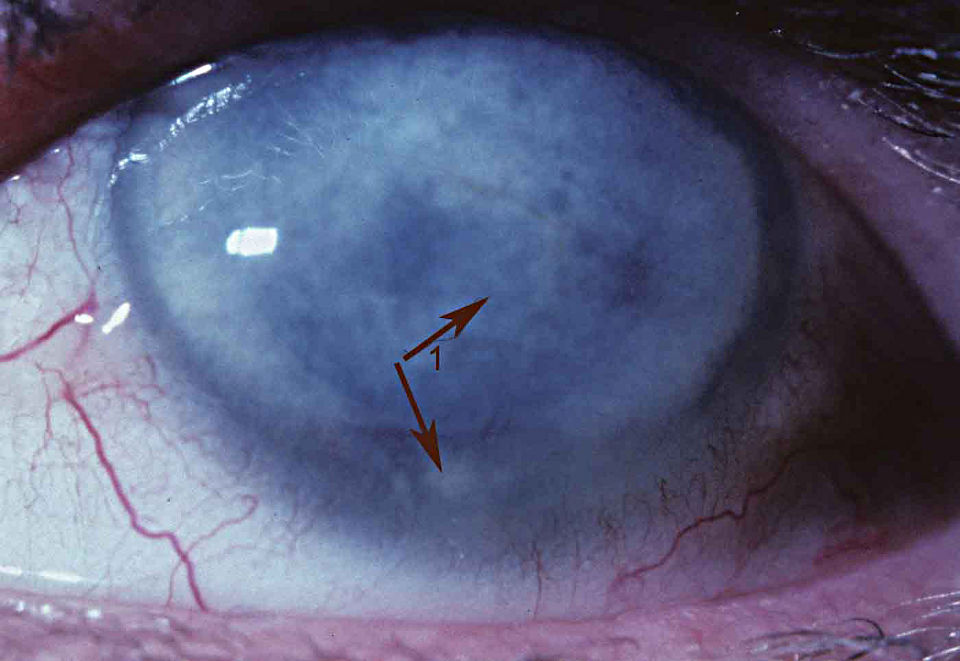
Симптомы (признаки)
Рис.3 Эндотелиальная (задняя) дистрофия роговицы (вид в щелевой лампе)
Все виды дистрофий роговицы сопровождаются снижением зрения. Его ухудшение обусловлено отеком роговицы и ее помутнением, что связано с отложением различных продуктов клеточного метаболизма: холестерина, белковых и жировых соединений. Чем больше выражен отек и нарушена прозрачность ткани роговицы, тем сильнее снижается зрение.
Диагностика заболевания
Для установления диагноза «дистрофия роговицы» требуется тщательное обследование. Офтальмолог выясняет, когда возникли первые симптомы заболевания, существуют ли те или иные провоцирующие факторы, действие которых могло привести к возникновению патологии. Наиболее информативным исследованием для определения вида дистрофии роговицы является осмотр с помощью биомикроскопа.
Консервативное лечение дистрофии роговицы
При эрозиях роговицы, особенно при их частом повторении, пациентам назначается медикаментозное лечение: прием препаратов, действие которых направлено на восстановление эпителия роговицы – кератопротекторов: глазных мазей и капель, способствующих увлажнению поверхности роговицы. Применение глазных капель целесообразно в дневное время, глазных мазей – в ночное, т.к. они обладают наиболее пролонгированным действием.
В терапевтических целях пациентам может быть также рекомендовано ношение мягких лечебных контактных линз, снимающих болевой синдром, устраняющих ощущение инородного тела и создающих благоприятные условия, способствующие восстановлению эпителиального слоя роговицы.
Хирургическое лечение дистрофии роговицы
Наиболее эффективным методом лечения дистрофии роговицы считается хирургическая коррекция. При повреждении эпителиального слоя либо мембраны Боумена может использоваться лазерная хирургия, направленная на удаление участка дистрофии (ФТК – фототерапевтическая кератэктомия).
В профилактических целях, для «укрепления» структуры роговой оболочки, рекомендуют процедуру коллагенового кросслинкинга, если имеют место патологические процессы в строме.
При повреждении более глубоких слоев необходимо проведение операции – кератопластики с удалением поврежденного слоя ткани роговицы и пересадкой на его место донорской ткани.
Проводят два вида хирургических вмешательств:
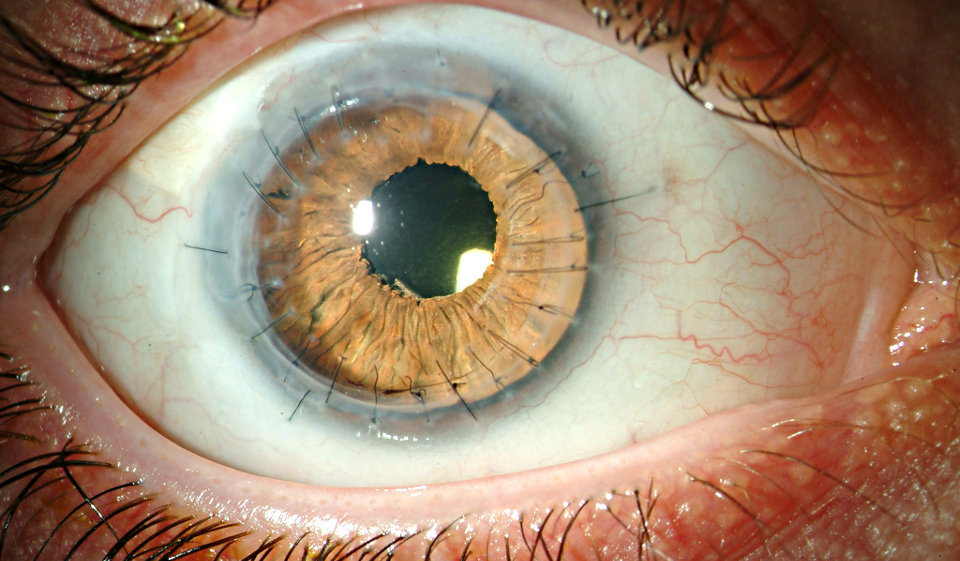
Рис.4 Глаз пациента через 6 мес. после операции сквозной кератопласстики
После пересадки донорской роговицы ее клетки начинают функционировать вместо собственных поврежденных, благодаря чему восстанавливается прозрачность роговицы и устраняются симптомы заболевания. В некоторых случаях при возникновении рецидива может потребоваться проведение повторной операции.
В нашем офтальмологическом центре у пациентов есть возможность получить высокотехнологичную офтальмологическую помощь мирового уровня: у врачей из Германии по 100% немецким технологиям!
Помимо сквозной кератопластики и фототерапевтической кератэктомии мы проводим уникальные операции послойной передней и задней пересадки роговицы, в том числе и с фемтосекундным сопровождением:
Стоимость операций
С расценками на различные виды хирургического лечения эпителиальных и эндотелиальных дистрофий роговой оболочки глаза Вы можете ознакомиться в нашем разделе ЦЕНЫ.
Дистрофии сетчатки
Термин дистрофия с латыни переводится как «расстройство питания тканей». В основе дистрофических процессов любой локализации лежит нарушение метаболических процессов на клеточном уровне, которое приводит к появлению сначала структурных изменений, а затем и к функциональной недостаточности.
Дистрофия сетчатки – это сложная патология сетчатой оболочки глаза, которая приводит к стойкому ухудшению остроты зрения. Причиной ее появления является комплекс факторов, которые условно можно разделить на внешние (экзогенные) и внутренние (эндогенные). Непосредственной причиной появления дистрофии сетчатки являются сосудистые нарушения, запускающие каскад патологических реакций, в итоге приводящих к выраженному снижению зрения. Длительное время болезнь остается совершенно незаметной и обнаруживается зачастую уже при развитии осложнений.
В лечении большинства болезней глаз время их обнаружения имеет решающее значение, ведь чем раньше начато адекватное лечение, тем лучше прогноз с точки зрения сохранения зрения. Не лишайте себя возможности хорошо видеть, ежегодно проходите обследование глаз, даже если вам кажется, что симптомов болезней глаз у вас нет! Простая, быстрая и недорогая процедура осмотра глаз у офтальмолога поможет сберечь зрение на долгие годы!
Причины появления дистрофии сетчатки
Довольно часто дистрофии сетчатки генетически обусловлены, но есть ряд факторов, которые повышают вероятность развития болезни. К ним относятся:
Как проявляется дистрофия сетчатки
Общим симптомом для любой формы дистрофии является прогрессирующее ухудшение зрения, а также нарушение полей зрения. При осмотре глаз могут быть выявлены скотомы (участки выпадения зрения), искажение видимого изображения предметов, ухудшение ориентации в сумерках и в условии ограниченной освещенности. Больной с дистрофией сетчатки может заметить искривление прямых линий, непрозрачные пятна в поле зрения, выпадение букв во время чтения, изменение цветовосприятия.
На ранней стадии дистрофии сетчатки могут не вызывать никаких неприятных ощущений. Поэтому если вы или ваши родственники находитесь в группе риска, не игнорируйте ежегодный осмотр у квалифицированного офтальмолога.
Какие бывают дистрофии сетчатки
Дистрофия сетчатки – сборное понятие, которое объединяет разные по природе и проявлениям патологии сетчатой оболочки глаза. По своей природе дистрофии сетчатки разделяются на первичные, наследственно обусловленные, и вторичные, приобретенные, вызванные общими заболеваниями организма.
Первичные дистрофии сетчатки – это множество различных патологий, передающихся по наследству. Обычно они проявляются в детском возрасте и вызывают стойкое прогрессирующее снижение зрения, со временем приводящее к слепоте. Примером первичных дистрофий сетчатки являются амавроз Лебера, пигментная дистрофия сетчатки, болезнь Вагнера, дистрофия Беста, болезнь Штаргардта, точечно-белая дистрофия сетчатки.
Вторичные (приобретенные) дистрофии, в зависимости от преимущественной области поражения сетчатки, разделяют на центральные и периферические.
Центральные дистрофии сетчатки
Поскольку при этой форме дистрофии сетчатки поражается область макулы (желтого пятна, центральной ямки сетчатки), заболевание также называют макулодистрофией. Желтое пятно, или макула – это область сетчатки, отвечающая за наилучшую остроту зрения и различие мелких деталей изображения. При поражении этой области страдает центральное зрение, а периферическое зрение остается неизменным. Человеку с центральной дистрофией сетчатки сложно читать, водить машину, рисовать, писать, вышивать и т.п.
В молодом возрасте центральная дистрофия сетчатки нередко выявляется при миопии, в пожилом возрасте диагностируют возрастную макулодистрофию. Своевременное выявление и регулярная терапия позволяют остановить прогрессирование симптомов заболевания и сохранить зрение на долгие годы.
Периферические дистрофии сетчатки
В этом случае изменения обнаруживаются на периферии сетчатки, то есть в тех ее областях, которые не принимают участия в формировании четкого зрения. Периферические ретинальные дистрофии, как правило, не сопровождаются отчетливым ухудшением зрения, но повышают риск развития тяжелых патологий глаз, таких как отслойка сетчатки.
Периферические дистрофии различной степени выраженности диагностируются у большинства близоруких людей. Поэтому если вы носите очки или линзы, обязательно проходите ежегодный осмотр глазного дна у офтальмолога. В случае, если доктор обнаружит участки истончения или разрывов сетчатки, вам будет предложена ограничительная лазерная коагуляция сетчатки.
Лечение дистрофии сетчатки
Своевременно начатое лечение дистрофии сетчатки помогает улучшить остроту зрения, остановить прогрессирование патологических изменений в тканях глаза и предотвратить появление грозных осложнений.
Для лечения дистрофий сетчатки применяют комплексный подход. Ввиду того, что большинство случаев заболевания носит наследственный характер, лечение болезни их симптоматическое, направленное на поддержание достаточной остроты зрения.
Медикаментозное лечение включает применение лекарственных препаратов с различным механизмом действия, цель которого – улучшение питания тканей сетчатки. Обычно применяют сосудорасширяющие препараты (но-шпа, папаверин), дезагреганты (аспирин, клопидогрель), комплексные витаминные препараты, укрепляющие стенки сосудов сетчатки (аскорутин, препараты с лютеином), биогенные стимуляторы и пептиды (ретиналамин, экстракт алоэ). При обнаружении экссудативной формы ВМД показаны интравитреальные инъекции препаратов из группы блокаторов неоангиогенеза (anti-VEGF препараты), дексаметазона, рассасывающих препаратов (гепарин, этамзилат).
Физиотерапевтическое лечение при дистрофии сетчатки включает магнитотерапию, лазерную стимуляцию сетчатки, электрофорез с лекарственными препаратами, улучшающими питание тканей (но-шпа, никотиновая кислота и пр.).
Наиболее эффективным методом лечения у пациентов с дистрофиями сетчатки является лазерная коагуляция (фотокоагуляция) сетчатки. Цель такого лечения – отграничение измененных областей сетчатки от окружающих их здоровых тканей для предотвращения прогрессирования болезни и развития возможных осложнений. Местное воздействие лазерных лучей повышает температуру в области обработки и вызывает ограниченную коагуляцию тканей и образование прочных сращений между сетчаткой и прилежащей к ней сосудистой оболочкой.
Хирургическое лечение показано при выявлении грубых сращений (шварт) между сетчаткой и стекловидным телом глаза, а также неоваскулярных мембран. С этой целью применяют витреоретинальные операции (витрэктомия, склеропломбаж, экстрасклеральное пломбирование и пр.).
Цены на лечение дистрофии сетчатки
Стоимость лечения при дистрофии сетчатки зависит от вида манипуляции (медикаментозное, лазерное, хирургическое) и объёма вмешательства, необходимости применения дополнительных расходных материалов и общей анестезии. Поэтому точная стоимость лечения может быть названа только после очной консультации со специалистом. Узнать стоимость основных процедур и операций вы можете в разделе ЦЕНЫ.
Что такое мышечная дистрофия
Мышечная дистрофия – это целый класс наследственных заболеваний, которые со временем приводят к ослаблению мышц тела. Сегодня болезнь неизлечима. Но некоторые физические и медицинские процедуры способны замедлить прогрессирование и улучшить состояние больного. При подозрении на наличие болезни рекомендуется обратиться к неврологу.
Формы мышечной дистрофии
Мышечная дистрофия характеризуется прогрессирующей симметричной атрофией мышц. Болезнь во всех ее формах и проявлениях протекает долго. Слабость мышц в этом случае обусловлена отсутствием важного белка – дистрофина. Он важен для человека, так как соединяет скелет мышечных волокон с внеклеточным матриксом.
Отсутствие дистрофина вызывает постоянную усталость, нарушения походки, проблемы с глотанием и координацией движений. Всего существует более 30 форм заболевания. Они отличаются характером, степенью тяжести, симптоматикой.
9 самых распространенных из них:
Примечательно, что это наследственное заболевание, которое может проявиться в любом возрасте. Чаще всего первые симптомы обнаруживаются на профилактических осмотрах у специалистов еще в раннем детстве. По статистике от патологии чаще страдают мальчики, чем девочки.
Прогноз для таких пациентов зависит от многих факторов. Кто-то живет с болезнью годами, лишь поддерживая свое состояние и замедляя прогрессирование атрофии мышц. Другие же быстро теряют способность вести привычный образ жизни, не могут самостоятельно ходить и часто нуждаются в инвалидном кресле.
Симптомы и причины мышечной дистрофии
Причины мышечной дистрофии кроются в хромосомной мутации. Поражается Х-хромосома, но каждая форма заболевания имеет свои особенности и характеризуется уникальным набором мутировавших генов. При этом все они способствуют снижению или же полному прекращению синтеза дистрофина – белка, необходимого мышцам для нормального функционирования.
Именно этот белок отвечает за их рост и восстановление, хотя его содержание очень мало – всего 0,002 % от общего количества белков в мышцах. Чем меньше количество дистрофина, тем больше прогрессирует болезнь и выражена симптоматика.
Среди основных симптомов, сопровождающих все формы патологии, стоит отметить такие признаки:
Если вы обнаружили у себя перечисленные выше симптому, записывайтесь на прием к неврологу в медицинский центр «Юнона».
Диагностика и лечение
При наличии симптоматики мышечной дистрофии больного отправляют на прием к врачу-неврологу. Специалист именно этого профиля подбирает способы и методы диагностики болезни, схему поддерживающей и восстанавливающей терапии.
Помимо личной беседы и изучения анамнеза, могут потребоваться такие диагностические мероприятия:
Кроме того, может потребоваться сдача анализа крови, мочи, аппаратное сканирование с целью исключить другие заболевания со схожей симптоматикой.
На сегодняшний день нет эффективных методов лечения этого заболевания. Невролог и другие специалисты помогут подобрать методы и процедуры, которые замедлят прогрессирования болезни, но не устранят ее полностью. Лечение подбирается симптоматическое. Оно может включать в себя:
Кроме того, могут потребоваться медицинские процедуры, в том числе операции на сердце и позвоночнике, вспомогательная вентиляция легких. А физиотерапия и ЛФК помогут укрепить мышцы конечностей, сохранить как можно дольше возможность ходить и двигаться.
Дистрофия роговицы: причины и лечение
Дистрофия роговицы — прогрессирующее офтальмологическое заболевание, суть которого заключается в повреждении внешнего слоя оболочки глаза. Даже при незначительных размерах патологического очага появляются проблемы со зрением: изображение в поле видимости становится мутным и нечетким. Особенность аномалии состоит в том, что она обнаруживается на обоих глазах, и в ряде случаев врачам не удается установить первопричину деструктивного процесса. Если вовремя не обратить внимание на болезнь и не начать лечение дистрофии роговицы, существует риск утраты зрения.
Классификация заболевания
Официальная классификация выделяет несколько разновидностей дистрофии роговицы в зависимости от особенностей ее возникновения и развития. По причинам появления заболевание делят на первичное и вторичное. Первичные формы дистрофии имеют генетические корни и относятся к категории наследуемых аномалий.
Важно! Несмотря на то, что предрасположенность к ухудшению прозрачности роговицы имеется с рождения, манифестация происходит в зрелом возрасте. Большая часть пациентов с таким диагнозом — люди старше 40 лет.
Вторичные дистрофические заболевания роговицы являются следствием перенесенного ранее офтальмологического недуга: инфекции, воспаления, травмы глазного яблока. Они также могут иметь ятрогенную природу, то есть развиваться после перенесенного хирургического вмешательства на глазах.
В зависимости от локализации патологического очага офтальмологи выделяют следующие виды дистрофии роговицы:
Независимо от формы и природы клиника дистрофической аномалии роговой оболочки всегда одинакова за небольшими исключениями.
Основные симптомы
Дистрофия роговицы начинает достаточно быстро проявляться симптоматически: даже при незначительном размере очага пациент ощущает дискомфорт в глазах, напоминающий усталость от долгого чтения книги с мелким шрифтом, и постепенно нарастающий «туман» в поле зрения. По мере прогрессирования заболевания к этим симптомам присоединяются:
Описанные симптомы обнаруживаются в разных сочетаниях, а интенсивность зависит от индивидуальных особенностей и вида патологии. Так, наиболее тяжелой симптоматикой отличается эндотелиальная дистрофия роговицы, в то время как краевая клинически не проявляет себя до момента перфорации роговой оболочки.
Диагностика
По симптоматике дистрофия роговицы не отличается от других офтальмологических заболеваний. Внешне она похожа на конъюнктивит, кератит и прочие воспалительные процессы: они тоже сопровождаются физическим дискомфортом и снижением остроты зрения. Для более точной диагностики, помимо внешнего осмотра и сбора анамнеза, используются дополнительные методы:
Этих методов бывает достаточно, чтобы подтвердить диагноз, установить вид патологии и определить степень ее развития.
Лечение дистрофии роговицы
Для лечения дистрофии роговицы используются консервативные и хирургические методы. В первом случае терапия направлена на замедление прогрессирования болезни, а во втором возможно полное устранение дистрофии роговицы.
Важно! Дистрофические изменения в оболочке глаза часто имеют необратимый характер, а причины появления дефектов не поддаются ликвидации. Поэтому даже радикальные способы лечения патологии могут дать временный результат.
Медикаментозное лечение
При неосложненном течении и отсутствии признаков стремительного прогрессирования патологию лечат с помощью лекарств местного и системного действия. К местным препаратам относятся:
Для уменьшения проявлений и более качественной защиты поверхности глаз от дополнительного травмирования и проникновения инфекций используются мягкие контактные линзы в сочетании с мазями и гелями.
Наряду с ними применяются препараты системного действия: инъекции экстракта алоэ, лидазы и стекловидного тела, витаминно-минеральные комплексы в форме таблеток и капель, отдельные виды витаминов внутримышечно.
Хирургическая операции
Кератопластика — радикальный способ, с помощью которого дистрофия роговицы устраняется полностью. В процессе операции врач послойно удаляет поврежденные участки роговой оболочки, а затем устанавливает на обработанные места донорский или искусственный материал.
В случае если повреждения поверхностные, для лечения дистрофии роговицы используют лазер. Им врач послойно «выпаривает» патологические ткани, на месте которых образуются новые слои.
Прогноз и возможные осложнения
Прогнозы при дистрофических изменениях роговицы зависят от того, как рано будет обнаружен дефект. Современная медицина располагает средствами для сохранения зрения при таком недуге, однако гарантий 100% избавления от него не существует, особенно если у болезни генетическая природа.
Что такое дистрофия стромы
1. Эндотелиальная дистрофия роговицы Фукса — К1, К2, К3.
2. Задняя полиморфная дистрофия роговицы — К1 или К2.
3. Врожденная эндотелиальная дистрофия — К1.
4. X-связанная эндотелиальная дистрофия роговицы — К2.
Далее приводятся данные о наиболее распространенных в офтальмологической практике и клинически значимых дистрофиях роговицы.
Дистрофия эпителиальной базальной мембраны (ДЭБМ) — одна из часто встречающихся дистрофий. Хотя она включена в представленную классификацию и поражает один слой роговицы, что типично для дистрофических поражений, только небольшое число случаев имеет доказанное наследование — ген TGFBI (transforming growth factor beta—induced), локус 5q31 [7, 11]. В большинстве наблюдений состояние считают специфической реакцией роговицы на внешние воздействия, т. е. дегенерацией, которая обусловлена аномальным восстановлением, созреванием и формированием базальной мембраны, приводящим к образованию патологических комплексов адгезии и ослабленному прикреплению эпителия к строме [7, 12]. Дистрофия встречается у 2% в популяции, чаще у женщин. При биомикроскопии в эпителиальном слое роговицы выявляются сероватые включения, тонкие линии, микрокисты. Эти образования формируют различные типы рисунка в субэпителиальном слое — точечные и микрокистные изменения, географический рисунок, рисунок «отпечатка пальца», «булыжной мостовой» (рис. 1). 
Дистрофия Рейс—Буклера — аутосомно-доминантная (ген TGFBI, локус 5q31), билатеральная, центральная дистрофия роговицы с первичным поражением боуменового слоя, начальные признаки которой появляются в первые годы жизни в виде поверхностных линейных и кольцевидных сероватых помутнений, сопровождающихся рецидивирующими эрозиями с выраженным болевым компонентом. К 20—30 годам помутнения прогрессируют, сливаются между собой, сохраняя характерный географический рисунок, распространяясь на среднюю периферию и глубже в строму, развивается диффузное стромальное неинтенсивное помутнение (хейз) [15, 16]. Частота эрозий с возрастом заметно уменьшается, ухудшается острота зрения из-за прогрессирования помутнений и неправильного астигматизма. Снижение остроты зрения при этой дистрофии более выражено, чем при сходной дистрофии Тиля—Бенке, из-за большего нарушения регулярности передней поверхности роговой оболочки глаза [7, 17]. При гистологическом исследовании видно, что эпителиальный слой теряет регулярную архитектонику, местами утолщен, повторяет измененный рельеф подлежащей соединительной ткани. Местами отсутствует базальная мембрана эпителия. Боуменов слой замещается листовидной фиброцеллюлярной соединительной тканью с зернистыми отложениями, которая в развитой стадии заболевания распространяется в передние слои стромы [7, 17, 18].
Для стромальных и ряда эпителиально-стромальных дистрофий характерным является отложение патологических веществ между коллагеновыми фибриллами или в кератоцитах. Это могут быть как нормальные метаболиты, представленные в избыточном количестве, как гликозамингликаны при макулярной дистрофии, так и вещества, не встречающиеся в роговой оболочке в норме (амилоид, холестерол, гиалин) [8, 17].
Зернистая дистрофия роговицы, тип 1 (классическая) имеет аутосомно-доминантный тип наследования (ген TGFBI, локус 5q31), билатеральная, симметричная. Заболевание проявляется в первую декаду жизни. Осмотр за щелевой лампой выявляет хорошо видимые гранулы, которые кажутся белыми при прямом освещении. При ретроиллюминации эти гранулы состоят из чрезвычайно мелких, полупрозрачных точек, выглядят как вакуоли, стеклянные осколки или измельченные крошки. Помутнения не захватывают лимбальную зону (рис. 2). 
Зернистая дистрофия роговицы, тип 2, считается комбинированной — зернисто-решетчатой. Также часто именуется дистрофией роговицы Авеллино по местности, где проживала семья, страдавшая таким заболеванием. Имеет аутосомно-доминантный тип наследования (ген TGFBI, локус 5q31). По данным световой микроскопии помутнения роговицы простираются от базального эпителия до глубокой стромы. Помимо типичных для зернистой дистрофии 1-го типа гиалиновых отложений, в строме присутствует амилоид [5]. Заболевание начинается в первой декаде жизни, но выявляется чаще в подростковом возрасте или в ранней зрелости. Начальными признаками дистрофии, которые выявляются под щелевой лампой, считаются поверхностные стромальные крошечные белесые точки. На следующем этапе между поверхностной и средней стромой появляются кольцевидные или в форме снежинки помутнения. У некоторых пациентов в более глубоких слоях также имеют место решетчатые линии. Как правило, эти линии расположены глубже, чем стромальные помутнения в виде снежинок. На заключительном этапе полупрозрачные плоские крошковидные помутнения, расположенные поверхностно, могут сливаться между собой. У некоторых пациентов проявления дистрофии ограничиваются только множеством белых точек. Пациенты с зернистой дистрофией 2-го типа имеют меньше помутнений, чем лица с зернистой дистрофией 1-го типа. Острота зрения уменьшается с возрастом, так как постепенно вовлекается центральная зона. При эрозиях, которые, как правило, не имеют тяжелого течения, возникают болевые ощущения [6, 17, 19]. Заболевание прогрессирует медленно, несколько быстрее при гомозиготной форме.
Решетчатая дистрофия роговицы, тип 1, считается классической решетчатой дистрофией роговицы, имеет аутосомно-доминантный тип наследования (ген TGFBI, локус 5q31). При гистологическом исследовании выявляются отложения амилоидного вещества в строме, которые нарушают ламеллярную архитектонику роговицы. Также могут отмечаться эпителиальная атрофия и дегенеративные нарушения базальных эпителиальных клеток, очаговое истончение или отсутствие слоя Боумена [5]. При биомикроскопии уже к концу первого десятилетия жизни видны тонкие ветвящиеся, отражающие свет линии и/или субэпителиальные беловатые овальные точки. Линии появляются в центре достаточно поверхностно, распространяясь на периферию и в глубь роговой оболочки глаза, но оставляя периферию, десцеметову мембрану и эндотелий интактными (рис. 3). 
Решетчатая дистрофия роговицы, тип 2, была внесена в первую редакцию современной классификации лишь условно, исключена из второй, не считается дистрофией роговицы как таковой, а является глазным проявлением семейного амилоидоза. Сопровождается краниальной нейропатией, проявляющейся как лицевой парез, бульбарный паралич, периферической полинейропатией. При биомикроскопии изменения сходны с таковыми при типе 1. Чувствительность роговицы снижена или отсутствует. Острота зрения сохраняется достаточно высокой длительное время, так как дистрофия прогрессирует от периферии к центру роговицы. Развивается симптоматика синдрома сухого глаза. В пожилом возрасте могут возникать рецидивирующие эрозии роговицы. Течение заболевания медленно прогрессирующее. У большинства может не быть серьезных нарушений до седьмого десятилетия. Существует повышенный риск открытоугольной глаукомы [6, 7].
Макулярная (пятнистая) дистрофия роговицы. Имеет аутосомно-рецессивный тип наследования, ген CHST6 (сarbohydrate sulfotransferase 6 gene), локус 16q22.
Морфологические изменения связаны с избыточным отложением в строме, эндотелии и десцеметовой мембране внутриклеточно и внеклеточно гликозаминогликанов. Заболевание проявляется в детском возрасте диффузным помутнением стромы, распространяющимся до лимба; позже обнаруживаются поверхностные центральные проминирующие неправильной формы белесые помутнения в виде пятен (рис. 4). 
Дистрофия роговицы Шнайдера имеет аутосомно-доминантный тип наследования, ген UBIAD1 (UbiA prenyltransferase domain containing 1), локус 1p36. Морфологически в базальных клетках эпителия, слое Боумена, строме выявляются аномальные отложения внутри- и внеклеточных этерифицированных и неэтерифицированных фосфолипидов и холестерина [8, 17]. Диагноз ставится обычно во втором или третьем десятилетии при кристаллической форме (рис. 5), 
Эндотелиальная дистрофия роговицы Фукса (ЭДРФ) — одна из часто встречающихся дистрофий [4, 23]. Наследование в большинстве случаев проследить не удается. При ранней форме выделен ген COL8A2, локус 1p34.3—p32, при поздней — найдена ассоциация с различными локусами — 13pter-q12.13 (ЭДРФ2), 18q21.2-q21.3 (ЭДРФ3), 20p13-p12 (ЭДРФ4), 5q33.1-q35.2 (ЭДРФ5), 10p11.2 (ЭДРФ6), 9p24.1-p22.1 (ЭДРФ7) и 15q25 (ЭДРФ8) [7]. При световой микроскопии выявляется характерное утолщение десцеметовой мембраны. Патологически измененные эндотелиальные клетки вырабатывают гиалиновые наросты — гутты — на утолщенной десцеметовой мембране. Гутты погружаются в мембрану, сливаются между собой. Часть эндотелиальных клеток гибнет, оставшиеся увеличиваются по площади, теряют гексагональность. При отеке роговицы значительно нарушается ламеллярная архитектоника стромальных волокон [8, 24]. Случаи без явного наследования проявляются на пятом десятке лет. Варианты с ранним началом — на первом—третьем десятилетии [6]. Заболевание в процессе развития проходит стадии от «cornea guttata» до субэпителиального фиброза с васкуляризацией. На стадии «cornea guttata» при биомикроскопии на уровне десцеметовой мембраны просматриваются центральные изменения в виде «битой металлической крошки» или «шагреневой кожи» с или без «напыления» пигмента (рис. 6). 
При задней полиморфной дистрофии (ЗПД) тип наследования аутосомно-доминантный, выявлены различные локусы: для ЗПД1 — 20p11.2-q11.2; ЗПД2 — 1p34.3-p32.3; ЗПД3 — 10p11.22. Ген для ЗПД1 не выделен, для ЗПД2 — COL8A2, ЗПД3 — ZEB1. Морфологически на задней поверхности десцеметовой мембраны выявляются патологические слои коллагена с локальными веретенообразными или узелковыми разрастаниями. Среди эндотелия определяются участки многослойных эпителиоподобных клеток с микроворсинками и десмосомами [8, 24]. Заболевание проявляется часто асимметричными поражениями различной формы в глубоких слоях роговицы, включая узелковые, везикулезные (изолированные, в группах или сливные) и блистероподобные. Помутнения могут иметь вид «железнодорожных путей» и очаговых серых участков на уровне десцеметовой мембраны. Стромальный и эпителиальный отек из-за эндотелиальной декомпенсации развивается редко. Изменения в эндотелии часто не прогрессируют годами. Возможны медленное прогрессирование полиморфных везикул и утолщение десцеметовой мембраны на протяжении многих лет. Периферические иридокорнеальные сращения встречаются в 25% случаев. Примерно в 15% наблюдений уровень внутриглазного давления повышен [26]. Эндотелиальные изменения часто протекают бессимптомно. Редко имеется значительное прогрессирующие снижение остроты зрения в результате стромальных помутнений [6, 24, 27].
Лечение. Эффективной патогенетической терапии на современном этапе развития медицины не существует. Симптоматическое местное лечение направлено на купирование нарушений передней поверхности роговицы и уменьшение ее отека при тех дистрофиях, где он имеет место. Для этого применяются любриканты, препараты, способствующие регенерации, мягкие контактные линзы, гипертонические растворы [12]. Перспективным представляется использование современных инновационных слезозаменителей, одним из представителей которых является катионорм (Santen), созданный по технологии Novasorb на основе катионной эмульсии. Препарат эффективно восстанавливает слезную пленку, во многом воспроизводит физиологию естественной слезы, не содержит консервантов, что позволяет применять его длительное время без побочных эффектов.
Хирургическое лечение может включать абразивные вмешательства на передней поверхности роговицы для улучшения адгезии эпителиального слоя к глубжележащим слоям и отчасти для уменьшения ее иррегулярности. ФТК является эффективным методом при удалении помутнений передних слоев роговой оболочки на фоне поверхностных и некоторых видов стромальных дистрофий. Кроме того, при выполнении ФТК удается устранить иррегулярный астигматизм и улучшить адгезию эпителия. При рецидивах заболевания процедуру можно повторять несколько раз. При глубоких помутнениях, существенно снижающих остроту зрения, методом выбора является кератопластика. При относительно изолированном поражении слоев роговицы предпочтительными являются модификации послойной кератопластики (передняя послойная, глубокая послойная, эндотелиальная кератопластика). При одновременном вовлечении стромального и эндотелиального слоев целесообразно проводить сквозную кератопластику или ее модификации со сложным профилем операционного разреза. Как и после ФТК, после кератопластики вероятны рецидивы в сроки от 1 года до 20 лет, частота которых и степень снижения зрения зависят от вида дистрофии и могут варьировать индивидуально [8, 28, 29].
Заключение
Дистрофии роговицы — группа медленно прогрессирующих невоспалительных поражений роговицы, большинство из которых отличаются вариабельностью фенотипических проявлений. Описанная в статье новая классификация сочетает в себе аспекты традиционного определения дистрофий роговицы с новыми генетическими, морфологическими и клиническими данными. Важно помнить о существовании подобной патологии и своевременно дифференцировать с острыми воспалительными процессами различной этиологии, которые требуют ургентной терапии. При дистрофиях целесообразное консервативное лечение, связанное, как правило, с нарушениями передней поверхности роговицы, является симптоматическим (любриканты, препараты, способствующие эпителизации, мягкие контактные линзы). Эффективной терапии этиопатогенетической направленности не существует. При значительном снижении остроты зрения возможно выполнение ФТК и различных модификаций кератопластики в зависимости от глубины поражения.
Авторы заявляют об отсутствии конфликта интересов.
Сведения об авторах
Текеева Лейла Юсуфовна — аспирант отдела патологии роговицы