Что такое диффузная лимфоцитарная инфильтрация
Лимфоцитарная инфильтрация Джесснера-Канофа
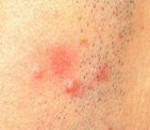
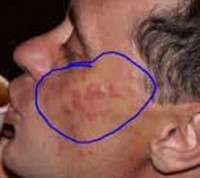
Лимфоцитарная инфильтрация Джесснера-Канофа – редкий хронический дерматоз, характеризующийся доброкачественной инфильтрацией кожи лимфоцитами. Заболевание имеет волнообразное течение, склонно к саморазрешению. Клинически проявляется высыпанием на неизменённой коже плоских гладких синюшно-розовых бляшек или папул, которые сливаются в очаги величиной с ладонь ребенка или взрослого. Первичные элементы имеют чёткие границы, шелушатся. Бляшки обычно единичные, располагаются на лице, шее, туловище, конечностях. Диагностируется клинически с гистологическим подтверждением, иногда проводят молекулярно-биологические исследования. Лечение – НПВС, гормональная терапия, препараты местного действия.
Общие сведения
Лимфоцитарная инфильтрация Джесснера-Канофа – доброкачественная псевдолимфома кожи с хроническим волнообразным рецидивирующим течением. Встречается редко. Чаще возникает у мужчин старше 20 лет. Сезонных, расовых различий не имеет, не эндемична. Иногда наблюдается улучшение в летний период. Впервые данная патология была описана в 1953 году, когда М. Джесснер и Н. Каноф рассмотрели ее как самостоятельное заболевание со сквозной инфильтрацией лимфоцитами всех слоёв дермы. Название «псевдолимфома» в 1965 году ввел К. Мач, объединивший инфильтрацию Джесснера-Канофа в одну группу с другими разновидностями лимфоцитарной инфильтрации.
В 1975 году О. Браун отдифференцировал тип заболевания, отнеся инфильтрацию лимфоцитами к В-клеточным псевдолимфомам, однако позже специалисты стали рассматривать патологию как Т-псевдолимфому. Именно Т-лимфоциты обеспечивают доброкачественное течение патологии и возможность спонтанной инволюции первичных элементов. Дальнейшие исследования показали, что в возникновении и течении лимфоцитарной инфильтрации Джесснера существенную роль играет иммунная система организма. Возможно, это связано с тем, что клетки иммунной системы располагаются в пищеварительном тракте, а он поражается в 70% случаев заболевания. Изучение лимфоцитарной инфильтрации Джесснера-Канофа продолжается и в настоящее время. Понимание причин возникновения и развития Т-лимфоидных процессов имеет большое значение в разработке патогенетического лечения псевдолимфом.
Причины лимфоцитарной инфильтрации
Наиболее вероятными причинами лимфоцитарной инфильтрации Джесснера-Канофа принято считать гиперинсоляцию, укусы клещей, инфекции, патологию желудочно-кишечного тракта, использование дерматогенной косметики и нерациональный приём лекарственных препаратов, провоцирующих системные иммунные нарушения, визуально представленные инфильтративными изменениями в коже. Механизм лимфоцитарной инфильтрации Джесснера-Канофа заключается в следующем: интактный эпидермис даёт Т-лимфоцитам возможность инфильтрировать глубокие слои дермы, располагаясь в сосочковых выростах и вокруг сосудистых сплетений по всей толще кожи. Триггеры заболевания запускают воспаление, на которое реагируют непосредственно клетки кожи и клетки иммунной системы. В процесс купирования воспаления включаются Т-лимфоциты, обеспечивающие доброкачественный ответ иммунной системы в виде пролиферации эпителиальных клеток дермы.
Одновременно в коже развивается банальное воспаление, проходящее три стадии: альтерации, экссудации и пролиферации с участием гистиоцитов – клеток ретикулярной ткани. Гистиоциты группируются и образуют островки, напоминающие лимфоидные фолликулы. На конечном этапе купирования воспаления два параллельных процесса пролиферации дополняют и усиливают друг друга. Так возникает очаг лимфоцитарной инфильтрации. Поскольку лимфоциты гетерогенны, оценка их гистохимических свойств с помощью иммунологических маркеров и моноклональных антител легла в основу иммунофенотипирования. Этот анализ имеет большое диагностическое значение в современной дерматологии.
Симптомы лимфоцитарной инфильтрации
Первичным элементом кожной сыпи при лимфоцитарной инфильтрации Джесснера-Канофа является крупная плоская розово-синюшная бляшка или папула с чёткими границами и гладкой поверхностью, имеющая тенденцию к периферическому росту. Сливаясь между собой, первичные элементы образуют кольцевидные или дугообразные «острова» с участками шелушения. Разрешение высыпавших элементов начинается с центра, поэтому сливные очаги могут иметь западание в центральной части. Типичной локализацией принято считать лицо, шею, околоушное пространство, затылок, лоб, щёки и скулы. Редко высыпания появляются на коже туловища и конечностях. Обычно первичный элемент одиночный, реже наблюдается тенденция к распространению процесса.
Лимфоцитарная инфильтрация Джесснера-Канофа характеризуется волнообразным рецидивирующим течением. Резистентна к проводимой терапии, способна спонтанно саморазрешаться. Рецидивы обычно возникают в местах прежней локализации, но могут захватывать и новые участки кожного покрова. Несмотря на длительное хроническое течение, внутренние органы в процесс не вовлекаются.
Диагностика лимфоцитарной инфильтрации
Заболевание диагностируется дерматологом на основании анамнеза, клиники, гистологии и люминесцентного микроскопирования (типичное свечение на границе дермоэпидермального соединения не определяется) с обязательной консультацией иммунолога и онколога. Гистологически при лимфоцитарной инфильтрации Джесснера-Канофа выявляется неизменённый поверхностный слой кожи. В толще дермальных слоёв обнаруживается группирование лимфоцитов и клеток соединительной ткани вокруг сосудов.
В сложных случаях проводят иммунотипирование опухоли, гистохимическое и молекулярное тестирование. К. Фан с соавторами рекомендуют основывать диагностику на результатах ДНК-цитофлюориметрии с анализом количества нормальных клеток (при лимфоцитарной инфильтрации Джесснера-Канофа более 97%). Дифференциальную диагностику проводят с саркоидозом, системной красной волчанкой, центробежной эритемой Биетта, кольцевидной гранулёмой, группой лимфоцитарных опухолей, токсикодермией и сифилисом.
Лечение лимфоцитарной инфильтрации
Лечение направлено на купирование острой фазы лимфоцитарной инфильтрации Джесснера-Канофа и увеличение продолжительности светлых промежутков. Терапия патологии неспецифическая. Отмечается хороший терапевтический эффект при назначении антималярийных препаратов (хлорохин, гидроксихлорохин) и нестероидных противовоспалительных средств (диклофенак, индометацин) после предварительного лечения сопутствующей патологии желудочно-кишечного тракта. Если состояние пищеварительной системы позволяет, применяют энтеросорбенты. Местно показаны гормональные кортикостероидные мази и кремы, а также инъекционные блокады очагов высыпаний триамцинолоном и бетаметазоном. При резистентности к проводимой терапии подключают плазмаферез (до 10 сеансов).
Инфильтрат
Инфильтрат — это скопление в тканях организма клеточных элементов, несвойственных для этой области, а также крови и лимфы. Его формирование сопровождается увеличением ткани в объеме, она уплотняется, меняет цвет, в очаге ощущается болезненность.
Лечение и прогноз этого состояния зависят от вида и причины его возникновения:
В медицине выделяется еще несколько разновидностей этого состояния.
Представляет собой скопление различных клеток в легочной ткани. При этом ткань уплотняется, увеличивается в объеме, а работа органов дыхания затрудняется. Причина образования инфильтрата легкого — проникновение инфекции и паразитов (аскаридоз), развитие опухоли, аллергический процесс.
Для определения патологии решающую роль играет рентгенологическое обследование. Также назначаются анализы крови для определения природы болезни и возможных возбудителей.
Лечение зависит от причины патологии. Терапию назначает врач-пульмонолог.
Инфильтрат после операции — это осложнение, возникшее в результате хирургического вмешательства. Причина развития патологии — инфицирование и травматизация тканей.
Также возникновению инфильтратов способствует нарушение кровообращения в области вмешательства и сниженная сопротивляемость инфекциям в послеоперационном периоде.
Патология развивается постепенно. Она обнаруживается на первой или второй неделе после операции. У человека поднимается температура, появляются боли в области брюшной полости, возникает задержка стула. В области вмешательства врач определяет болезненное уплотнение.
Инфильтрат опасен остановкой затягивания послеоперационной раны и ее нагноением, поэтому сразу при его обнаружении хирург назначает антибиотикотерапию.
Патология развивается на месте подкожных или внутримышечных уколов. Чаще всего инфильтрат возникает после инъекций в ягодичную мышцу: появляется болезненность, при пальпации обнаруживается уплотнение. Кожа краснеет, температура поднимается до субфебрильных цифр.
Причиной развития становится нарушение правил постановки уколов (тупые иглы, быстрое введение препарата, частые инъекции в одну и ту же область, несоблюдение правил асептики).
Для лечения инфильтрата используются местные средства (йодная сетка), методы физиотерапии (электрофорез), УВЧ и антибиотикотерапия.
Это осложнение острого аппендицита, которое проявляется в виде спаянных между собой тканей аппендикса с органами, расположенными поблизости (слепая кишка, тонкая кишка, сальник).
Образование формируется на 2–5 день от начала болезни. После формирования инфильтрата острую боль в правой подвздошной области сменяет тупая и ноющая. В крови также определяется воспаление (повышенное СОЭ, лейкоцитоз). Температура поднимается до субфебрильных цифр. Со временем уплотнение может нагноиться или рассосаться. Образование лечится консервативным путем: врач назначает антибиотики, физиотерапевтические процедуры. Через 2 месяца проводится плановая аппендэктомия.
МОРФОЛОГИЧЕСКИЕ КРИТЕРИИ ДИАГНОСТИКИ ХРОНИЧЕСКОГО ЭНДОМЕТРИТА
В работе приведены основные патологоанатомические критерии при установлении диагноза хронический эндометрит.
Для выявления частоты и морфологических критериев хронического эндометрита нами, в одном из частных клиник города, изучены материалы диагностического выскабливания полости матки, нередком при гистероскопическом исследовании. В гинекологическом отделении клиники в последние 2 года исследованы соскобы от 622 женщин.
При обострении ХЭ появляются очаговые или диффузные инфильтраты из лейкоцитов, выраженная гиперемия и отек эндометрия
Таким образом, при исследовании материала диагностического выскабливания полости матки ( соскоба) патологоанатомы должны четко выявлять гистологические проявления хронического эндометрита. В нашем материале морфологические изменения эндометрия соответствовали хроническому неспецифическому лимфоцитарному эндометриту.
Повторные исследования материала с диагнозом хронический эндометрит после окончания курса лечения позволяет судить об эффективности проведенного лечения. Нормализация морфологической характеристики эндометрия ( отсутствие лимфоцитарных инфильтратов, макрофагов, плазматических клеток, фиброза и отека стромы) позволяет судить о восстановлении функциональной активности эндометрия и является критерием эффективности лечения.
Литература
3. Коваленко В.Л и др Характеристика эпителия и внеклеточного матрикса эндометрия при невынащивании беременности ранних сроков, ассоциированном с хроническим эндометритом Арх.пат,2000,№3, с 40-43
8. Сухих Г.Т, Шуршалина А.В, Верясов Иммуноморфологические особенности эндометрия у женщин с хроническим эндометритом В.Н Бюлл.экспер и биол.,2006,№1,113-115
9. Salamonsen L.A., Zhang J., Brasted M. // j. Reprod. Immunol/ 2002. Vol.52, N2.P. 95-108
Созылмалы эндометритті анықтаудың морфологиялық критерийлері
Ахметов Ж.Б
ҚазҰМУ, патологиялық анатомия кафедрасы
Morphological criteria of the diagnosis of chronic endometritis.
Akhmetov J.B.
Department of Pathology of the Kazakh National Medical University.
Abstract Ordinaly chronic endometritis is asymptomatic and discovered during histological examination. For the diagnosis of chronic endometritis is important to indicate the day of taking the material, and the optimal time is 7-9 day of the menstrual cycle. The criteria for the diagnosis of chronic endometritis are lymphoid infiltration in the lower part of the functional and basal layers of the endometrium. Among cell infiltrates it is possible found isolated macrophages and plasma cells. For the diagnosis of chronic endometritis important signs are the fibrosis of the stroma of endometrium and sclerosis of the wall of spiral vessels. According to our data the frequency of chronic endomtrita is 12.5%.
Кафедра патологической анатомии КазНМУ им. С. Д. Асфендиярова
Хронический гастрит: от гистологического протокола до обоснования этиопатогенетической терапии

Гастрит представляет собой реакцию слизистой оболочки (СО) желудка на повреждение и характеризуется формированием воспалительных, дистрофических и дисрегенераторных изменений в СО желудка, а также атрофией эпителиальных клеток с замещением нормальных желе
Abstract. Gastritis is a reaction of the mucous membrane (MM) of the stomach to damage and is characterized by the formation of inflammatory, dystrophic and dysregenerative changes in the MM of the stomach, as well as atrophy of epithelial cells with replacement of normal glands with fibrous tissue. The progression of chronic gastritis (CG) is accompanied by the development of MM atrophy, dysplasia and becomes a significant factor in the formation of gastric malignant neoplasms. The article presents the modern etiological classification of CG, approaches to the diagnosis of CG, assessing the stage of gastritis on a scale of progressive increase in the likelihood of developing stomach cancer, presents the histological characteristics, and also substantiates etiopathogenetic approaches to the treatment of various forms of CG, including methods for optimizing the eradication therapy of H. pylori infection. which can be used to increase the effectiveness of not only standard triple therapy, but also other anti-Helicobacter treatment regimens. The use of proton pump inhibitors in the treatment of gastritis is considered. For citation: Dolgalev I. V., Kareva E. N., Lyalyukova E. A. Chronic gastritis: from histological protocol to substantiation of etiopathogenetic therapy // Lechaschy Vrach. 2021; 2 (24): 30-34. DOI: 10.26295/OS.2021.76.84.006
Резюме. Гастрит представляет собой реакцию слизистой оболочки (СО) желудка на повреждение и характеризуется формированием воспалительных, дистрофических и дисрегенераторных изменений в СО желудка, а также атрофией эпителиальных клеток с замещением нормальных желез фиброзной тканью. Прогрессирование хронического гастрита (ХГ) сопровождается развитием атрофии, дисплазии СО и становится значимым фактором формирования злокачественных новообразований желудка. В статье приводятся современная этиологическая классификация ХГ, подходы к диагностике ХГ, оценке стадии гастрита по шкале прогрессирующего увеличения вероятности развития рака желудка, представлены гистологические характеристики, а также обоснованы этиопатогенетические подходы к терапии различных форм ХГ, включая методы оптимизации эрадикационной терапии инфекции H. pylori, которые могут быть применены для повышения эффективности не только стандартной тройной терапии, но и других режимов антихеликобактерного лечения. Рассмотрено примение ингибиторов протонной помпы в терапии гастрита.
Хронический гастрит (ХГ) – широко распространенное заболевание пищеварительной системы, регистрируемое у 15-30% населения в различных популяциях и составляющее 80-85% всех заболеваний желудка 3. Медико-социальная значимость проблемы заключается в том, что прогрессирование ХГ сопровождается развитием атрофии, дисплазии слизистой оболочки (СО) и становится значимым фактором формирования злокачественных новообразований желудка [4, 5].
Целью данного обзора было представить гистологическую характеристику и обосновать этиопатогенетические подходы к терапии различных форм ХГ.
Дефиниции
Гастрит представляет собой реакцию СО на повреждение и характеризуется формированием воспалительных, дистрофических и дисрегенераторных изменений в СО желудка, а также атрофией эпителиальных клеток с замещением нормальных желез фиброзной тканью. Развитие этого заболевания сопровождается нарушением секреторной и моторной функций желудка.
К настоящему времени сложилось устойчивое мнение о том, что диагноз гастрита должен быть верифицирован морфологически. Основным гистологическим признаком заболевания являются инфильтрация собственной пластинки воспалительными клетками и структурные изменения железистого аппарата слизистой желудка [5]. При гистологическом исследовании гастрит подтверждается наличием нейтрофилов или мононуклеарных клеток 2-й степени по крайней мере в одном участке биопсии желудка либо нейтрофилов или мононуклеарных клеток 1-й степени по меньшей мере в двух участках [6]. Воспалительный инфильтрат представлен лимфоцитами, плазматическими клетками, гистиоцитами и гранулоцитами, расположенными диффузно или в виде скоплений в собственной пластинке СО, иногда – внутри желез. Активность воспалительного процесса определяется степенью инфильтрации полиморфноядерными лейкоцитами (нейтрофилами и ацидофильными гранулоцитами) собственной оболочки (lamina propria) слизистой желудка [7].
Международная группа патологов Оперативного звена для оценки гастрита (Operative Link for Gastritis Assessment – OLGA) предложила интегральный метод оценки выраженности морфологических изменений СО желудка и стандартизировала гистологические фенотипы по степени и стадии развития (OLGA Staging System) 10. Локализация нейтрофилов определяет степень: нейтрофилы в собственной пластинке оболочки – легкая (+-) активность; нейтрофилы в эпителии – умеренная (++-) активность и нейтрофилы в просвете железы – выраженная (+++) активность.
Прогрессирование заболевания сопровождается замещением собственных железистых структур lamina propria фиброзной тканью (неметапластическая атрофия) или заменой желез метапластическими железами. Метапластическая атрофия может иметь два фенотипа: кишечная метаплазия (КМ), поражающая слизистые железы, и псевдопилорическая метаплазия, которая также известна как метаплазия псевдопилорических желез. Система позволяет оценить стадию гастрита по шкале прогрессирующего увеличения вероятности развития рака желудка – риск от самого низкого (стадия 0) до самого высокого (стадия IV). Таким образом, под степенью гастрита подразумевается выраженность суммарной воспалительной инфильтрации (нейтрофильными лейкоцитами и мононуклеарными клетками), под стадией – выраженность атрофии. Такая система дает достаточно полную характеристику гастрита и отражает его динамику.
Альтернативная система определения стадии заболевания (Operative Link on Gastric Intestinal Metaplasia Assessment – OLGIM) предлагает рассматривать только КМ для оценки атрофии [9]. Различение неатрофического и атрофического гастрита необходимо, чтобы получить информацию о том, за какими пациентами требуется клиническое/эндоскопическое наблюдение.
Этиология ХГ
Современная этиологическая классификация ХГ была предложена в 2015 г. на Международном консенсусе в Киото (Япония) [12].
С учетом этиологического фактора различают следующие формы гастрита:
I. Аутоиммунный ХГ (АИГ) (этиология неизвестна; аутоиммунный патогенез).
II. Инфекционный ХГ.
III. Экзогенный ХГ (лекарственный, алкогольный, радиационный, вызванный химическими веществами).
IV. ХГ, вызванный воздействием специфических причин (лимфоцитарный, гигантский гипертрофический (болезнь Менетрие), аллергический, эозинофильный).
V. Вторичный ХГ, вызванный другими заболеваниями (при саркоидозе, васкулитах, болезни Крона).
Аутоиммунный хронический гастрит
В общей популяции встречается нечасто – менее чем в 1% случаев, а среди больных ХГ – до 5% [13]. Заболевание вызывает поражение фундального отдела и тела желудка. АИГ является наследственно обусловленным и передается как аутосомно-доминантный признак, часто сочетаясь с другими аутоиммунными заболеваниями (сахарным диабетом 1 типа, тиреоидитом Хашимото, синдромом Шегрена) [14]. Патогенетически это аутоиммунная патология, связанная с наличием антител, направленных против париетальных клеток желудка и их компонентов (внутренний фактор и протонная помпа) с формированием атрофии СО желудка. Прогрессивное снижение количества париетальных клеток приводит к гипохлоргидрии вплоть до анацидного состояния. Снижение синтеза соляной кислоты стимулирует G-клеточную гиперплазию и таким образом способствует повышению уровня гастрина в сыворотке крови. В свою очередь гипергастринемия создает условия для гиперплазии энтерохромаффиноподобных клеток, которые иногда трансформируются в злокачественную опухоль желудка [15]. Относительный риск развития аденокарциномы желудка у этих больных возрастает в 3 раза [16]. Снижение образования внутреннего фактора приводит к мальабсорбции витамина В12 и его дефициту в организме, что может стать причиной пернициозной (мегалобластной) анемии, а также множественных неврологических расстройств (фуникулярный миелоз) [15].
Типичные гистологические паттерны аутоиммунного гастрита 17
Другие гистологические паттерны
ХГ, ассоциированный с инфекцией H. pylori
Инфекция H. pylori – наиболее частая причина развития ХГ. Заболевание первоначально развивается как хронический активный гастрит, при котором H. pylori обнаруживается как в антральном отделе, так и в теле желудка (обычно в большем количестве в антральном отделе). Длительно сохраняющийся активный гастрит, ассоциированный с H. pylori, создает условия для развития вторичной атрофии СО желудка. Так, по результатам 10-летнего проспективного наблюдения больных хеликобактерным активным гастритом, атрофия выявлена у 6% пациентов через 2 года, у 22% – через 4 года, у 34% – через 6 лет и у 43% – через 10 лет наблюдения, при этом в группе контроля (Нр-негативные) атрофия не развивалась [19].
Гистология процесса представлена следующим образом: полиморфноядерные лейкоциты инфильтрируют собственную пластину, железы и фовеолярный эпителий, образуя небольшие микроабсцессы. Наблюдаются лимфоидные агрегаты и лимфоидные фолликулы, расширяющие собственную пластинку СО, иногда лимфоциты проникают в эпителий. Инфекция H. pylori – основная причина вторичной атрофии СО желудка. Атрофические изменения (как метапластические, так и неметапластические) в образце биопсии из угла и антрального отдела в первую очередь следует рассматривать как доказательства хеликобактерного гастрита. На поздних стадиях атрофии, связанной с хронической инфекцией H. pylori, как в теле, так и в антральном отделе наблюдается обширное замещение КМ, связанной с развитием гипохлоргидрии. По мере распространения КМ количество бактерий H. pylori, обнаруживаемых в желудке, уменьшается, так как H. pylori исчезает из участков метапластического эпителия. Особое значение этой проблеме придает то, что атрофический гастрит является начальной ступенью каскада изменений СО, приводящего к злокачественному новообразованию желудка (каскад Корреа) [20]. Вероятность развития рака желудка возрастает по мере нарастания тяжести атрофии слизистой, и этот риск находится в прямой зависимости от степени атрофических изменений, выявляемых в антральном отделе и в теле желудка, в особенности при наличии метаплазии [21]. Длительное течение гастрита, ассоциированного с H. pylori, повышает вероятность развития злокачественной опухоли желудка в 6 раз [21].
Типичные гистологические паттерны
Варианты гистологических паттернов
Последствия
Цитомегаловирусный (ЦМВ) гастрит
Единственная вирусная инфекция желудка с отчетливой патологической картиной. Преимущественно поражает детей и пациентов с ослабленным иммунитетом. Обычно поражаются разные участки желудочно-кишечного тракта. Эндоскопически СО желудка может выглядеть полностью нормальной или иметь эрозии и язвы. В редких случаях это может быть образование, называемое псевдоопухолью. Гистологически многочисленные включения ЦМВ в эпителиальных клетках можно увидеть реже, чем в эндотелиальных, а также в макрофагах с незначительным воспалением или его отсутствием. В этом случае иммунологический статус пациентов обычно сильно подавлен. В других случаях может наблюдаться обильная грануляционная ткань с серьезной воспалительной реакцией, в то время как включения ЦМВ трудно увидеть без методов иммуногистохимии или гибридизации in situ. Эозинофильные инфильтраты также могут быть важным компонентом воспаления при ЦМВ-гастрите [7].
Гастрит, вызванный лекарственными средствами; алкогольный гастрит; лучевой гастрит, рефлюкс-гастрит
Химические агенты увеличивают обновление эпителия желудка, что приводит к фовеолярной гиперплазии. Эти состояния часто протекают бессимптомно, но они могут привести к множественным эрозиям или язвам, даже с кровотечением. Атрофические изменения встречаются редко [7].
Диагноз основан на микроскопическом исследовании СО желудка, и, согласно существующему определению, основным его признаком является наличие не менее 25 интра-эпителиальных лимфоцитов на 100 эпителиальных клеток желудка. Большинство этих лимфоцитов имеют фенотип CD3+ и CD8+. Известно, что инфекция H. pylori связана с ЛГ, достигая от 0% до 27% случаев. Связь между ЛГ и глютеновой болезнью установлена и колеблется от 10% до 38% [7].
Эозинофильный гастрит (ЭГ)
Является частью семейства эозинофильных желудочно-кишечных расстройств, которое включает эозинофильный эзофагит, эозинофильный гастроэнтерит и эозинофильный энтерит/колит, связанные с триггерами пищевых аллергенов. У многих пациентов в анамнезе были атопические состояния, включая астму, аллергический ринит или атопический дерматит, а также аллергию на лекарственные продукты или пыльцу. Рекомендованы два основных критерия диагностики ЭГ: 1) в биоптате желудка средняя плотность эозинофилов > 127/мм 2 (или > 30 эозинофилов/поле высокого увеличения (HPF) на микроскопах, оснащенных широкоугольными окулярами (FN 22), по крайней мере в пяти отдельных HPFs); 2) отсутствие известных ассоциированных причин эозинофилии (например, инфекция H. pylori, болезнь Крона, паразитарные инфекции, а также гематологические или лимфоидные нарушения) [7].
Диагностика ХГ
Диагностика ХГ включает клиническое обследование, cерологическое исследование (пепсиногены и антитела против инфекционных агентов и/или аутоантигены), эндоскопию верхних отделов желудочно-кишечного тракта (с применением стандартизированных протоколов биопсии) и последующее гистологическое исследование. Гистологическое изучение биоптата является «золотым стандартом» в диагностике заболевания. Прицельная биопсия из пяти мест: антральный отдел, большая (А1) и малая кривизна (А2), угол (А3) и тело желудка, большая (С1) и малая кривизна (С2).
Стандартизация морфологических признаков ХГ нашла отражение в полуколичественных системах гистологической классификации гастритов, которые были заложены Сиднейской системой (Sydney Systems, 1990) и получили дальнейшее развитие в Хьюстонской модифицированной классификации (1994) и системах OLGA и OLGIM (2008) 23.
Подходы к терапии отдельных форм ХГ
Своевременная диагностика и верное определение классификационной группы ХГ имеют основополагающее значение для успешного лечения этого заболевания.
Особенности АИГ зависят от стадии, наличия инфекции H. pylori, текущего дефицита питательных веществ, сопутствующих аутоиммунных состояний и риска злокачественной трансформации. Так как инфекция H. pylori может играть решающую роль в патогенезе АИГ, необходим скрининг на H. рylori пациентов с диагностированным АИГ, атрофией желудка, КМ/дисплазией и гипо- или ахлоргидрией. При положительном результате на H. pylori пациенты нуждаются в последующем лечении. Исследования подтверждают, что эрадикация H. pylori была связана со снижением уровней антител к париетальным клеткам и антител против внутреннего фактора на ранних стадиях AИГ.
Пероральный прием витамина B12, железа и фолиевой кислоты рекомендуется на ранних стадиях АИГ. При появлении неврологических симптомов следует назначать витамин B12 парентерально.
Поскольку различные аутоиммунные заболевания признаются сопутствующими AИГ, необходимо уделять внимание их скринингу и последующему лечению.
Тактика лечения AИГ с предотвращением осложнений требует надлежащего длительного наблюдения в соответствии с текущими симптомами, серологическими результатами и данными визуализации. Для этого необходим правильный мониторинг показателей – один раз в год (общий анализ крови, уровень гастрина, железа и витамина B12) [25, 26].
ХГ, вызванный Н. pylori, в том числе у «бессимптомных» лиц, является показанием к проведению эрадикационной терапии инфекции Н. pylori. Эрадикация способствует излечению хронического неатрофического гастрита, может привести к регрессии атрофического гастрита и снижает риск развития рака желудка у пациентов с неатрофическим и атрофическим гастритом. Эрадикация H. pylori у пациентов с КМ тяжелой степени, судя по всему, не приводит к существенному снижению риска развития рака желудка, как минимум в краткосрочной перспективе, однако обеспечивает снижение выраженности воспаления и атрофии, и у таких пациентов следует рассмотреть возможность ее проведения [27].
В России терапией первой линии эрадикации служит стандартная тройная терапия, включающая ИПП, кларитромицин и амоксициллин. Стандартную тройную терапию следует проводить, применяя различные меры, повышающие ее эффективность. Среди методов оптимизации, позволяющих повысить эффективность эрадикационной терапии инфекции H. pylori, следует отметить увеличение продолжительности лечения до 14 дней, выбор надежного ИПП или увеличение дозы ИПП, добавление висмута трикалия дицитрата или пробиотика. В качестве альтернативного варианта эрадикационной терапии первой линии может быть использована классическая четырехкомпонентная схема на основе висмута трикалия дицитрата или без препаратов висмута, которая включает ИПП, амоксициллин, кларитромицин и метронидазол. Квадротерапию с висмута трикалия дицитратом применяют также как основную схему терапии второй линии при неэффективности стандартной тройной терапии. Другая схема второй линии включает ИПП, левофлоксацин и амоксициллин. Тройная терапия с левофлоксацином может быть назначена только гастроэнтерологом по строгим показаниям. Терапию третьей линии подбирают индивидуально в зависимости от предшествующих схем лечения.
Методы оптимизации эрадикационной терапии инфекции H. pylori могут быть применены для повышения эффективности не только стандартной тройной терапии, но и других режимов антихеликобактерного лечения, а комбинирование этих методов позволяет добиться наилучшего результата у конкретного пациента [28].
Эрадикация H. pylori позволяет купировать симптомы диспепсии и активность гастрита.
Если все варианты терапии исчерпаны, обычное лечение будет направлено на снижение секреции кислоты СО желудка и защиту слизистого барьера.
В клинической практике кислая среда в желудке играет решающую роль в развитии гастрита, вызванного H. рylori, и ассоциированных с ним симптомов диспепсии, поэтому ИПП являются важной стратегией лечения пациентов с симптоматическим гастритом [29].
Кислотообразующая АТФаза, известная как АТФаза вакуо-лярного типа, помимо париетальных клеток имеется также в лизосомах лейкоцитов, и на ее активность тоже влияют ИПП [31]. Противовоспалительный эффект ИПП включает торможение хемотаксиса и дегрануляции нейтрофилов, взаимодействие нейтрофилов с эндотелиоцитами, выработку нейтрофилами свободных радикалов [32]. Противовоспалительная активность ИПП подтверждена результатами клинических и экспериментальных исследований. В частности, в экспериментальном исследовании было оценено влияние омепразола на адгезивную активность нейтрофилов, стимулированную H. pylori. Адгезия нейтрофилов увеличивалась за счет присутствия H. рylori, тогда как введение ИПП (омепразола), напротив, значительно снижало адгезию дозозависимым образом [31].
Использование авторадиографии позволило выявить накопление 3H-лансопразола в цитоплазматических гранулах нейтрофилов, инфильтрирующих СО желудка. За счет повышения внутривакуолярного уровня pH в лизосомах нейтрофилов, ИПП ослабляют активацию нейтрофилов и высвобождение ими токсичных метаболитов [33].
В исследованиях in vivo было показано, что омепразол (1-100 мкМ) дозозависимо увеличивал рН в лизосомах, ингибировал подвижность активированных нейтрофилов, подавлял выработку ими токсичных продуктов и снижал работу лизосомальных ферментов. У здоровых добровольцев, которым вводили омепразол в дозе 40 мг/сут в течение 7 дней, выявлено значительное снижение хемилюминисценции (отражающей активности) периферических нейтрофилов [34].
Учитывая, что длительное воспаление в СО желудка сопряжено с повреждением ДНК и риском канцерогенеза, своевременное и эффективное лечение гастрита, особенно на ранних его стадиях, является важным аспектом канцеропревенции в гастроэнтерологии.
Таким образом, не вызывает сомнений тот факт, что класс ИПП является наиболее востребованным при лечении кислотозависимых заболеваний с позиции доказательной медицины. Согласно реестру Сomcon (2020) [35], омепразол занимал и продолжает занимать лидирующие позиции в назначениях докторов и полностью отвечает критериям эффективности и безопасности при лечении кислотозависимых заболеваний [36].
Среди препаратов омепразола, представленных на российском фармацевтическом рынке, одним из самых изученных и надежных, а также известных [37] является Омез®. Полный цикл производства лекарственного препарата Омез® соответствует международным стандартам GMP [сертификат, подтверждающий производство Омеза по стандартам GMP], что обеспечивает высокое качество препарата и достижение должного уровня рН в желудке у пациентов, необходимого для кислотосупрессии. Омез® включен в Оранжевую Книгу FDA с терапевтической эквивалентностью категории «А», что подтверждает его качество на мировом уровне и идентичность оригинальному омепразолу [38].
Сравнительное исследование по оценке эффективности генериков омепразола, назначаемых в течение 7 дней в параллельных группах (в одной из которых использовали ИПП Омез®, в других – небрендированные омепразолы разного производства), показало, что уровень кислотосупрессии желудка достоверно выше на фоне применения Омез® в дозе 20 мг 2 раза в сутки. Использование других генериков омепразола в приведенном исследовании не приводило к целевому снижению уровня кислоты в желудке, что очевидно отражает их потенциальную клиническую неэффективность. Полученные различия могут быть связаны как с качеством субстанции, так и различиями лекарственных форм. Все молекулы ИПП являются кислотонеустойчивыми, и потому для сохранения действующего вещества в нативном виде для всасывания в кровь в кишечнике абсолютно необходимо защитить молекулу от кислоты. Для этого в лекарственной форме имеется кишечнорастворимая оболочка. Из капсулы Омез®, которая растворяется в желудке, высвобождаются гранулы (пеллеты), покрытые кишечнорастворимой оболочкой (MUPS – multi-unit pellet system). Пеллеты правильной формы и одинакового размера, который позволяет им смешаться с химусом и без задержек отправиться в тонкую кишку. Здесь происходит растворение оболочки, выход омепразола в жидкую среду и абсорбция его энтероцитами. Этот процесс должен происходить дружно, и пик концентрации омепразола должен совпасть с пиком активации протонных насосов (для этого обязательно принять пищу через 30 мин после приема препарата ИПП), только в активированном состоянии они доступны для связывания и блокады. Очевидно, что оптимизация лекарственных форм отражается на клинической эффективности препаратов. Но это статья расходов, на которой дженериковые компании зачастую экономят. Поэтому при выборе медикаментозной кислотосупрессивной терапии следует учитывать потенциальные возможности лекарственных препаратов, ориентируясь на должный уровень эффективности [39].
Омез® – один из немногих препаратов омепразола, имеющих форму выпуска – капсулы 40 мг. Пациентам с низкой приверженностью к терапии можно рекомендовать Омез® 40 мг 1 раз в сутки за 30 минут до завтрака [40]. Эта доза является оптимальной и для быстрых метаболизаторов. Еще одним несомненным достоинством препарата является его доступная цена при высоком качестве субстанции и уникальной лекарственной форме, что дает возможность в сложившихся социально-экономических условиях поддерживать на высоком уровне качество жизни большого числа больных кислотозависимыми заболеваниями.
КОНФЛИКТ ИНТЕРЕСОВ. Авторы статьи подтвердили отсутствие конфликта интересов, о котором необходимо сообщить.
CONFLICT OF INTERESTS. Not declared.
Литература/References
* ФГБОУ ВО Сибирский ГМУ Минздрава России, Томск, Россия
** ФГАОУ ВО РНИМУ им. Н. И. Пирогова Минздрава России, Москва, Россия
*** ФГАОУ ВО Первый МГМУ им. И. М. Сеченова Минздрава России, Москва, Россия
**** ФГБОУ ВО ОмГМУ Минздрава России, Омск, Россия
***** ФГБОУ ВО МГМСУ им. А. И. Евдокимова Минздрава России, Москва, Россия
Хронический гастрит: от гистологического протокола до обоснования этиопатогенетической терапии/ И. В. Долгалёв, Е. Н. Карева, Е. А. Лялюкова, Н. В. Павлова
Для цитирования: Долгалёв И. В., Карева Е. Н., Лялюкова Е. А., Павлова Н. В. Хронический гастрит: от гистологического протокола до обоснования этиопатогенетической терапии // Лечащий Врач. 2021; 2 (24): 30-34.
Теги: хеликобактерная инфекция, слизистая оболочка, дисплазия, факторы риска