Что может находиться на плазмиде
Что может находиться на плазмиде
• В клетках большинства прокариот присутствует одна кольцевая хромосома
• Генетическая гибкость прокариот и их адаптационные возможности усиливаются при заражении бактериофагами и при переносе плазмид
• Быстрая эволюция генома прокариот обеспечивается транспозонами и другими мобильными элементами
У большинства прокариот присутствует одна кольцевая хромосома, и они являются гаплоидными клетками. В следующем разделе рассмотрены вопросы организации хромосомы в дискретную структуру, нуклеоид. В настоящее время мы располагаем данными секвенирования более 200 геномов прокариот, размеры которых варьируют от 580 кнп (Mycoplasma genitalium) до 9 Мнп (Streptomyces, Myxococcus).
Геном таких хорошо известных бактерий, как Е. coli и В. subtilis, занимает среднее положение (4-5 Мнп). Относительно небольшие размеры прокариотических хромосом, по сравнению с хромосомами высших эукариот, объясняются их компактностью и небольшим количеством некодирующих последовательностей ДНК. В общем, гены, необходимые для постоянного роста и поддержания жизнеспособности прокариот, находятся в хромосоме, а генетическая гибкость микроорганизмов обеспечивается различными мобильными элементами.
У некоторых бактерий хромосома имеет линейную форму, или же в клетке содержится несколько таких хромосом. Встречаются виды, для которых характерны обе эти особенности. Например, клетки Streptomyces содержат линейную хромосому. Концы этой хромосомы замкнуты белковым мостиком, и это объясняет, почему долгое время на генетической карте этих бактерий изображали круговую хромосому.
Бактерии Rhodobacter sphaeroides обладают двумя большими кольцевыми хромосомами (3,0 и 0,9 Мнп), в каждой из которых присутствует много необходимых генов домашнего хояйства. Возбудитель Лайм-боррелиоза, бактерия Воrrelia burgdorferi характеризуется наличием нескольких линейных хромосом.
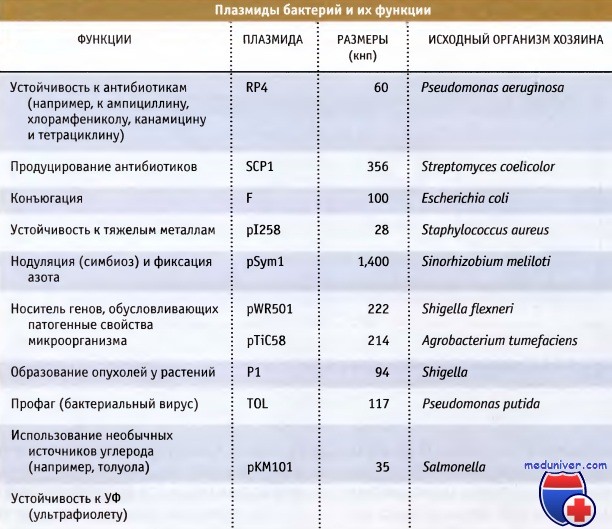
Стабильные элементы внехромосомной ДНК, которые не несут необходимых генов домашнего хозяйства и поэтому не являются существенными, называются плазмиды. На рисунке ниже перечислены некоторые хорошо изученные плазмиды бактерий. Эти данные дают представление о размерах генов, которые могут нести эти плазмиды. Плазмиды обычно невелики, варьируя по размерам от 2 до 1000 кнп, и обладают кольцевой структурой.
Так же как и в случае хромосом, известны исключения, и некоторые крупные плазмиды достигают размера 1 Мнп или больше, и небольшая их часть обладает линейной структурой. Все плазмиды несут гены, управляющие их репликацией, обычно включающей различные элементы аппарата репликации клетки хозяина. К числу важнейших генов, которые несут плазмиды, относятся гены устойчивости к антибиотикам и обусловливающие патогенные свойства или деградацию необычных источников углерода.
Плазмиды могут распространяться между организмами различными путями. Конъюгация представляет собой процесс, напоминающий спаривание, при котором присходит прямой перенос ДНК от клетки донора, содержащей плазмиду, в клетку реципиента. В донорской плазмиде закодированы функции, необходимые дляУ большинства прокариот присутствует одна кольцевая хромосома, и они являются гаплоидными клетками. В следующем разделе рассмотрены вопросы организации хромосомы в дискретную структуру, нуклеоид.
В настоящее время мы располагаем данными секвенирования более 200 геномов прокариот, размеры которых варьируют от 580 кнп (Mycoplasma genitalium) до 9 Мнп (Streptomyces, Myxococcus). Геном таких хорошо известных бактерий, как Е. coli и В. subtilis, занимает среднее положение (4-5 Мнп). Относительно небольшие размеры прокариотических хромосом, по сравнению с хромосомами высших эукариот, объясняются их компактностью и небольшим количеством некодирующих последовательностей ДНК. В общем, гены, необходимые для постоянного роста и поддержания жизнеспособности прокариот, находятся в хромосоме, а генетическая гибкость микроорганизмов обеспечивается различными мобильными элементами.
У некоторых бактерий хромосома имеет линейную форму, или же в клетке содержится несколько таких хромосом. Встречаются виды, для которых характерны обе эти особенности. Например, клетки Streptomyces содержат линейную хромосому. Концы этой хромосомы замкнуты белковым мостиком, и это объясняет, почему долгое время на генетической карте этих бактерий изображали круговую хромосому.
Бактерии Rhodobacter sphaeroides обладают двумя большими кольцевыми хромосомами (3,0 и 0,9 Мнп), в каждой из которых присутствует много необходимых генов домашнего хояйства. Возбудитель Лайм-боррелиоза, бактерия Воrrelia burgdorferi характеризуется наличием нескольких линейных хромосом.
Стабильные элементы внехромосомной ДНК, которые не несут необходимых генов домашнего хозяйства и поэтому не являются существенными, называются плазмиды. На рисунке ниже перечислены некоторые хорошо изученные плазмиды бактерий. Эти данные дают представление о размерах генов, которые могут нести эти плазмиды. Плазмиды обычно невелики, варьируя по размерам от 2 до 1000 кнп, и обладают кольцевой структурой.
Так же как и в случае хромосом, известны исключения, и некоторые крупные плазмиды достигают размера 1 Мнп или больше, и небольшая их часть обладает линейной структурой. Все плазмиды несут гены, управляющие их репликацией, обычно включающей различные элементы аппарата репликации клетки хозяина. К числу важнейших генов, которые несут плазмиды, относятся гены устойчивости к антибиотикам и обусловливающие патогенные свойства или деградацию необычных источников углерода.
Плазмиды могут распространяться между организмами различными путями. Конъюгация представляет собой процесс, напоминающий спаривание, при котором присходит прямой перенос ДНК от клетки донора, содержащей плазмиду, в клетку реципиента. В донорской плазмиде закодированы функции, необходимые для обеспечения контакта с клеткой реципиентом, инициации переноса реплицированной ДНК, и самого переноса ДНК в клетку реципиента.
Плазмиды также могут передаваться при прямом захвате ДНК (трансформация) или с участием бактериофага (трансдукция). Независимо от наличия экстрахромосомных элементов, изменения в бактериальном геноме могут возникать за счет процессов гомологичной и сайт-специфической рекомбинации.
Для многих бактерий важными источниками генетической вариабельности, по-видимому, являются бактериофаги (бактериальные вирусы). Результаты секвенирования показывают, что в геноме многих бактерий присутствуют интегрированные последовательности бактериофага (профаги). Например, у Е. coli их по меньшей мере 9, а у B. subtilis 10. Некоторые из этих профагов обладают дефектами, например у них присутствуют делеции и другие мутации, что делает маловероятным их дальнейшую активацию с образованием инфекционных бактериофагов.
В некоторых случаях профаги несут гены, которые обеспечивают некоторые преимущества клеткам хозяина: это относится к системам рестрикции и модификации, устойчивости к УФ и к таким детерминантом патогенности, как токсины.
Наконец, бактериальный геном также содержит много мобильных генетических элементов, которые распространяются посредством транспозиции. Инсерционные последовательности содержат минимальные элементы, которые, в своей простейшей форме, вместе с фланкирующими последовательностями, обладают только одним геном транспозазы. При инициации транспозиции, фланкирующие последовательности узнаются белком транспозазой.
Затем происходит мобилизация ферментов клетки хозяина, участвующих в репликации и репарации ДНК. Они завершают процесс вставки последовательности в необходимом месте. Более сложные транспозоны несут дополнительные гены, способные обеспечить адаптационные преимущества клеткам хозяина. Наиболее известными примерами транспозонов у бактерий являются гены устойчивости к антибиотикам, однако подобным образом могут переноситься также многие другие гены. Близкие к транспозонам элементы могут катализировать несколько таких типов перегруппировок ДНК, как инверсии и делеции.
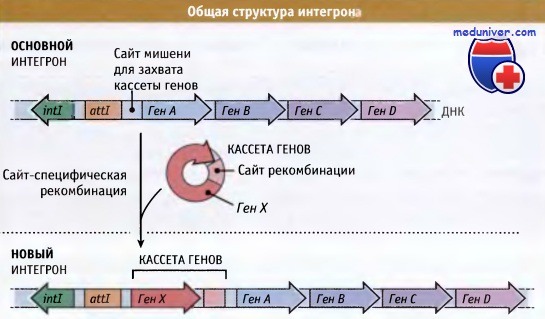
Интегроны представляют собой особенно важный инструмент адаптивной перегруппировки генома. Как показано на рисунке ниже, интегроны обычно состоят из гена интегразы, примыкающего к нему сайта мишени для захвата кассеты генов, и сильного промотора, регулирующего экспрессию захваченных генов. В кассетах, часто включающих гены устойчивости к антибиотикам, содержатся последовательности, которые позволяют им включаться на место мишени под действием белка интегразы. Интегроны могут расти за счет последовательного захвата различных кассет генов, что способствует быстрому развитию таких бактерий, которые устойчивы к ряду антибиотиков.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
— Вернуться в содержание раздела «генетика» на нашем сайте
Мобильные генетические элементы прокариот: стратификация «общества» бродяжек и домоседов
Многообразие мобильных генетических элементов
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Мобильные элементы генома прокариот обсуждаются в отечественных научных и научно-популярных изданиях незаслуженно редко. Однако именно эти агенты распространяют в популяциях микроорганизмов устойчивость к физическим и химическим факторам, в том числе ультрафиолету и антибиотикам. Или дарят приютившим их клеткам селективные преимущества, кодируя метаболические пути и факторы патогенности. Эти «путешественники» преодолевают не только межклеточные и межвидовые границы, но даже междоменные, перетаскивая с собой внушительный багаж ценной генетической информации. Прокариотический мобилом поразительно мозаичен, сложно стратифицирован и напоминает своеобразный «парк юрского периода», предоставляя возможность исследовать ранние этапы эволюции механизмов наследственности и изменчивости.
Конкурс «био/мол/текст»-2014
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2014 в номинации «Биоинформатика и молекулярная эволюция».
Главный спонсор конкурса — дальновидная компания Генотек.
Конкурс поддержан ОАО «РВК».
Спонсором номинации «Биоинформатика» является Институт биоинформатики.
Спонсором приза зрительских симпатий выступила фирма Helicon.
Свой приз также вручает Фонд поддержки передовых биотехнологий.
Организмы и геномы можно таким образом расценивать как секции биосферы, по которым гены глобально циркулируют с различной интенсивностью, и в которые персональные гены и опероны могут включаться, если они предоставляют достаточные преимущества.
K. Jeon и J. Danielli [1]
Характерная, но не уникальная, особенность прокариотических организмов (бактерий и архей) — способность передавать наследственную информацию не только «вертикально» (от предков к потомкам), но и активно обмениваться ею «горизонтально» (между «соседями») — путем конъюгации, трансформации и трансдукции. Горизонтальный генетический перенос (ГГП) может происходить между прокариотическими, эукариотическими и даже между прокариотическими и эукариотическими клетками, а также в пределах одной клетки. В настоящее время ГГП признан одним из основных механизмов адаптивной эволюции [2].
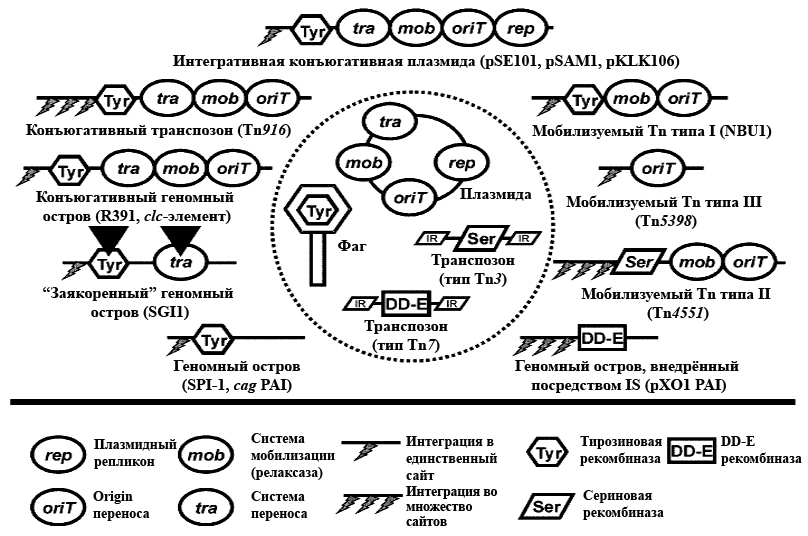
ГГП осуществляют мобильные генетические элементы (МГЭ) — чрезвычайно пёстрая группа «мигрантов» с различной склонностью к оседлости, в которую входят вирусы, плазмиды, транспозоны, интегроны, геномные острова и др. Революционные темпы развития молекулярно-биологического инструментария и пополнения баз «прочитанных» нуклеотидных последовательностей способствовали открытию удивительного мира МГЭ, или мобилома. Оказалось, что в геномах бактерий эти «бродяги» не только не являются маргиналами, но и выстроили сложную иерархию. И не так их легко различить. Основной виновник этого — всё тот же ГГП, предоставляющий неисчерпаемые возможности для генетической изменчивости. В результате наследственный материал организован модульно (рис. 1) и подобно матрёшке: МГЭ меньшего размера входят в состав более крупных и т.д. И не все они легки на подъём — иногда им нужны приличные стрессы или помощь товарища. Они часто путешествуют в другие клетки «зайцами», эксплуатируя элементы более высокого ранга. А могут и предательски обездвиживать друг друга. Итак, рассмотрим основные группы прокариотического «мобильного социума».
Рисунок 1. Мозаичная структура мобилизуемых и конъюгативных генетических элементов. В пунктирном круге приведены МГЭ (плазмиды, фаги, транспозоны), предоставляющие функциональные модули (указаны под чертой). Чёрные треугольники в функциональных модулях «заякоренного» геномного острова обозначают существование мутантных, нефункциональных форм этих модулей.
Основные сокращения
Вирусы: суперпаразиты и помощники
Вирусы (в т.ч. бактериофаги) и вироиды — субклеточные инфекционные агенты, которые могут воспроизводиться только внутри живых клеток («переключают» на собственное воспроизведение системы экспрессии наследственной информации клеток-хозяев), а вне клеток ведут себя как органические полимеры. Здесь я немного отклонюсь от прокариотических перипетий — уж очень интересны недавние открытия в мобиломе эукариот и даже вирусов.
«Мир РНК» — это гипотетический сценарий возникновения жизни на Земле, в основе которого лежит предположение о том, что исходно жизнь была основана только на молекулах РНК, а не ДНК или белках: «РНК у истоков жизни?». — Ред.
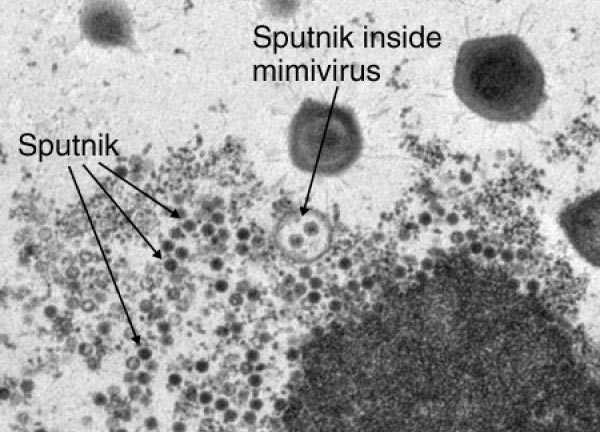
Вирусы паразитируют в клетках всех известных доменов — Eukarya, Archaea и Bacteria. Недавно был обнаружен ДНК-содержащий вирус «Спутник», паразитирующий на гигантском (различим с помощью светового микроскопа) мимивирусе акантамёбы (APMV) и названный по аналогии с бактериофагами вирофагом [4]. Вирофаг способен размножаться только при коинфицировании клетки амёбы мимивирусом, используя его «фабрику воспроизводства» и вызывая образование абортивных форм или патологически измененных капсидов APMV (рис. 2). ДНК «Спутника» — химера, совмещающая гены, заимствованные как у APMV, так и вирусов архей и неохарактеризованных морских вирусов.
Захватывающая история открытия вирусов вирусов рассказана в статье «. А на блохе — блошиночка поменьше». — Ред.
Рисунок 2. Частицы вирофага «Спутник» в мимивирусе.
В 2011 году были описаны еще 2 вирофага — OLV (Organic Lake Virophage) и Mavirus (Maverick Virus), причем множественные генетические параллели между Мавирусом и МП-транспозонами (гигантские транспозоны эукариот типа Maverick/Polinton) позволили предположить, что они эволюционировали от общего предка [6]. Отбор способствовал широкому распространению вирофага в клетках, поскольку паразитизм по отношению к гигантским вирусам повышал выживаемость инфицированных ими клеток, а приобретенная ретровирусная интеграза повышала шансы «закрепиться» в эукариотической клетке и трансформироваться в МП-транспозон.
В 2012 году охарактеризовали интегрированную в ДНК мимивирусов форму вирофага и даже новый класс МГЭ — трансповироны, способные встраиваться в ДНК и мимимирусов, и вирофагов [7]. Подобно бактериофагам, переносящим гены от одних бактерий к другим, вирофаги могут играть важную роль в ГГП между разными группами вирусов и их хозяевами.
Бактериофаги за счёт собственных тирозиновых рекомбиназ (интеграз) способны существовать в интегрированном (чаще в хромосому) состоянии — в форме профага. Однако при вырезании профага могут захватываться и упаковываться в вирусные «головки» фрагменты ДНК хозяина, которые в дальнейшем трансдуцируются в новые клетки и вместе с фаговой ДНК часто становятся «плацдармом» для рекомбинационных событий. Профаговая ДНК в некоторых случаях может составлять до 16% бактериального генома, причём постоянный обмен функциональными модулями между профагами, инфицировавшими одну клетку, приводит к формированию химерных фагов (P22 из Salmonella), а часто — к утрате способности к вырезанию и перманентному участию в эволюции бактериального генома.
Многие профаги кодируют факторы вирулентности, трансформируя нетоксигенные бактерии в агентов-убийц: профаг CTXphi из Vibrio cholerae кодирует холерный токсин, а упомянутый выше P22 — ферменты конверсии О-антигена сальмонеллы, позволяя ей уходить от иммунного надзора.
В составе фагов обнаруживают другие МГЭ (например, транспозоны, несущие гены антибиотикорезистентности) и их модули (системы репликации и переноса конъюгативных плазмид). Самый известный пример слияния модулей фагового и плазмидного происхождения — фаг Р1, способный реплицироваться и длительно поддерживаться вне хромосомы, ничем не отличаясь от плазмиды. Профаги разных бактерий детально рассмотрены в обзоре [8].
Плазмиды — маленькие гиганты больших процессов
Плазмиды — внехромосомные двуцепочечные молекулы ДНК, способные к длительному автономному существованию в клетках прокариот и некоторых эукариот. Чаще всего плазмидные ДНК суперскручены и ковалентно замкнуты в кольцо, однако у актиномицетов и спирохет встречаются и линейные формы, что обычно сочетается с линейной организацией хромосом. Размер плазмид обычно варьирует от 0,85 т.п.н. (pRKU1 из Thermotoga petrophila) до 600 т.п.н., но у бруцелл и ризобий описаны мегаплазмиды размером более 1 млн п.н., что иногда делает вопрос их дифференцировки от дополнительных хромосом риторическим [9]. Элиминация мегаплазмид, в отличие от хромосом, обычно не вызывает фатальных для бактериальной клетки последствий, однако вместе с плазмидами могут утратиться такие важные функции, как способность к фиксации азота и формированию симбиотических клубеньков (у ризобий).
На долю плазмидной ДНК может приходиться 1–15% наследственной информации бактериальной клетки, однако известны случаи, когда плазмидами контролируется до 25% (у некоторых Archaea) и даже до 40% информации (2 мегаплазмиды размером около 1,4 и 1,6 млн п.н. у Sinorhizobium meliloti).
Не являясь обязательными элементами генома, плазмиды обеспечивают селективное преимущество содержащим их микроорганизмам при освоении различных экологических ниш. При стабильном поддержании в клетке они «даруют» хозяину устойчивость к антибиотикам (R-плазмиды), солям тяжёлых металлов, ультрафиолетовому облучению, кодируют факторы патогенности, пути биосинтеза антибиотиков и бактериоцинов, системы рестрикции-модификации, симбиотические факторы, пути деградации органических и неорганических соединений (D-плазмиды), фиксации атмосферного азота [2]. Недавно показано, что некоторые плазмиды, кодируя специфические регуляторы транскрипции (AraC-, H-NS-типов и др.), могут изменять экспрессию и хозяйских генов.
Участие плазмид в ГГП обусловлено свойствами плазмидного «остова», в состав которого входят области, обеспечивающие инициацию репликации (rep-oriV, иногда — cop), стабильное наследование (у многих плазмид за это отвечают локусы par и mrs, системы постсегрегационной гибели бесплазмидных клеток), а также кластеры, обеспечивающие миграцию плазмид — системы мобилизации и конъюгации (mob, tra). Плазмиды классифицируют по размеру, копийности, кодируемым фенотипическим признакам и т.д., однако филогенетически обоснована только классификация по группам несовместимости на основе гомологии области rep-oriV.
Плазмидами часто мобилизуются сосуществующие с ними в одной клетке неконъюгативные МГЭ (но обладающие как минимум сайтом начала переноса oriT, а чаще и генами mob) и даже хромосомы. Мобилизация генов хромосомы возможна в случае интеграции в неё конъюгативной плазмиды. Это возможно, когда в обеих молекулах присутствуют одинаковые инсерционные последовательности (IS-элементы), обеспечивающие гомологичную рекомбинацию (типичный пример — F-фактор E.coli). Однако интеграция может быть и RecA-независимой, если плазмида кодирует тирозиновую интегразу (плазмиды стрептомицетов pSE101, pSAM2 и псевдомонад pKLK106). В этом случае интеграция чаще происходит в гены тРНК, но в некоторых хозяевах эта закономерность нарушается [3].
Плазмиды служат донорами функциональных модулей для других МГЭ (рис. 1), в результате чего формируются сложные мобильные мозаичные конструкции, осваивающие новые геномы. Плазмидные репликоны — «каркасы» многочисленных векторных систем и прекрасные модели для изучения механизмов экспрессии наследственной информации.
Транспозоны — универсальные генетические челноки
Транспозоны — МГЭ, перемещающиеся как в пределах одной молекулы ДНК, так и между разными репликонами одного генома (конъюгативные транспозоны — и между геномами). Фланкированы инвертированными повторами, а в центральной части содержат гены, ответственные за перемещение. Транспозоны прокариот подразделяют на IS-элементы, Tn-элементы и Mu-подобные фаги [10].
Интегроны — природные системы клонирования и экспрессии
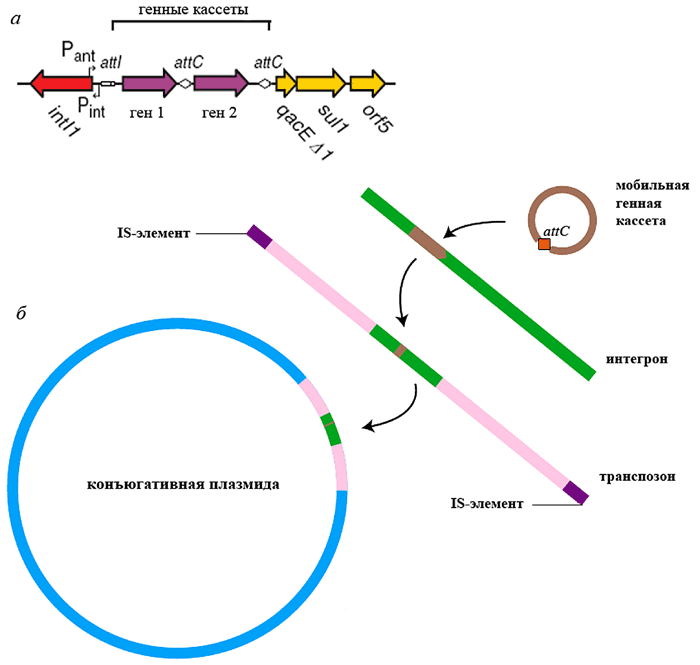
Интегроны представляют собой «заякоренные» в транспозонах, плазмидах и хромосомах «платформы», включающие ген intI тирозиновой рекомбиназы (интегразы), промотор и сайт интеграции attI для «улавливаемых» генных кассет — ДНК-сегментов, содержащих только беспромоторную ОРС с уникальным рекомбинационным сайтом attC (рис. 3, а).
В процессе перемещения от одного интегрона к другому или от одного сайта в интегроне к другому сайту, генная кассета существует как автономная и неспособная к репликации двунитевая кольцевая молекула ДНК. Кассеты, захватываемые интегронами и суперинтегронами, могут содержать гены факторов патогенности, метаболических путей, детерминанты антибиотико- и дезинфектантоустойчивости или гены рестрикционных ферментов. Интеграза IntI катализирует сайт-специфическую рекомбинацию между сайтами attI и attC, в результате чего происходит интеграция или вырезание кассеты. Множество событий интеграции ведет к образованию мультикассетных рядов, в которых все кассеты фланкированы attC-сайтами. Известны хромосомные суперинтегроны, включающие до 179 генных кассет (у Vibrio cholerae), однако среди клинически значимых бактерий большинство интегронов содержит до 5–8 генных кассет. Наиболее эффективно экспрессируются кассеты, расположенные ближе к промотору, но изменение селективного давления может способствовать перестройкам в составе интегрона.
Рисунок 3. Интегрон — ДНК, улавливающая генные кассеты и распространяемая в составе более высокоорганизованных МГЭ. а — Структура интегрона класса 1. Pint — промотор интегразы, Pant — промотор кассет антибиотикорезистентности. Остальные элементы объяснены в тексте; б — Иерархическая организация МГЭ.
Все интегроны, несущие кассеты антибиотикорезистентности, разделяют на 5 классов на основании гомологии последовательностей кодируемых ими интеграз. Большинство интегронов антибиотикорезистентности относится к классу 1 (часто ассоциированы с Tn21-семейством). Они включают два концевых невариабельных региона, называемых константными последовательностями (constant sequences, CS), и высоковариабельный центральный участок. В одном конце интегрона (5’-CS), обычно находятся intI, attI и промотор, от которого экспрессируются гены кассеты. В другом конце (3’-CS), находится часть гена qacEΔ1, который, будучи интактным, несёт устойчивость к четвертичным аммониевым соединениям. За ним расположен ген sul, определяющий резистентность микроорганизма к сульфаниламидам, и 1–2 гена с неустановленной функцией — orf5 и иногда orf6 (рис. 3, а). Интегроны класса 2 ассоциированы с Tn7-семейством, классов 3 и 5 — с плазмидами, класса 4 — с конъюгативным геномным островом SXT Vibrio cholerae.
Не являясь «самораспространяемыми» элементами, интегроны активно переносятся в бактериальных популяциях за счёт МГЭ, в которых они локализованы (рис. 3, б), подвергаются рекомбинации (известны химерные интегроны из модулей разных классов), деградации, «улавливают» новые кассеты, причем функции огромного числа кассет до сих пор не известны [13].
Геномные острова — «пластилин» для эволюционного процесса
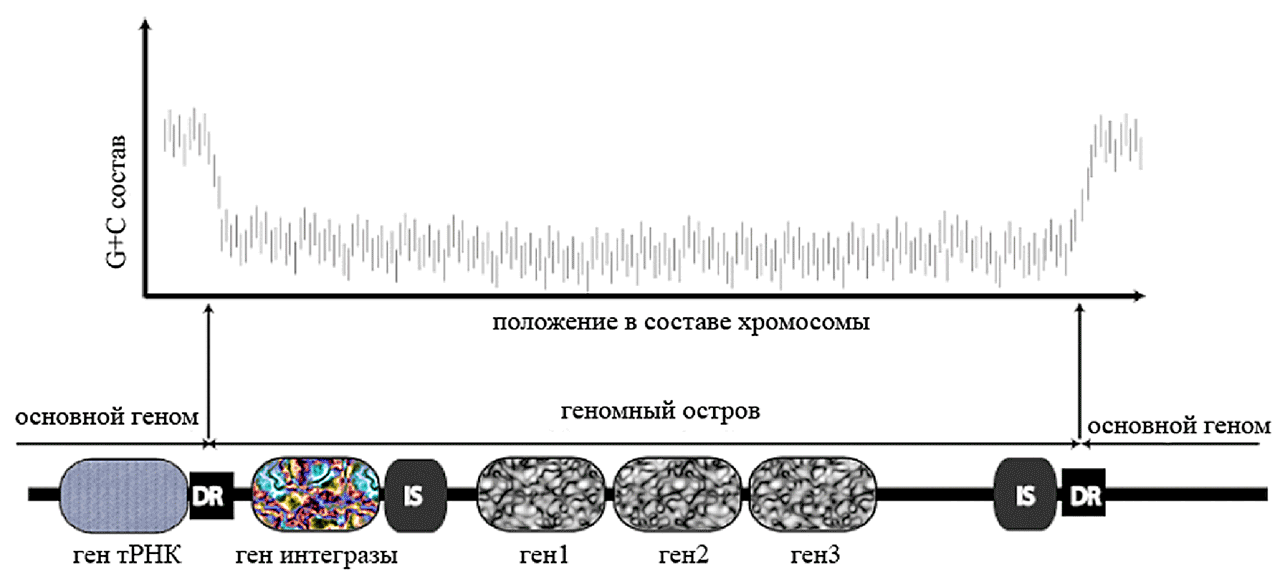
Геномные острова (genomic islands, ГО) — сегменты ДНК, присутствующие в геноме одних штаммов и отсутствующие у других, даже близкородственных штаммов одного вида. Строение «усредненного» ГО показано на рис. 4. Для геномных островов характерно:
Рисунок 4. Схематическое изображение структуры геномного острова в составе бактериальной хромосомы. DR — прямые повторы ДНК хромосомы, фланкирующие ГО; IS — инсерционные элементы.
Недавно у штаммов клона С Pseudomonas aeruginosa был обнаружен ГО — pKLC102 (103,5 т.п.н.) — плазмидно-фаговый гибрид, предположительно несущий детерминанты патогенности, способный существовать как в интегрированном в хромосому состоянии, так и в форме автономной плазмиды [15]. Различные ОРС pKLC102 гомологичны типичным генам бактерий, ассоциированных с ризосферой растений, что может указывать на эволюционирование этого ГО в соответствующих микробных сообществах. У некоторых штаммов клона С, выделенных из лёгких больных муковисцидозом, этот ГО был необратимо «заякорен» в хромосоме из-за внедрения в него транспозона TNCP23 (химера из IS6100, интегрона класса 1 и плазмиды), что вело и к крупным хромосомным инверсиям. Внедрению транспозона, несущего интегрон с кассетой устойчивости к аминогликозидам, видимо, способствует лечение больных муковисцидозом соответствующими антибиотиками.
Геномные острова гонококков (GGI) кодируют систему секреции типа IV (T4SS), родственную плазмидным системам конъюгационного переноса. Посредством T4SS распространяется не только сам элемент и его продукты, но секретируется в окружающую среду и хромосома Neisseria gonorrhoeae, которая затем может трансформировать другие бактерии и участвовать в рекомбинационных событиях.
Помимо островов патогенности огромный интерес представляют «экологические» острова β- и γ-протеобактерий, многие из которых конъюгативны и кодируют ферменты биодеградации хлорированных и нитроароматических соединений. В частности, clc-элемент из Pseudomonas sp. B13 несёт amn-кластер биодеградации аминофенола.
Эксцизия, а, следовательно, и распространение ГО, строго регулируется. Часто это происходит под quorum-sensing-контролем («чувством кворума») в стационарной фазе бактериального роста. Мобилизация многих ГО происходит в результате SOS-ответа на повреждения ДНК, вызванные антибиотиками (SXT-элемент V. cholerae, способный мобилизовать и «приютившую» его ДНК) или другими факторами среды [14].
Главные нарушители границ и их мекка
Крупнейшие из самых подвижных «платформ» для сборки всевозможных мобильных элементов и модулей — плазмиды и бактериофаги, но последние обычно имеют очень ограниченный круг хозяев. Плазмиды — более широко представленный и разнообразный МГЭ прокариотического мира, поскольку этот элемент способен преодолевать не только межвидовые барьеры, но и междоменные (энциклопедический пример — Ti-плазмиды Agrobacterium tumefaciens, инфицирующие эукариотические клетки). Плазмидные модули входят в состав конъюгативных транспозонов и геномных островов (рис. 1), а в самих плазмидах находят приют IS-элементы, транспозоны, интегроны, фаговые модули и даже геномные острова. Оказалось, что влияния ГГП не избежали и внутриклеточные паразиты, которые, считалось, должны быть изолированы от потенциальных доноров ДНК: конъюгативные плазмиды, причастные к вирулентности, обнаружены у Rickettsia felis, как найдены плазмиды и у внутриклеточной бактерии Buchnera — эндосимбионта тли.
Можно выделить несколько «горячих точек» ГГП: ризосфера растений, биоплёнки, разлагающиеся материалы, клетки простейших (жизнеспособные Chlamydiae и Rickettsia обнаружены в амёбах) [16]. Всё перечисленное можно встретить в отстойниках (станциях очистки воды), где смешиваются сточные воды различного происхождения, в т.ч. больничные и фармпроизводств, обеспечивающие селективное давление для обмена МГЭ в условиях высокой бактериальной плотности и метаболической активности. Процесс трансформации клеток молекулами ДНК происходит в среде постоянно. Свободная ДНК может сохраняться в окружающей среде тысячелетиями, а природной компетентностью обладает как минимум 90 видов почвенных и водных прокариот. Однако ведущую роль в распространении между бактериями детерминант резистентности и биодеградации играют конъюгативные и мобилизуемые плазмиды.
Из обитателей отстойников, а что самое опасное — из бактерий вод, уже прошедших очистку, — в большом количестве выделяют плазмиды IncP-1-группы несовместимости (в системе классификации плазмид псевдомонад) [12]. Эти относительно небольшие молекулы дарят хозяевам массу селективных преимуществ (от множественной резистентности до биодеградации хлорорганики) и способны распространяться не только среди псевдомонад, но и практически всех грамотрицательных и некоторых грамположительных бактерий. Кроме того, они способны мобилизовать неконъюгативные R-плазмиды (например, IncP-4) к переносу в ещё более широкий спектр бактерий, а также в дрожжи и клеточные линии млекопитающих [17].
Селективное давление, оказываемое присутствием в сточных водах как лекарств, так и нефтепродуктов, тяжёлых металлов и сурфактантов, стабилизирует соответствующую плазмидную ДНК в бактериальных популяциях отстойников. Интересно, что возможна неспецифическая, «побочная», селекция R- и D-плазмид присутствием тяжёлых металлов, устойчивость к которым часто кодируется плазмидами этих двух типов. Возможна и селекция R-плазмид присутствием в среде детергентов, содержащих четвертичные аммонии: детерминанты антибиотикорезистентности и ген qacEΔ1 часто «соседствуют» в плазмидных интегронах. Кроме того, кодируемые R-плазмидами эффлюкс-помпы бактерии используют не только для выброса поступающих в клетку антибиотиков, но и для транспортировки других соединений, поэтому даже при отсутствии в среде антибиотиков соответствующие плазмиды могут оказаться полезными и стабильно поддерживаться в бактериальных популяциях. Отстойники, по сути, служат котлами по переплавке геномов, где под множественным селективным давлением происходит обмен наследственной информацией между патогенными и сапротрофными микроорганизмами, отбор оптимальных комбинаций генов, которым ничто не мешает распространяться за пределами очистных сооружений. И именно плазмиды играют важнейшую роль в поддержании бактериального «коммунального генетического пула» [9].
Биология плазмид в России и за рубежом. Что же можно возвести на крепком фундаменте?
Несмотря на колоссальный вклад плазмид в распространение бактериальной резистентности, в биодеградативный потенциал среды, в эволюцию геномов и биотехнологию, заниматься изучением этих молекул в России теперь не модно. Показательно, что в огромной стране работает всего одна (!) лаборатория, специализирующаяся на биологии плазмид (ИБФМ РАН, г. Пущино). Особо неблагодарное дело — исследовать не антибиотикорезистентность, практическая значимость которой так очевидна, а фундаментальные процессы — репликацию, сегрегацию, конъюгацию. Но именно эти процессы позволяют исследователю заглянуть в «эволюционные ясли» механизмов наследственности, лежат в основе классификации плазмид и определяют возможность поддержания клинически/биотехнологически важных признаков в конкретной бактериальной популяции.
Как же относятся к плазмидам зарубежные биологи? Статьи коллективов из Японии, Германии и Испании, посвящённые структуре и функционированию внехромосомных ДНК бактерий, регулярно появляются на страницах таких авторитетных изданий, как Nature, Journal of Bacteriology, EMBO и др. В последние годы признанных экспертов в области биологии плазмид «догнали» учёные из США, Китая, Польши, Белоруссии.
Как и в любой другой науке, практически и мировоззренчески ценные открытия в биологии плазмид опираются на возводимый десятилетиями теоретический фундамент. В этом отношении показательна «биография» плазмиды pPS10 фитопатогена Pseudomonas savastanoi. Испанские биологи копили знания о механизмах её поддержания 30 лет! В итоге на базе белка-инициатора репликации этой плазмиды (RepA) была разработана модель для изучения амилоидных протеинопатий, наблюдаемых при нейродегенеративных заболеваниях человека [18]. Кроме того, обнаружение структурного сходства белка RepA с компонентами эукариотического origin recognition complex заставило учёных выдвинуть предположение о слиянии на каком-то эволюционном этапе гена инициатора репликации хромосомы общего предка эукариот и архей и гена repA бактериальных плазмид типа pPS10 [19]. Таким образом, некоторые молекулярные модули эукариотических организмов, включая человека, могут быть унаследованы напрямую от плазмид прокариот.
Внушителен и «послужной список» плазмиды биодеградации карбазола pCAR1: японские микробиологи по ней написали не менее пяти работ, причём именно гены биодеградации их интересовали в последнюю очередь, а в первую — механизмы поддержания и распространения, взаимодействие с бактериальной хромосомой. Авторы «CARологии» показали, например, что глобальный регулятор транскрипции H-NS-семейства, кодируемый pCAR1, модулирует экспрессию хромосомных генов, в том числе, усиливает транскрипцию mexEF-oprN-оперона (гены эффлюкс-системы), повышая устойчивость бактерии-хозяина к антибиотикам [20].
С годами становится ясно, что самое интересное лежит не на поверхности. Связь плазмид с распространением антибиотикорезистентности очевидна, и соответстующие гены изучаются давно, однако борьба с этим опасным явлением пока успехом не увенчалась. И вот тут-то на помощь могут прийти всё те же, такие «неинтересные», области rep-ori-par, ответственные за поддержание плазмидной ДНК. Именно их рассматривают в качестве мишеней антиплазмидной терапии, которой в перспективе можно было бы дополнить лечение некоторых бактериальных инфекций.
Потенциал мобильных элементов прокариот как объектов исследования почти неиссякаем. На какие же аспекты функционирования «мобильного социума» будут направлены взгляды учёных в будущем? Разумеется, микробиологи продолжат «вербовать» эти элементы для удовлетворения биотехнологических нужд общества (векторы, препараты для биоремедиации) и искать способы борьбы с негативными для человека последствиями горизонтального генетического переноса (бактериальная резистентность и вирулентность). В то же время, внимание научного сообщества будет направлено и на дальнейшее вскрытие вклада МГЭ в эволюцию организмов. В ближайшие годы также прогнозируется массовое обращение микробиологов к мобилому кишечной микрофлоры: публикации о циркуляции плазмид в этих загадочных бактериальных коллективах уже появляются в респектабельных изданиях. Поиски будут направлены, в том числе, на выяснение роли МГЭ наших симбионтов в формировании метаболических путей и развитии заболеваний.