Буферный раствор для чего используют
БУФЕРНЫЕ РАСТВОРЫ
БУФЕРНЫЕ РАСТВОРЫ (буферные смеси, буферы) — растворы, содержащие буферные системы и обладающие вследствие этого способностью поддерживать pH на постоянном уровне. Б. р. применяются для сохранения активной реакции среды (см.) на определенном неизменном уровне, если тот или иной процесс (напр., выращивание культуры бактерий, проведение ферментативной реакции и т. п.) должен быть проведен при постоянном pH; для определения водородного показателя (см.) — в качестве стандартных растворов с известными и устойчивыми значениями pH и в других случаях лабораторной практики.
Б. р. обычно готовят путем растворения в воде взятых в соответствующих пропорциях слабой кислоты и ее соли, образованной щелочным металлом, частичной нейтрализацией слабой кислоты сильной щелочью или слабого основания сильной кислотой, растворением смеси солей многоосновной кислоты. Величины pH приготовленных таким образом Б. р. незначительно меняются с температурой. Б. р., представляющие собой смеси слабых оснований с их солями, образованными сильными кислотами, ввиду значительной зависимости их pH от температуры, как правило, применяются на практике редко. Общая концентрация компонентов Б. р., употребляемых для практических целей, в большинстве случаев находится в пределах 0,05— 0,2 н. Такого рода Б. р. проявляют буферное действие, если отношение концентраций составляющих их слабых кислот к концентрациям соответствующих солей не меньше 0,1 и не больше 10. Интервал значений pH, в к-ром Б. р. обладает устойчивыми буферными свойствами, лежит в пределах рК±1 (рК — отрицательный десятичный логарифм константы диссоциации слабой кислоты, входящей в состав Б. р., т. е. рК= —lgK). Т. о., для приготовления Б. р., проявляющего буферное действие, напр, в области pH=3—5, следует взять кислоту с рК=4.
СОСТАВ НАИБОЛЕЕ РАСПРОСТРАНЕННЫХ БУФЕРНЫХ РАСТВОРОВ, ПРИМЕНЯЕМЫХ В ЛАБОРАТОРНОЙ ПРАКТИКЕ
1. Глициновый буфер Серенсена
Соляная кислота — у
2. Ацетатный буфер Вальполя
Уксусная кислота — х
3. Фосфатный буфер Серенсен
4. Боратный буфер Палича
5. Вероналовый буфер Михаэлиса
Соляная кислота — y
6. Карбонатный буфер Кольтгоффа
Соляная кислота — х
7. Универсальный вероналовый буфер Михаэлиса
Соляная кислота — х
Соляная кислота — х
Количества компонентов, необходимых для приготовления определенного Б. р., рассчитывают по уравнению соответствующей буферной системы или находят с помощью специальной таблицы (см. выше).
При пользовании таблицей следует иметь в виду: В левом вертикальном столбце перечислены наименования Б. р. и их составных частей (x, y).
Во всех горизонтальных рядах, соответствующих тому или иному Б. р., верхняя цифра обозначает искомые значения pH, нижние цифры (или цифра) — объем (в мл) составных частей (части) Б. р. (z, у). Значения х и у соответствуют объемам (в мл) каждого из компонентов Б. р. Напр., для получения Б. р. с pH 1,15 (второй цифровой столбец вверху) следует взять 1,0 мл раствора глицина и 9,0 мл HCl (из расчета приготовления 10,0 мл смеси).
Глициновый буфер Серенсена представляет смесь соответствующих объемов 0,1 М раствора глицина в 0,1 М растворе NaCl и 0,1М раствора HCl. Ацетатный буфер Вальполя — это смесь 0,2 М раствора уксусной к-ты и 0,2М раствора ее натриевой соли. Фосфатный буфер Серенсена готовят смешиванием М/15 растворов NaH2PO4 и Na2HPO4. Боратный буфер Палича — смесь соответствующих объемов 0,2 М раствора борной к-ты и 0,05 М раствора буры. Для приготовления вероналового буфера Михаэлиса используют 0,1 М раствор Na-веронала и 0,1 М раствор HCl.
Для приготовления карбонатного буфера Кольтгофа на каждые 50 мл 0,1 М раствора углекислого натрия берут х мл 0,1 М раствора HCl и доводят объем полученной смеси до 100 мл.
Для приготовления универсального вероналового буфера Михаэлиса растворяют в воде 9,714 г ацетата натрия (CH3COONa-3H2O) и 14,714 г диэтил барбитурата натрия. Объем раствора доводят дистиллированной водой до 500 мл. На каждые 5 мл раствора добавляют 2 мл 8,5% раствора хлорида натрия, х мл 0,1 М соляной к-ты и (18—х) мл дистиллированной воды.
Для приготовления трис-буфера используют раствор а — 24,3 г трис-(гидроксиметил)-аминометана в 1 л дистиллированной воды и раствор б — 0,1 н. HCl.
При приготовлении любых Б. р. следует употреблять очень чистые исходные вещества. Способность Б. р. сопротивляться изменению pH определяется его буферной емкостью, измеряемой количеством грамм-эквивалентов сильной кислоты или сильной щелочи, к-рое необходимо добавить к 1 л Б. р., чтобы изменить его pH на единицу. При неизменной величине отношения концентраций компонентов Б. р. его буферная емкость возрастает с увеличением концентрации этих компонентов.
Значение Б. р. для мед. практики — см. Буферные системы.
Библиография: Калинин Ф. Л., Лобов В. П. и Жидков В. А. Справочник по биохимии, с. 882, Киев, 1971; Швабе К. Основы техники измерения pH, пер. с нем., М., 1962.
Буферный раствор – химический реактив с постоянным pH
Буферный раствор – химический реактив с постоянным pH
Лабораторная посуда, лабораторное оборудование, приборы и химические 
В практике проведения лабораторных работ сотрудники часто сталкиваются с такими химическими растворами, которые имеют или должны обладать определенным показателем величины pH. Именно для этих целей изготавливают специальные буферные растворы.
Что представляет собой данный раствор?
Буферные растворы – химические реактивы с определенным стабильным показателем концентрации водородных ионов; смесь слабо концентрированной кислоты и ее соли. Данные растворы практически не изменяют свою структуру при концентрировании, разбавлении ее другими химическими реагентами или при добавлении в него в малом количестве высококонцентрированных щелочей или кислот. Чтобы получить буферный раствор с различным показателем pH, необходимо изменять концентрацию и соотношение используемых химических растворов.
Данный химический реактив способен сохранять определенный показатель pH до определенного уровня, в зависимости от конкретного количества агрессивных сред, щелочей и кислот. У каждой буферной смеси есть определенная буферная вместимость – эквивалентное соотношение количества элементов щелочи и кислоты.
К сожалению, сами кислоты и щелочи нельзя отнести к буферным смесям, так как при разбавлении их с водой уровень pH данных агрессивных сред изменяется.

Для работы как в лабораторных условиях, так и в частной практике, рекомендуется использование буферных смесей высокой стабильности, приготовленные в специализированных лабораториях с использованием лабораторной посуды из стекла на специальном лабораторном оборудовании и приборах. Самостоятельное приготовление данного химического реактива может быть получено с большой погрешностью.
Из чего состоит буферный раствор?
В состав этого химического реактива входит вода – растворитель и в равной степени 
Такие химические реактивы вместе с современным лабораторным оборудованием и приборами нашли широкое применение в исследованиях аналитической химии, биологии и микробиологии, генетике, медицине, фармацевтике, исследовательских центрах и других научных областях.
Важность буферного раствора для человека
Естественная буферная смесь очень важна и для нормальной жизнедеятельности организма, так как благодаря ей поддерживается постоянный уровень pH биологических жидкостей тканей, органов, лимфы и крови.
Хранить данный химический реактив необходимо в герметически закрытой емкости (стеклянных или пластиковых флаконах).
Где приобрести лабораторное оснащение высокого качества по доступной цене?
Химреактивы, приборы, оборудование, лабораторную посуду купить в Москве выгодно в современном специализированном магазине химических реактивов Москва розница и опт «Прайм Кемикалс Групп». Именно здесь Вы найдете широкий ассортимент товаров высокого качества от известных торговых марок по приемлемым ценам. Также у нас возможна доставка как по городу, так и по области.
“Prime Chemicals Group” –лабораторное оснащение от перчаток смотровых до весов электронных лабораторных со знаком качества.
Буферный раствор
Буферный раствор (рус. Буферные раствор, англ. Buffer solution, нем. Pufferlösung f) — водный раствор, содержащий соединения, которые противостоят значительном изменении pH при добавлении небольшого количества кислоты или основания.
Общее описание
Иногда понятие «буферный раствор» используется в более широком смысле: для растворов, имеющих любой постоянный параметр (окислительно-восстановительный потенциал, активность ионов кальция и т.д.), почти не меняется при незначительном изменении состава системы, например при концентрирования, разбавления, добавлении небольших количеств посторонних соединений. Стабильность достигается благодаря тому, что компоненты буферной системы находятся в состоянии химического равновесия.
Буферы широко используются в химических, биологических и медицинских лабораториях для поддержания устойчивого pH среды, в которой происходят химические реакции. Они также входят в состав большого количества промышленных товаров, таких как некоторые медицинские препараты (например забуференный аспирин), средства для ухода за кожей и волосами и тому подобное. Буферные растворы необходимы для обеспечения гомеостаза живых организмов, например pH крови человека поддерживается на постоянном уровне, оптимальном для транспорта кислорода (около 7,4), благодаря нескольким буферным системам.
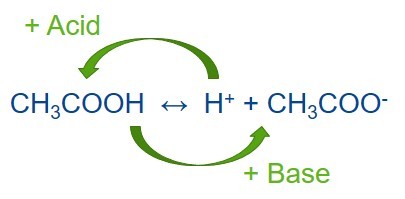
Для обеспечения устойчивого pH буфер должен содержать два соединения: одну, которая бы препятствовала уменьшению концентрации ионов H 3 O — (или упрощенно — H +), а другая — которая препятствовала ее увеличению, при этом они не должны нейтрализовать друг друга. По используется пара слабая кислота (донор протонов) / ее сопряженная основа (акцептор протонов) в примерно одинаковых концентрациях, и значительно реже — слабое основание / сопряженная с ней кислота. Буферные растворы часто делают на основе пар уксусная кислота / ацетат, дигидрогенфосфат / моногидрогенфосфат, угольная кислота / гидрокарбонат и др.
Механизм действия буферных систем
С другой стороны, при добавлении небольшого количества щелочи, поставляет ионы OH — в раствор, с ними взаимодействовать слабая кислота
Эти две оборотные реакции и обеспечивают буферные свойства раствора: добавление к раствору ионов H + или OH — влечет изменение соотношения слабой кислоты и сопряженной основе и совсем незначительное смещение pH.
Достаточно распространенное заблуждение о том, что буферные растворы способны поддерживать pH на абсолютно постоянном уровне. На самом деле это не так, добавление даже небольшого количества кислоты или щелочи к такому раствора приводит к изменению водородного показателя, но очень незначительной. Например, если добавить к 1 л чистой воды 0,01 моль соляной кислоты, то ее pH изменится от 7,0 до 2,0, то есть на 5 единиц, с другой стороны, при добавлении такого же количества кислоты в 1 л буферного раствора, его pH может измениться всего на 0,1.
Буферная емкость и область буферирования
PH буферного раствора
pH буферного раствора при известной соотношение между количествами слабой кислоты и сопряженной основы можно определить, используя уравнения Гендерсона-Гассельбаха:

Так что для приготовления буфера с желаемым pH можно выбрать слабую кислоту (или основу) с максимально приближенным значением pK a и рассчитать по уравнению Гендерсона-Гассельбаха соотношение кислоты и сопряженной основы, которые нужно смешать. Возможно также использовать и другие пути: например, титровать раствор слабой кислоты сильной щелочью, или ее соли сильной кислотой до нужного pH.
Изменение pH буферного раствора при добавлении сильных кислот или оснований
Чтобы вычислить, как изменится pH буферного раствора при добавлении известного количества сильной кислоты или основания, следует сначала использовать принципы стехиометрии, чтобы выяснить количество одного компонента буферного раствора при этом превратится в другой. Предполагается, что реакция нейтрализации происходит до конца (например, если в ацетатного буфера добавить 0,1 моль гидроксида натрия, то можно считать, что количество уксусной кислоты в растворе уменьшится на 0,1 моль, а количество ацетата увеличится на такое же значение). Полученные значения новых концентраций компонентов буфера можно подставить в уравнение Гендерсона-Гассельбаха для вычисления равновесного значения pH.
Практическое значение pH буферов
Буферные системы существуют внутри всех живых клеток, так как большинство из химических превращений, происходящих в них зависящие от pH. С этой же причине в лабораториях при исследовании свойств белков, особенно ферментов, нуклеиновых кислот и других биомолекул всегда используют pH буфера.
pH буфера широко используются во многих отраслях промышленности и в лабораторной практике. Например, один из первых этапов пивоварения — измельчение солода — должен происходить при pH от 5,0 до 5,2. С изготовлением пива связано и само открытие шкалы pH, поскольку ее изобретатель Сорен Соренсон работал исследователем на пивоварне.
Буферные системы крови человека
pH крови человека в среднем составляет 7,4, изменение этого значения даже на одну десятую единицы приводит к тяжелым нарушениям (ацидоза или алкалоза). Когда водородный показатель выходит за пределы диапазона 6,8 ÷ 7,8, это обычно ведет к гибели. Важнейшее буферная система крови — угольная (HCO-3 / H 2 CO 3), вторая по значению — фосфатный (HPO2-4 / H 2 PO-4), также определенную роль в поддержании pH играют белки.
PH буфера в биологических лабораториях
| Буферный агент | pK a |
| Трис | 8,3 |
| TES | 7,55 |
| HEPES | 7,55 |
| MOPS | 7,2 |
| PIPES | 6,8 |
В экспериментах с биохимии и молекулярной биологии первично использовались обычные буфера на основе слабых кислот и их сопряженных оснований, такие как цитратные, ацететни, фосфатные. Однако они имели ряд недостатков, таких как довольно значительное изменение pH при разведении или изменении температуры, проникновения их компонентов через клеточные мембраны и влияние на физиологические процессы. Поэтому на смену им стали применять буферы на основе других веществ, например основы трис (гидроксиметил) аминометану (сокращенно трис), цвиттер-ионной соединения MOPS и тому подобное.
Норман Гуд разработал серию буферов на основе соединений, молекулы которых могут находиться в состоянии цвиттерионив, таких как HEPES, PIPES, MES. Гуд отбирал буферные агенты на основе таких желательных признаков как: значение pK a в диапазоне 6 ÷ 8, соответствует физиологическим значением pH, высокая растворимость в воде, нерастворимость в полярных соединениях, непроницаемость через мембраны, малое влияние на ионную силу раствора, максимальная независимость диссоциации от температуры и концентрации, стабильность, легкость в приготовлении. Также буферные агенты не должны поглощать видимый и ультрафиолетовый свет с длиной волны более 230 нм, чтобы не препятствовать стандартным методам спектрофотометрии. Ни одна из известных соединений не подходит идеально под все описанные признаки, однако имеющийся выбор буферных агентов позволяет выбрать нужный для каждой конкретной задачи.
Другие типы буферных систем
В химическом анализе применяют и другие буферные системы: окислительно-восстановительные буферные растворы для образования и сохранения окислительно-восстановительного потенциала, например, на основе смеси солей Fe (II) и Fe (III); кальциевый буферный раствор для образования и сохранения активности катионов кальция, например на основе смеси эквимолярной количества дигликоляту натрия и кальция или натриевой и кальциевой солей нитрилацетатнои кислоты. В ионометрии широко используются буферные растворы для образования общей ионной силы раствора (БРЗИС).
Буферный раствор постоянной ионной силы
Буферный раствор с высокой ионной силой, которая прилагается к аналiзованого и калиброванного растворов с целью обеспечения в них одинаковой ионной силы при равной активности йонiв Н + в этих растворах.
Буферный раствор
Буферные растворы имеют большое значение для протекания процессов в живых организмах. Например, в крови постоянство водородного показателя рН поддерживается буферными смесями, состоящими из карбонатов и фосфатов. Известно большое число буферных растворов (ацетатно-аммиачный буферный раствор, фосфатный буферный раствор, боратный буферный раствор, формиатный буферный раствор и др.).
Значение pH буферного раствора можно рассчитать по формуле: 


См. также
Полезное
Смотреть что такое «Буферный раствор» в других словарях:
БУФЕРНЫЙ РАСТВОР — БУФЕРНЫЙ РАСТВОР, раствор, к которому можно добавить умеренное количество сильной кислоты или сильного основания без существенных изменений его рН (кислотности или щелочности). Обычно состоят из смеси либо слабой кислоты с одной из ее солей,… … Научно-технический энциклопедический словарь
Буферный раствор — Раствор с определенной устойчивой концентрацией водородных ионов, представляющий собой смесь слабой кислоты и ее соли или слабого основания и его соли и используемый для воспроизведения и поддержания числовых значений рН в растворах различного… … Словарь-справочник терминов нормативно-технической документации
буферный раствор — buffer буфер, буферный раствор. Pаствор, обеспечивающий сохранение показателя рН (или каких либо других его показателей) на постоянном уровне; Б. широко применяются в большинстве генетических и цитогистологических методик, имеющих дело с жидкими… … Молекулярная биология и генетика. Толковый словарь.
Буферный раствор — Buffer Буферный раствор. (1) Вещество, которое при добавлении или присутствии имеет тенденцию минимизировать физические и химические эффекты тех или иных количеств материалов в смеси. Часто свойства, оказывающие буферное действие, включают рН,… … Словарь металлургических терминов
буферный раствор — buferinis tirpalas statusas T sritis chemija apibrėžtis Tirpalas, palaikantis tam tikrą pH, redokso potencialą, metalo jono koncentraciją ar kitą terpės charakteristiką. atitikmenys: angl. buffer; buffer solution rus. буфер; буферный раствор… … Chemijos terminų aiškinamasis žodynas
БУФЕРНЫЙ РАСТВОР — поддерживает при изменении состава среды постоянство значения к. л. характеристики, напр. рН (кислотно основной Б. р.) или окислит. восстановит. потенциала (окислит. восстановит. Б. р.). Значение рН кислотно основного Б. р. зависит от… … Химическая энциклопедия
буферный раствор — буферная смесь, буфер … Cловарь химических синонимов I
буферный раствор для корректировки общей ионной силы — — [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN total ionic strength adjustment buffer solution … Справочник технического переводчика
буферный раствор, поддерживающий постоянную общую ионную силу (БРОИС) — 3.6 буферный раствор, поддерживающий постоянную общую ионную силу (БРОИС): Буферный раствор с высокой ионной силой, добавляемый к анализируемому и контрольным растворам для выравнивания их ионной силы. Примечание Для некоторых электродов состав… … Словарь-справочник терминов нормативно-технической документации
Буфер буферный раствор — Буфер, буферный раствор * буфер, буферны раствор * buffer раствор, содержащий смесь слабой кислоты и щелочи, который препятствует изменению концентрации ионов водорода (рН) в растворе при добавлении кислоты или щелочи, а также поддерживает… … Генетика. Энциклопедический словарь
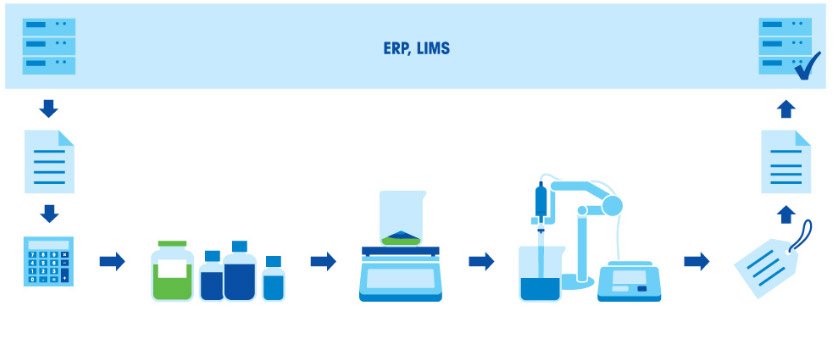
Приготовление буферных растворов
Почему точность взвешивания так важна для качества буферного раствора?
Приготовление буферных растворов — распространенная процедура в химических и биохимических лабораториях. Буферный раствор — это смесь слабой кислоты и сопряженного с ней основания или слабого основания и сопряженной с ним кислоты. Буферные растворы позволяют поддерживать стабильный уровень pH другого раствора, смешанного с буферным. Если в раствор попадает небольшое количество другой кислоты или щелочи или они образуются в ходе химической реакции, буферный раствор не допустит изменения значения pH всего раствора. Поэтому буферы очень полезны в разных задачах, где требуется поддержание стабильного уровня pH. Другие названия буферных растворов — также pH-буферы, водород-ионные буферы или просто буферы.
Например, в крови человека содержатся естественные буферы для поддержания рН в диапазоне от 7,35 до 7,45 — именно при таком уровне могут нормально действовать энзимы. Поскольку активность энзимов зависит от pH, при проведении биохимических анализов необходимо поддержание этого параметра на постоянном уровне. Буферные растворы применяются в шампунях для предотвращения раздражения кожи, в детских лосьонах для противодействия росту бактерий, а также в растворах для контактных линз, чтобы уровень pH жидкости оставался совместимым с уровнем рН глаз.
Приготовление буферного раствора состоит из нескольких этапов: взвешивание компонентов, растворение компонентов, корректировка pH и дополнение до заданного объема. Поскольку итоговое значение pH в буфере зависит от соотношения кислоты и основания, чрезвычайно важно взвешивать компоненты с высокой точностью. Все используемое оборудование (весы, пипетки и рН-метр) должно быть правильно откалибровано и иметь достаточную точность.
Buffer Preparation
Видео: приготовление буферного раствора — простота, удобство и точность
Для приготовления буферного раствора нужны время и особая тщательность, иначе раствор не будет действовать так, как требуется. Если качество продукции или биохимических анализов зависит от качества буферных растворов, ошибки при приготовлении буферов недопустимы.
Посмотрите видео и узнайте, как можно сэкономить время и силы, если готовить буферные растворы с помощью технических весов и рН-метров МЕТТЛЕР ТОЛЕДО.
Перейдите в один из следующих разделов, чтобы узнать больше:
Как готовить буферные растворы? Стандартная процедура
Приготовление буферного раствора состоит из нескольких этапов: расчет концентрации и количества компонентов в соответствии с назначением и нужным объемом раствора; взвешивание компонентов; растворение компонентов; корректировка pH; дополнение до заданного объема; маркировка и документирование; использование раствора или его сохранение для применения в будущем.
Буферный раствор — это раствор, сохраняющий свой показатель pH при добавлении небольшого количества кислоты или основания. Буферный раствор состоит из слабой кислоты и сопряженного с ней основания. Постоянный уровень pH в буферном растворе поддерживается благодаря поглощению протонов, которые высвобождаются в ходе реакции, или высвобождению протонов, если в ходе реакции они поглощаются. К созданию буферных растворов привело открытие того, что частично нейтрализованные растворы слабых кислот или оснований не меняют pH при добавлении к ним небольшого количества сильной кислоты или основания.
Сопряженная кислота — это основание, которое приобрело протон.
A + H + ↔ H + A
Основание + протон ↔ сопряженная кислота
Что происходит после добавления кислоты в буферный раствор?
Когда к равновесной смеси слабой кислоты и ее сопряженного основания добавляется сильная кислота (с большим количеством H+), точка равновесия смещается влево в соответствии с принципом Ле Шателье.
Что происходит после добавления основания в буферный раствор?
Аналогичным образом, если в смесь добавляется сильное основание, то концентрация ионов водорода снижается меньше, чем ожидалось с учетом количества добавляемого основания. Это происходит потому, что точка равновесия смещается вправо, чтобы компенсировать потерю H + в реакции с основанием.
Разновидности буферных растворов
Буферные растворы, состоящие из слабой кислоты и ее сопряженного основания, считаются кислыми и имеют рН 7. Примером щелочного буфера может служить водный раствор гидроксида аммония (слабое основание) и хлорида аммония (сопряженная кислота), имеющий рН 9,25.
На что следует обращать внимание при приготовлении буферного раствора
Буферы работают наиболее эффективно, если их pH примерно равен pH исследуемой системы или раствора. При изучении энзимов в биологии человека необходима система, соответствующая pH крови (7,35–7,45), в противном случае энзимы будут функционировать неправильно. Если у буферной системы pH выходит за пределы требуемого диапазона, это также отрицательно повлияет на анализ.
Поэтому необходимо знать, как приготовить буферные растворы с заданным pH. Это можно сделать несколькими способами:
где pKa — константа диссоциации слабой кислоты;
[A-] — концентрация сопряженного основания в точке равновесия;
[HA] — концентрация кислоты в точке равновесия.
Если в точке равновесия концентрации сопряженного основания и кислоты одинаковы, то pH равно константе диссоциации. В этой точке буферный раствор обладает максимальной буферной емкостью.
Уравнение Гендерсона — Гассельбаха также используется для определения константы диссоциации слабых кислот посредством прямых измерений pH.
Преимущества универсальных буферных растворов
Универсальные буферные растворы состоят из нескольких комбинаций кислотно-основных пар. Это позволяет использовать универсальные буферные растворы для поддержания уровня pH раствора в более широком диапазоне и, следовательно, в более широком круге задач.
Дополнительные советы по приготовлению и использованию буферных растворов