Бронхолитическое средство это что такое
Бронхолитические препараты в терапии болезней органов дыхания
В структуре болезней органов дыхания хроническая обструктивная болезнь легких (ХОБЛ) и бронхиальная астма (БА) являются ведущими причинами заболеваемости и смертности. Патофизиологическую основу обеих нозологических форм составляет бронхиальная обструк
В структуре болезней органов дыхания хроническая обструктивная болезнь легких (ХОБЛ) и бронхиальная астма (БА) являются ведущими причинами заболеваемости и смертности.
Патофизиологическую основу обеих нозологических форм составляет бронхиальная обструкция, для купирования или коррекции которой требуется назначение бронхолитической терапии. Это положение закреплено в международных и национальных руководствах по диагностике и лечению БА и ХОБЛ [1–6].
Необходимо отметить, что БА и ХОБЛ представляют собой два самостоятельных заболевания, которые имеют различные этиологию, патогенез, прогноз, а также требуют разных подходов к лечению. Так, в частности, вентиляционные нарушения при БА характеризуются обратимой бронхиальной обструкцией и бронхиальной гиперреактивностью, что обусловливает целесообразность применения бронхолитиков, использующихся при этом заболевании. Напротив, бронхиальная обструкция при ХОБЛ неуклонно прогрессирует и обратима лишь частично. Последнее обстоятельство аргументирует целесообразность клинического применения бронхолитиков и при этом заболевании.
Естественно, что указанные различия между БА и ХОБЛ требуют дифференцированного подхода как к выбору конкретных бронхолитиков, так и к тактике их назначения. Так, если больным ХОБЛ бронхолитики назначаются преимущественно на постоянной основе, то пациентам с БА — чаще «по требованию» и/или в сочетании с базисной противовоспалительной терапией (глюкокортикостероидами или кромонами).
Современные бронхолитические препараты можно разделить на три группы, перечисленные ниже в том порядке, в котором они внедрялись в клиническую практику.
Антихолинергические препараты. На протяжении многих тысячелетий при необходимости лечения болезней органов дыхания применялись средства народной медицины. Упоминания об использовании растений семейства пасленовых были найдены еще в древнеегипетских папирусах. Гиппократ рекомендовал людям с болезнями легких применение курений и дымов порошков, приготовленных из высушенных корней и листьев белладонны (Atropa belladonna), дурмана (Datura stramonium), белены (Hyoscyamus niger). Недавними исследованиями было установлено, что эффект от курения антиастматических сигарет, содержащих листья Datura stramonium, сопоставим с таковым при применении современных бронхолитических средств [7].
К началу XIX в. уже было известно антихолинергическое действие алкалоидов белладонны, несколько позже ученые установили роль парасимпатической нервной системы в развитии бронхоспазма, а с середины 19-го столетия холиноблокаторы — атропин и синтезированный вскоре платифиллин — становятся «золотым стандартом» в лечении БА. Широкое использование холинолитиков по этому показанию продолжалось до 70-х гг. XX в. Лишь с появлением мощных селективных β2-агонистов, а также метилксантинов атропин утратил свое значение в лечении больных БА. Этому в немалой степени способствовало и наличие большого количества нежелательных явлений, сопутствующих введению препарата: сухость во рту, нарушения мукоцилиарного клиренса, мидриаз и др. [8].
В 70-х гг. XX в. были выделены и классифицированы мускариновые рецепторы в дыхательных путях человека (М1-, М2-, М3-рецепторы). Установление важной роли парасимпатической нервной системы в контроле бронхиальной проходимости при БА дало толчок к дальнейшим разработкам антихолинергических лекарственных средств, что привело к созданию принципиально нового препарата — ипратропия бромида [8, 9]. Однако при проведении клинических исследований у больных БА его эффективность оказалась невелика. Напротив, препарат продемонстрировал отчетливый клинический и в ряде случаев бронхолитический эффект у больных ХОБЛ. Таким образом, удалось доказать частичную обратимость бронхиальной обструкции при ХОБЛ и впоследствии установить две ее патофизиологические составляющие — обратимую и необратимую.
Обратимый («бронхолитический») компонент бронхиальной обструкции представлен воспалительным отеком слизистой дыхательных путей, аккумуляцией клеток воспаления, слизи и плазмы в просвете бронхов, спазмом гладкой мускулатуры, которые в основном контролируются парасимпатическим отделом вегетативной нервной системы, тонус которой при ХОБЛ закономерно повышен [10].
Необратимый («эмфизематозный») компонент бронхиальной обструкции обусловлен развитием и прогрессированием эмфиземы легких и так называемой болезни мелких бронхов (снижение эластической тяги легочной ткани вследствие неравномерной преимущественно центриацинарной эмфиземы, ранний экспираторный коллапс, деформация и сужение мелких бронхов). Предполагалось, что данные структурные изменения не могут служить точкой приложения бронхолитических и/или противовоспалительных лекарственных средств. Однако в дальнейшем удалось установить, что именно эти изменения в паренхиме легких обусловливают формирование гиперинфляции легких с развитием «воздушной ловушки», приводящей к нарушению опорожнения альвеол во время выдоха (наиболее наглядно этот патофизиологический феномен можно продемонстрировать при выполнении физических нагрузок). Именно этот механизм и объясняет развитие таких кардиальных симптомов ХОБЛ, как выраженная одышка и снижение толерантности к физической нагрузке, заметно ухудшающих качество жизни данной категории пациентов [11].
Наиболее известным и широко распространенным лекарственным средством из числа ингаляционных антихолинергических препаратов в настоящее время является ипратропия бромид. Препарат хорошо переносится, эффективен и безопасен при длительном применении, не вызывает развития тахифилаксии, лишен кардиотоксического действия. При этом важно отметить, что чувствительность М-холинорецепторов с возрастом не уменьшается. Вот почему в рекомендациях по ведению больных ХОБЛ подходы к назначению этого препарата определяют следующим образом: лечить «так долго, как долго симптомы заболевания будут продолжать причинять неудобства пациенту» [2].
Продолжительность действия ипратропия бромида — 4–6 ч, в результате чего возникает необходимость повторных ингаляций (4 раза в сутки), поэтому иногда проблематично контролировать возможные ухудшения бронхиальной проходимости в ночные или предутренние часы. Подобно атропину, ипратропия бромид не является селективным холиноблокатором и одинаково быстро блокирует все три типа мускариновых рецепторов, поэтому следует бдительно наблюдать за пациентом, так как блокада М2-рецепторов иногда может приводить к парадоксальной бронхоконстрикции [9].
Представителем новой генерации антихолинергических препаратов является тиотропия бромид, зарегистрированный в России в 2003 г. Особенности химической структуры препарата объясняют своеобразие его взаимодействия с мускариновыми рецепторами, а именно уникальную кинетическую селективность, т. е. различия в скорости блокирования, соответствующих подтипов мускариновых рецепторов, а также увеличение продолжительности действия [12, 13].
В ходе проведенных исследований, в частности, было показано, что длительная бронходилатация (
24 ч), регистрируемая после однократной ингаляции тиотропия бромида, сохраняется и при длительном его приеме (на протяжении 12 мес) [14, 15]. Уже через 30 мин после первой ингаляции увеличивались показатели объема форсированного выдоха за первую секунду (ОФВ1) и форсированной жизненной емкости легких (ФЖЕЛ), в дальнейшем не снижавшиеся в течение последующих 24 ч. Наибольший бронхолитический эффект отмечался ко второй неделе лечения тиотропия бромидом.
Продолжительная терапия тиотропия бромидом (в течение 12 мес) сопровождается оптимизацией показателей бронхиальной проходимости, регрессом респираторной симптоматики, улучшением качества жизни пациентов [16]. При этом отчетливо уменьшалась выраженность одышки. Известный пульмонолог P. Jones высоко оценил возможности симптоматического контроля с помощью ингаляций тиотропия бромида, отметив его саногенетический эффект: больные, длительно принимавшие препарат, более не испытывали одышки при физической нагрузке и передвигались в темпе, характерном для их возраста [17]. Регресс одышки объясняется уменьшением гиперинфляции легких и размера «воздушной ловушки». При этом в рамках длительного лечения больных ХОБЛ удалось продемонстрировать терапевтическое превосходство тиотропия бромида над ипратропия бромидом [18].
Важное преимущество ингаляционных антихолинергических препаратов — минимальная частота и выраженность нежелательных явлений. Самое распространенное из них — сухость во рту, как правило, не приводит к прекращению приема лекарственных средств [16, 18].
Метилксантины. В течение многих десятилетий метилксантины (теофиллин и др.) применяются при лечении больных БА, хотя механизм их действия длительное время оставался неясным. В 1859 г. появилось сообщение доктора Hyde Salter о том, что чашка крепкого кофе способна купировать приступ БА. В 1888 г. был выделен теофиллин из листьев чая. Длительное время подход к использованию теофиллина был чисто эмпирическим и только после уточнения механизма его действия в конце 1930-х гг. препарат получил широкое распространение. Бронхолитический эффект теофиллина осуществляется посредством ингибирования изоформ фосфодиэстеразы с последующим увеличением внутриклеточного содержания цАМФ и релаксацией гладких мышц дыхательных путей. Кроме того, установлены иммуномодулирующий и противовоспалительный эффекты теофиллина, что позволяет назначать данное средство в рамках монотерапии при невозможности применения ингаляционных противовоспалительных и/или бронхолитических препаратов. Кратковременный прием пролонгированных теофиллинов в течение 6–12 нед сопровождается улучшением показателей симптоматического контроля над заболеванием, увеличением ОФВ1 [19, 20].
Обсуждая возможности применения теофиллина у пациентов с бронхообструктивными заболеваниями, важно учитывать и его внелегочные эффекты: улучшение периферической вентиляции, уменьшение развития «воздушных ловушек», улучшение функции диафрагмы, особенно при гиперинфляции легкого, улучшение (восстановление) мукоцилиарного клиренса, дилатацию артерий малого круга кровообращения, снижение давления в легочной артерии и гемодинамическую «разгрузку» правых отделов сердца, повышение физической работоспособности.
В то же время известно, что метаболизм теофиллина подвержен значительным изменениям. Так, у курильщиков, лиц, страдающих хроническим алкоголизмом, больных, принимающих рифампицин или противосудорожные препараты, клиренс теофиллина ускорен, а значит, при использовании стандартного режима дозирования плазменная концентрация препарата может не достигать терапевтических показателей. Напротив, с возрастом, при наличии артериальной гипоксемии (РаО2
И. Л. Клячкина, кандидат медицинских наук, доцент
ГИУВ МО РФ, Москва
ТОП лекарств от кашля
Кашель – защитная рефлекторная реакция организма, направленная на очищение закупоренных или раздраженных дыхательных путей. Половая принадлежность, возраст и генетика в данном случае значения не имеют. Лающий, мучительный, с мокротой или без нее, возникающий в течение всего дня, только в определенное время суток или при употреблении определенных продуктов – существуют совершенно разные типы кашля. Он может быть разделен, во-первых, по продолжительности (острый и хронический кашель), а во-вторых, по отношению к выделяемому секрету (сухой, продуктивный и кровохарканье).
Чтобы подобрать лучшее средство от кашля, следует обратиться к врачу. Только специалист, после проведения обследования и постановки диагноза, может назначить эффективный препарат, который не только устраняет симптом, но и борется с причиной его возникновения.
Какие виды кашля бывают
Сухой (раздражающий)
Называется непродуктивным или кашлем без мокроты. Вызван раздражением дыхательных путей. Острый сухой кашель может возникать, например, в начале бронхита, при небольших легочных эмболиях (закупорка легочного кровеносного сосуда), плеврите, а также при вдыхании раздражающих газов, пыли и других инородных тел.
Хронический сухой кашель может быть вызван, например, хроническим насморком или хронической синусовой инфекцией, рефлюксной болезнью и астмой. Кроме того, хронический сухой кашель также может быть побочным эффектом ингибиторов АПФ (сердечно-сосудистых средств).
Продуктивный (кашель с мокротой)
Сопровождается большим количеством слизистого образования. Слизь в основном прозрачная. Желтоватая мокрота, отходящая из нижних дыхательных путей, связана с воспалительными клетками. Зеленоватый бронхиальный секрет указывает на бактериальную инфекцию.
Острый продуктивный кашель может возникать, например, в рамках пневмонии, а также на более поздней стадии острого бронхита. Хронический продуктивный кашель может быть признаком хронического бронхита или ХОБЛ (хронической обструктивной болезни легких).
Кровохарканье
Причины возникновения кашля
Существует много провоцирующих факторов. Перед назначением лекарственной терапии назначается комплексное обследование для уточнения причины. Самолечение в данном случае недопустимо, т. к. может привести к развитию необратимых последствий для здоровья.
Простуда
Поражение верхних дыхательных путей вирусами. Обычно сопровождается кашлем, насморком, заложенностью носа и общим ухудшением самочувствия. Если не начать лечить кашель на данном этапе, то происходит прогрессирование патологического процесса и развитие поражения верхних дыхательных путей или легких.
Грипп
Респираторная вирусная инфекция протекает тяжелее простой простуды. Болезнь начинается очень внезапно с высокой температурой, головной и мышечной болью. Также присоединяется боль в горле с затруднением глотания. При гриппе чаще всего возникает сухой кашель. Иногда пациенты также страдают от тошноты.
Хронический синусит
Сопровождается в основном сухим кашлем, который усиливается в положении лежа. Воспалительный процесс часто распространяется и на слизистую оболочку носовой полости, поэтому сопровождается хроническим насморком.
Бронхит
Воспаление респираторного тракта, которое часто сопровождается мучительным кашлем. При остром бронхите сначала возникает сухой, позже продуктивный кашель. Кроме того, у больных отмечается насморк и боль в горле. Диагноз хронический бронхит ставится тем, у кого был ежедневный кашель и мокрота в течение как минимум 3 месяцев подряд по 2-3 эпизода в год. Часто курение является причиной хронического бронхита.
Пневмония
Плеврит
Острое воспаление легких. Возможные причины включают инфекции, рак и легочную эмболию. Сухая форма плеврита сопровождается раздражающим кашлем, сильной, односторонней и болью в груди при вдохе.
Воздействие раздражающих факторов
При попадании жидкости или пищи в трахею, а не в пищевод, возникает сухой раздражающий кашель – организм пытается снова транспортировать инородные тела вверх к полости рта. То же самое происходит при вдыхании или проглатывании инородных тел.
Аллергия
Кашель, связанный с аллергией, может возникать, например, при аллергии на плесень, пищевой аллергии и аллергии на пылевые клещи. Люди с аллергией на пыльцу (сенная лихорадка) позже часто дополнительно заболевают астмой, для чего кашель и одышка являются первыми признаками.
Бронхиальная астма
Астма является широко распространенным хроническим заболеванием с воспалением и сужением дыхательных путей. Пациенты страдают преимущественно сухим кашлем (даже ночью) и судорожной одышкой.
Хроническая обструктивная болезнь легких (ХОБЛ)
Дыхательные пути в легких хронически воспалены и сужены. Возникающий дискомфорт – это в первую очередь хронический кашель с мокротой, а также одышка при нагрузке. Основной причиной ХОБЛ является курение.
Коллапс легких (пневмоторакс)
Приводит к болезненному накоплению воздуха между внутренней и внешней легочной оболочкой. Причиной этого является, например, разрыв легочных пузырьков или травма легких. При коллапсе внезапно появляется боль в области груди, которая может иррадиировать в спину. Также усиливается нехватка воздуха.
Легочная эмболия
Рак легких
Подразумевает наличие различных злокачественных наростов. Упорный кашель является относительно ранним симптомом карцином, но также может указывать на многие другие заболевания. У некоторых пациентов также возникает кровохарканье. Основной причиной рака легких является курение.
Редкие причины
Некоторые лекарства могут вызвать хронический сухой кашель в качестве побочного эффекта, который часто возникает приступами. Речь идет о ингибиторах АПФ и бета-блокаторах. Обе группы лекарственных средств служат сердечно-сосудистыми препаратами и назначаются при сердечной недостаточности и гипертонии. Кроме того, прием противовоспалительного кортизона также может вызвать кашель.
У детей хронический кашель часто возникает из-за повышенной чувствительности дыхательных путей после вирусной инфекции и при рефлюксе кислотного содержимого желудка в пищевод. Причиной может стать отток слизи из носовых ходов в горло. Редкими причинами кашля у детей являются вдыхание инородных тел и кистозный фиброз.
Классификация препаратов от кашля
Лекарства дают при кашле только в том случае, если это абсолютно необходимо, или дискомфорт сильно влияет на состояние пациента. Поскольку кашель – это не болезнь, а симптом, перед его лечением обязательно следует диагностировать основное заболевание. Особенно длительный кашель может быть симптомом серьезного нарушения в организме. По этой причине перед составлением диагноза обязательно следует избегать препаратов, угнетающих кашель.
Таблица – Классификация препаратов от кашля
Бронхолитическая терапия больных со стабильным течением хронической обструктивной болезни легких
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Государственный институт усовершенствования врачей МО РФ, Москва
К раеугольным камнем в лечении больных хронической обструктивной болезнью легких (ХОБЛ) является терапия, направленная на уменьшение бронхиальной обструкции. С этой целью применяются b 2–агонисты короткого и длительного действия, антихолинергические препараты, метилксантины. Положение о ведущей роли бронхолитической терапии в комплексном лечении больных ХОБЛ закреплено как в национальных, так и в международных согласительных рекомендациях [1].
Однако критерии выбора бронхолитических препаратов первого ряда в обсуждаемой клинической ситуации остаются весьма неопределенными, а нередко и противоречивыми (учитывая тот факт, что b 2–агонисты, как правило, столь же эффективны при ХОБЛ, как и антихолинергические препараты). Так, эксперты Европейского респираторного общества (ERS) рекомендуют либо b 2–агонисты, либо антихолинергические препараты без четких критериев выбора между ними [2]. Напротив, в рекомендациях Американского торакального общества (ATS), Французского пульмонологического общества предпочтение отдается антихолинергическим препаратам (как препаратам выбора у пациентов с постоянными симптомами), тогда как b 2–агонисты предлагается использовать «по требованию» у пациентов с пароксизмальной одышкой [3,4]. Наконец, согласно мнению экспертов Британского торакального общества (BTS), поначалу следует назначать b 2–агонисты, а к антихолинергическим препаратам обращаться лишь при недостаточной эффективности симпатомиметиков или при необходимости «усилить» бронхолитическую терапию [5].
Еще сравнительно недавно (1970–80–е годы) предположение о возможности применения бронхолитических препаратов при ХОБЛ выглядело, по меньшей мере, спорным. Действительно, в течение многих лет ХОБЛ определялась, как заболевание, ключевым патофизиологическим признаком которого являлась «фиксированная» или «необратимая» бронхиальная обструкция, развивающаяся в результате воспалительно–дегенеративных изменений в дыхательных путях и легочной ткани. Необратимость бронхиальной обструкции традиционно рассматривалась в качестве опорного пункта в алгоритме дифференциальной диагностики ХОБЛ и бронхиальной астмы (БА).
Убежденность в необратимости бронхиальной обструкции была серьезно поколеблена в середине 70–х годов ХХ века результатами исследований по оценке клинической эффективности холиноблокатора ипратропиума бромида у больных ХОБЛ.
Прежде всего, очевидно, стоит напомнить, что холиноблокаторы (Atropa belladonna, Datura stramonium и др.) применялись для лечения болезней органов дыхания в течение нескольких тысячелетий. Антихолинергическое действие алкалоидов белладонны, в том числе и выделенного в 1833 г. атропина (датурина), было доказано в начале XIX века. С середины XIX века атропин становится «золотым стандартом» в лечении БА. Кстати, впоследствии было установлено, что эффект от курения сигарет или вдыхания дыма сжигаемого порошка из листьев белладонны оказался по выраженности бронходилатации сопоставимым с современными бронхолитическими средствами [6].
Однако со временем использование атропина, как бронхолитика, в лечении БА заметно уменьшилось. С одной стороны, это объяснялось значительным количеством нежелательных явлений (сухость во рту, мидриаз и др.), особенно при системном применении препарата. С другой стороны, появились более эффективные и безопасные бронхолитические лекарственные средства – симпатомиметики (1920–е годы) и, с известными оговорками, метилксантины (1930–е годы).
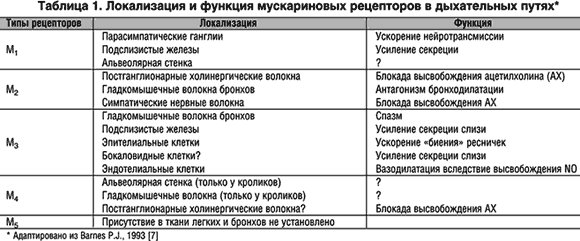
Ренессанс холиноблокаторов (антихолинергических препаратов) пришелся на 1970–е гг., когда удалось доказать важную роль парасимпатической нервной системы в контроле бронхиальной проходимости при БА, а также выделить и классифицировать мускариновые рецепторы (табл. 1) [7,8].
В результате многочисленных исследований к 1975 г. был разработан принципиально новый препарат – ипратропиум бромид. Во время проведения клинических испытаний нового лекарственного средства оказалось, что его бронхолитический эффект при БА невелик и в основном аддитивен таковому b 2–агонистов. В то же время неожиданным, но приятным «сюрпризом» оказалось отчетливое бронхолитическое действие препарата у пациентов c ХОБЛ. Так, пожалуй, впервые удалось продемонстрировать обратимость бронхиальной обструкции у данной категории больных [8].
В результате дальнейших исследований были окончательно установлены две патофизиологические составляющие бронхиальной обструкции при ХОБЛ – обратимая и необратимая.
Прогрессирующая эмфизема легких и так называемая болезнь мелких бронхов формируют необратимый или «эмфизематозный» компонент бронхиальной обструкции. Названные структурные изменения, естественно, не могут быть точкой приложения медикаментозной терапии.
В свою очередь, обратимый компонент бронхиальной обструкции развивается вследствие процессов, описываемых термином «воспалительное ремоделирование стенки бронхов» (отек, отложение протеогликана в подслизистой и адвентиции стенки бронха, гипертрофия слизистых желез и гиперплазия бокаловидных клеток, увеличение микроваскулярной сети бронхов, гипертрофия и гиперплазия гладкомышечных клеток бронхов).
При этом особое значение приобретают воспалительный отек слизистой дыхательных путей и избыточное образование вязкого секрета, заметно ухудшающие проходимость бронхов. Эти процессы контролируются парасимпатической нервной системой, тонус которой при ХОБЛ закономерно повышен. Стимуляция ветвей блуждающего нерва воспалительными медиаторами (например, брадикинином) приводит к высвобождению ацетилхолина, который активирует соответствующие мускариновые рецепторы дыхательных путей (табл. 1) [8]. Наибольшие патофизиологические «последствия» имеет стимуляция М3–рецепторов: сокращение гладкомышечных клеток, гиперсекреция подслизистых желез и бокаловидных клеток, отек слизистой бронхов. Парасимпатикотония обусловливает и определенный базальный бронхомоторный тонус, а также небольшую его вариабельность.
Холиноблокаторы (антихолинергические препараты или М–холинолитики), являющиеся конкурентными антагонистами ацетилхолина, блокируют мускариновые рецепторы и тем самым устраняют известные эффекты парасимпатикотонии на постсинаптические рецепторы гладкой мускулатуры и слизеобразующие элементы бронхов. М1–рецепторы локализуются в парасимпатических ганглиях и контролируют процесс нейротрансмиссии, а М2–рецепторы, расположенные на окончаниях постганглионарных нервных волокон, являются ауторецепторами и контролируют высвобождение ацетилхолина в синаптическую щель. В этой связи фармакологическая блокада М2–рецепторов приводит к высвобождению значительных количеств ацетилхолина и возможному усугублению бронхиальной обструкции.
Менее определенным оказался патофизиологический «вклад» сокращения гладкой мускулатуры дыхательных путей в формирование бронхиальной обструкции при ХОБЛ. В работах M.S. Dunnil c соавт., A. Nagai с соавт. [9,10] было показано, что при ХОБЛ происходит гиперплазия гладких мышц дыхательных путей, хотя и менее выраженная, чем при БА. В исследованиях in vitro было установлено отчетливое расслабление гладкомышечных клеток, одинаковое как у астматиков, так и у не болеющих БА [11]. В то же время при назначении бронхолитических препаратов больным ХОБЛ происходит лишь ограничение («лимитирование») укорочения гладких мышц бронхов. Это лишний раз доказывает то, что собственно бронхоконстрикция имеет ограниченное значение в формировании бронхиальной обструкции при ХОБЛ.
Важным для объяснения роли и места холиноблокаторов в лечении ХОБЛ (а заболеванию подвержены преимущественно лица старших возрастных групп) является тот факт, что чувствительность мускариновых рецепторов с возрастом не уменьшается.
Все вышесказанное объясняет признание в настоящее время за холиноблокаторами статуса препаратов выбора в лечении ХОБЛ. Препараты этой группы могут назначаться «по требованию», т.е. для купирования остро возникшей респираторной симптоматики. Однако более оправдано их применение на регулярной основе, поскольку антихолинергические средства, воздействуя на обратимую составляющую хронической бронхиальной обструкции, замедляют темпы прогрессирования вентиляционных нарушений и улучшают качество жизни больных.
Наиболее известным и широко применяемым в настоящее время из числа ингаляционных антихолинергических препаратов является ипратропиум бромид (ИБ). Препарат хорошо переносится, эффективен и безопасен при длительном применении, не вызывает развития тахифилаксии, лишен кардиотоксического действия. При этом важно еще раз напомнить, что чувствительность М–холинорецепторов с возрастом не уменьшается. Вот почему существующие рекомендации по ведению больных ХОБЛ следующим образом определяют подходы к назначению ИБ: лечить «. так долго, как долго симптомы заболевания будут продолжать причинять неудобства пациенту» [3].
В то же время ИБ не свободен и от известных недостатков. Прежде всего это малая продолжительность действия (4–6 часов), в результате чего возникает необходимость повторных ингаляций (4 раза в сутки), и препарат не позволяет адекватно контролировать возможные ухудшения бронхиальной проходимости в ночные или предутренние часы. Кроме того, подобно атропину, ИБ не является селективным холиноблокатором и одинаково быстро диссоциирует со всеми тремя типами мускариновых рецепторов. При этом блокада М2–рецепторов, как уже говорилось выше, может приводить к парадоксальной бронхоконстрикции [7].
Представителем новой генерации антихолинергических препаратов является тиотропиум бромид (ТБ). Особенности химической структуры ТБ объясняют своеобразие его взаимодействия с мускариновыми рецепторами, а именно – уникальную кинетическую селективность, т.е. различия в скорости диссоциации с соответствующими рецепторами (табл. 2), а также увеличенную продолжительность действия [12,13].
В ходе проведенных исследований, в частности, было показано, что длительная бронходилатация (
24 ч), регистрируемая после однократной ингаляции ТБ, сохраняется и при длительном его приеме на протяжении 12 месяцев [14,15,16]. Долговременная терапия ТБ (в течение 12 мес.) сопровождается оптимизацией показателей бронхиальной проходимости, регрессом респираторной симптоматики, улучшением качества жизни пациентов [17]. При этом удалось продемонстрировать терапевтическое превосходство ТБ над ИБ в рамках длительного лечения больных ХОБЛ [18].
Важное преимущество ингаляционных антихолинергических препаратов – минимальная частота и выраженность нежелательных явлений. Самое актуальное из них – сухость во рту, как правило, не приводит к прекращению приема лекарственных средств [15,17,18].
Наряду с антихолинергическими препаратами при ХОБЛ широко применяются и b 2–агонисты – короткодействующие и пролонгированные.
Действие b 2–агонистов (стимуляторов b 2–адренорецепторов) опосредуется через повышение внутриклеточной концентрации цАМФ, что ведет к многообразным биологическим и терапевтическим эффектам (в т.ч. расслаблению гладкой мускулатуры дыхательных путей и улучшению бронхиальной проходимости). Длительное время обсуждался вопрос о терапевтической сопоставимости b 2–агонистов и антихолинергических препаратов при ХОБЛ, при этом нередко выбор между этими группами препаратов происходил (и происходит) эмпирически. Однако в настоящее время предлагается выбирать то или иное направление бронхолитической терапии с учетом индивидуальной чувствительности пациента (по результатам ингаляционного теста).
Короткодействующие b 2–агонисты могут применяться как «по требованию», т.е. для купирования симптомов, так и на регулярной основе. Согласно результатам мета–анализа, проведенного P. Sestini с соавт. [19], регулярное применение короткодействующих b 2–агонистов на протяжении 1–8 недель приводит к незначительному увеличению ОФВ1 (
0,14 л), а также уменьшает выраженность одышки по сравнению с плацебо. Однако полученные данные не дают четких доказательств терапевтического превосходства регулярного применения ингаляционных b 2–агонистов по сравнению с их приемом «по требованию».
Ретроспективный анализ исследований, посвященных оптимизации бронхолитической терапии больных ХОБЛ, показал, что наименьшее количество обострений заболевания наблюдается при комбинированном лечении (сальбутамол + ИБ) по сравнению с монотерапией b 2–агонистом или холиноблокатором [20].
Появление пролонгированных b 2–агонистов (сальметерол, формотерол) возобновило дискуссию о преимуществах симпатомиметиков перед антихолинергическими препаратами. Однако результаты первых контролируемых исследований по оценке эффективности непродолжительного приема (4–16 недель) пролонгированного b 2–агониста сальметерола больными со стабильным течением ХОБЛ свидетельствовали о сдержанном превосходстве бронхолитика перед плацебо (прирост ОФВ1 составил
В более поздних исследованиях было показано, что длительный прием сальметерола сопровождается более отчетливым бронхолитическим эффектом [22], минимизацией клинических симптомов [23], улучшением качества жизни больных ХОБЛ [24], удлинением временного интервала с момента назначения лекарственного средства до развития первого обострения заболевания [25].
Одновременно в сравнительных исследованиях – сальметерол vs. ИБ [26] и формотерол vs. ИБ [27] – была продемонстрирована сопоставимая терапевтическая эффективность (регресс одышки, возрастание ОФВ1) обоих направлений терапии.
Несмотря на ограниченный патогенетический вклад бронхоконстрикции в нарушение проходимости дыхательных путей у больных ХОБЛ и, соответственно, незначительное влияние b 2–агонистов на тонус гладкомышечных клеток бронхов, их применение в обсуждаемой клинической ситуации стало едва ли не хрестоматийным. Практически все исследователи отмечают значительное улучшение состояния больных, регресс симптоматики (особенно утренней), уменьшение количества тяжелых обострений и госпитализаций, не коррелирующих зачастую с динамикой ОФВ1.
В этой связи следует отметить, что b 2–агонисты, кроме бронхолитического действия, обладают и другими саногенетическими эффектами. Объяснение последним следует искать прежде всего в распространенной локализации b 2–адренорецепторов не только в гладкомышечных клетках бронхов, но и в скелетных мышцах, миокарде, сосудистой стенке и т.д. А отсюда и множественность терапевтических эффектов b 2–агонистов: стимуляция биения ресничек мерцательного эпителия слизистой бронхов и улучшение мукоцилиарного клиренса; увеличение силы и выносливости дыхательных мышц, в т.ч. и диафрагмы; повышение сократительной способности миокарда, снижение сосудистого сопротивления, снижение гемодинамической нагрузки на сердце и, как следствие этого – возрастание физической работоспособности [28].
В течение нескольких десятилетий метилксантины (теофиллин и др.) применяются при лечении БА. Бронхолитический эффект теофиллина (ТФ) осуществляется через ингибирование фосфодиэстеразы (блокада фосфодиэстеразных рецепторов, преимущественно III и IV типов) с последующим увеличением внутриклеточного содержания цАМФ и релаксацией гладких мышц дыхательных путей. В последнее время стало известно, что фосфодиэстеразные рецепторы IV типа локализуются и на поверхности «клеток воспаления» (эозинофилов, нейтрофилов и др.), что объясняет иммуномодулирующий и противовоспалительный эффекты ТФ.
Бронхолитическое действие ТФ отчетливо проявляется и при лечении больных ХОБЛ. Так, в частности, кратковременный прием (6–12 недель) пролонгированного теофиллина сопровождается улучшением симптоматического контроля заболевания, особенно в утренние часы, и увеличением ОФВ1 [29,30].
Обсуждая возможности применения ТФ у больных ХОБЛ, нельзя игнорировать и его внелегочные эффекты: улучшение периферической вентиляции; уменьшение развития «воздушных ловушек»; улучшение функции диафрагмы, особенно при гиперинфляции легкого; улучшение (восстановление) мукоцилиарного клиренса; дилатация артерий малого круга кровообращения, снижение давления в легочной артерии и гемодинамическая «разгрузка» правых отделов сердца, повышение физической работоспособности.
Однако несмотря на эти и другие доказательства «терапевтической привлекательности» ТФ, роль и место препарата в лечении ХОБЛ еще окончательно не определены. Отчасти это связано с тем, что метаболизм ТФ подвержен значительным изменениям. Так, у курильщиков, лиц, страдающих хроническим алкоголизмом, больных, принимающих рифампицин или противосудорожные препараты, клиренс ТФ ускорен, а значит, при использовании стандартного режима дозирования плазменная концентрация препарата может не достигать терапевтической. Напротив, с возрастом, при наличии артериальной гипоксемии (РаО2 b 2–агонистов), своего рода резерву для тех пациентов, у которых другие направления бронхолитической терапии недостаточно адекватно контролируют симптомы заболевания. Возможно также назначение ТФ и тем больным, которые не могут пользоваться ингаляционными средствами доставки.
Комбинированная бронхолитическая терапия
Комбинация ингаляционного b 2–агониста (короткодействующего или пролонгированного) и холиноблокатора сопровождается улучшением бронхиальной проходимости в большей степени, чем при назначении любого из этих препаратов в рамках монотерапии [34–37]. В еще большей степени удается оптимизировать вентиляционную функцию легких при одновременном применении b 2–агонистов, холиноблокаторов и ТФ [38]. Однако согласно распространенному мнению комбинированная терапия должна применяться, как правило, лишь при невозможности добиться оптимального терапевтического эффекта при назначении какого–либо одного класса бронхолитиков.
В соответствии с современными рекомендациями по ведению больных ХОБЛ в случаях неадекватного контроля заболевания следует прибегать к комбинированной терапии: Комбивент (ИБ+сальбутамол) или Беродуал (ИБ+фенотерол). Применение комбинированных препаратов способствует лучшей комплаентности и существенно уменьшает стоимость лечения по сравнению с использованием каждого препарата в отдельности.
Несмотря на то, что в происхождении ХОБЛ и БА основное место отводится хроническому воспалению, конкретные клеточные и молекулярные механизмы воспаления при этих заболеваниях оказываются различными. Так, при БА цитограмма воспаления слизистой бронхов представлена преимущественно эозинофильными лейкоцитами и CD4+–лимфоцитами, а в случаях ХОБЛ доминирующими клетками воспаления являются нейтрофилы, макрофаги и CD8+–лимфоциты [39]. Отсюда и значительные различия в ответе на лечение при БА и ХОБЛ. Эозинофильноклеточное воспаление эффективно контролируется глюкокортикоидами. Напротив, эти лекарственные средства практически не влияют на выраженность нейтрофильноклеточного воспаления и на продукцию нейтрофилами известных медиаторов воспаления и протеаз. Более того, в отношении эозинофильных и нейтрофильных лейкоцитов глюкокортикоиды демонстрируют прямо противоположные эффекты – апоптоз эозинофилов и удлинение жизни нейтрофилов.
Все это объясняет противоречивость результатов, полученных в ходе кратковременного применения ИГК у больных ХОБЛ (в т.ч. и динамики ОФВ1). Отсюда и известные разночтения в трактовке роли и места ИГК. Так, согласно результатам исследований, проведенных во Франции, практические врачи назначают ИГК больным ХОБЛ в 76% случаев [40], что сопоставимо с частотой их назначения в Великобритании [3,41]. При этом показания, аргументировавшие этот «терапевтический максимализм», удалось подтвердить только в 10–30% случаев [1,5,40].
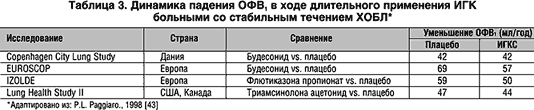
В свою очередь, масштабные многоцентровые контролируемые исследования (Copenhagen City Lung Study, EUROSCOP, ISOLDE, Lung Health Study II), ставившие своей целью оценку клинической и функциональной эффективности длительного применения ИГК, дали неожиданные результаты (табл. 3) [42]. Так, было показано, что в течение первых 6 месяцев значения ОФВ1 у больных ХОБЛ, принимающих ИГК, несколько возрастали, но к концу третьего года показатели бронхиальной проходимости оказывались сопоставимыми с таковыми в группах больных, получавших плацебо. Вместе с тем было установлено, что длительное применение ИГК сопровождается уменьшением числа тяжелых и среднетяжелых обострений ХОБЛ на 25% [43].
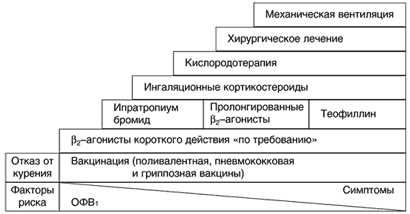
В заключение, характеризуя бронхолитическую терапию больных со стабильным течением ХОБЛ, целесообразно обратиться к известным положениям инициативы GOLD [1]:
Рис. 1. Современные подходы к ведению больных ХОБЛ
1. Global Initiative for Chronic O b structive Lung Disease. Glo b al Strategy for Diagnosis, Management, and Prevention of Chronic O b structive Pulmonary Disease. NHLBI/WHO Workshop Report. Pu b lication 2701, 2001.
2. Siafakas N.M., Vermeire P., Pride N.B., et al. Optimal assessment and management of chronic o b structive pulmonary disease (COPD). Eur Respir J 1995; 8: 1398–1420.
3. American Thoracic Society. Standards for the diagnosis and care with chronic o b structive pulmonary disease. Am Rev Respir Dis 1995; 152: S77–S120.
4. Societe de Pneumologie de Langue de Francaise. Recommandations pour la prise en charge des b ronchopneumopaties chroniques o b structives. Comite d’organisation: Huchon G., Fournier M., Le b as F.X., Pujet J.C., Roche N. Rev Mal Respir 1997; 14: 2S3–2S92.
5. The COPD Guidelines Group of the Standards of Care Committee of the BTS. BTS Guidelines for the management of chronic o b structive pulmonary disease. Thorax 1997; 52: S1–S28.
6. Trechsel K., Bachofen H., Scherre M. Die b ronchodilatorische Wirkung der Asthmazigarette. Scweizerische Medizinische Wochenschrift 1973; 103: 415–423.
7. Barnes P.J. Muscarinic receptor su b types in airways. Life Sci 1993; 52: 521–527.
8. Gross N.J., editor. Anthicholinergic therapyin o b structive airway disease. London, Franklin Scientific Pu b lications, 1993.
9. Dunnil M.S., Massarella G.R., Anderson J.A. A comparison of the quantitative anatomy of the b ronchi in normal su b jects, in the status asthmaticus in chronic b ronchitis and in emphysema. Thorax 1969; 24: 176–179.
10. Nagai A., West W.W., Paul J.B., Thur b eck W.M. The National Institutes of Health intermittent positive–pressure b reathing trial: pathology studies. Am Rev Respir Dis 1985; 132: 937–945.
11. James A., Carroll N. Airway smooth muzcle in health and disease; methods of measurement and relation to function. Eur Respir J 2000; 15: 782–789.
12. Barnes P.J. The pharmacological properties of tiotropium. Chest 2000; 117 suppl.: 63S–69S.
13. Disse B., Reichl R., Speck G., et al. DF 679 BR, a novel long acting anticholinergic b ronchodilator. Life Sci 1993; 52(5–6): 537–544.
14. van Noord J.A., Bantje T.A., Eland M.E. et al. A randomized controlled comparison of tiotropium and ipratropium in the treatment of chronic o b structive pulmonary disease. The Dutch Tiotropium Study Group. Thorax 2000; 55: 289–294.
15. Casa b uri R., Briggs D.D., Donohue J.F. et al. The spirometric efficacy of once– daily dosing with tiotropium in sta b le COPD. Chest 2000; 118: 1294–1302.
16. Littner M.R., Ilovite J.S., Tashkin D.P. et al. Long–acting b ronchodilatation with once–daily dosing of tiotropium (Spiriva) in sta b le chronic o b structive pulmonary disease. Am J Respir Crit Care Med 2000; 161: 1136–1142.
17. Casa b uri R.,Mahler D.A., Jones P.W. et al. A long–term evaluation of once–daily inhaled tiotropium in chronic o b structive pulmonary disease. Eur Respir J 2002; 19: 217–224.
18. Wincken W., van Noord J.A., Greefhorst A.P.M., et al. on b ehalf of the Dutch/Belgian Tiotropium Study Group. Improved health patients with COPD during 1–yr’s treatment with tiotropium. Eur Respir J 2002; 19: 209–216.
20. Friedman M., Ser b y C.W., Menjoge S.S. et al. Pharmacoeconomic evaluation of a com b ination of ipratropium plus al b uterol compared with ipratropium alone and al b uterol alone in COPD. Chest 1999; 115: 635–641.
21. Appleton S., Smith B., Veale A., Bara A. Longacting b eta2–agonists for chronic o b structive pulmonary disease. (Cochran Review). In: The Cochran Li b rary. Issue 4, 2001. Oxford Update Software.
22. van Noord J.A., de Munck D.R., Bantje T.A. et al. long–term treatment of chronic o b structive pulmonary disease with salmeterol and the additive effect of ipratropium. Eur Respir J 2000; 15: 878–885.
23. Ramirez–Venegas A., Ward J., Lentine T. Et al. Salmeterol reduces dyspnoea and improves lung function in patients with COPD. Chest 1997; 112: 335–340.
24. Jones P.W., Bush T.K. Quality of life changes in COPD patients treated with salmeterol. Am J Respir Crit Care Med 1997; 155:1283–1289.
25. D’Urzo A.D., De Salvo M.C., Ramirez–Rivera A. et al. In patients with COPD, treatment with a com b ination of formoterol and ipratropium is more effective than a com b ination of sal b utamol and ipratropium: a 3–week, randomized, dou b le– b lind, within–patient, multicenter study. Chest 2001; 119: 1347–1356.
26. Mahler D.A. et al. Efficacy of salmeterol xinafoate in the treatment of COPD. Chest 1999; 115: 957–965.
27. Dahl R. Et al. Inhaled formoterol dry powder versus ipratropium b romide in chronic o b structive pulmonary disease. Am J Respir Crit Care Med 2001; 164: 778–784
29. Murciano D. et al. A randomized, controlled trial of theophylline in patients with severe chronic o b structive pulmonary disease. N Engl J Med, 1989; 320: 1521–1525.
30. Tsukino M. et al. Effects of theophylline and ipratropium b romide on exercise performance pulmonary disease. Thorax 1998; 53: 269–273.
31. ZuWallak R.L., Mahler D.A., Reilly D., et al. Salmeterol Plus Nheophilline Therapy in the Treatment of COPD. Chest. 2001; 119: 1661–1670.
32. Shannon M. Life–threatening events after theophylline overdose: a 10–year–prispective analysis. Arch Intern Med 1999; 159: 989–994.
33. Torphy T.J. State of the art: Phosphodiesterase isozymes: Molecular targets for novel antiasthma agents. Am J Respir Crit Care Med 1998; 157: 351–370.
34. COMBIVENT Inhalation Aerosol Study Group. In chronic o b structive pulmonary disease, a com b ination of ipratropium and al b uterol is more effective than either agent alone. An 85–day multicenter trial. Chest 1994; 105: 1411–1419.
35. Ikeda A. et al. b ronchodilating effects of com b ined therapy of ipratropium b romide and sal b utamol for sta b le COPD: comparison with ipratropium b romide alone. Chest 1995; 107: 401–405.
36. Wesseling G. et al. A comparison of the effects of anticholinergic and b eta–2–agonist and com b ination therapy on respiratory impedance in COPD. Chest 1992; 101: 166–173.
37. van Noord J.A. et al. long–term treatment of chronic o b structive pulmonary disease with salmeterol and the additive effect of ipratropium. Eur Respir J 2000; 15: 878–885.
38. Karpel J.P et al. a comparison of inhaled ipratropium, oral theophylline plus inhaled b eta–agonist, and the com b ination of all three in patients with COPD 1994; 105: 1089–1094.
39. Barnes P. Mechanisms in COPD. Differences From Asthma. Chest 2000; 117: 10S–14S.
40. Roche N., Lepage T., Bourcereau J., Terriox P. Guidelines versus clinical practice in the treatment of chronic o b structive pulmonary disease. Eur Respir J 2001; 18: 903–908.