Бром в честь чего назван
Бром (Br, Bromum)
История брома
Открытие брома произошло в первой трети XIX столетия, независимо друг от друга немецкий химик Карл Якоб Лёвих в 1825 году, а француз Антуан Жером Балар – в 1826 представили миру новый химический элемент. Интересный факт – изначально Балар назвал свой элемент муридом (от латинского muria – рассол), потому что открытие своё сделал, изучая средиземноморские соляные промыслы.
Общая характеристика Брома
Нахождение брома в природе
Бром – широко распространённый химический элемент, во внешней среде встречается практически везде. Особенно много брома находится в солёной воде – морей и озёр, там он имеется в виде бромида калия, бромида натрия и бромида магния. Наибольшее количество брома образуется при испарении морской воды, есть он и в некоторых горных породах, а также в растениях.
В организме человека находятся до 300 мг брома, в основном в щитовидной железе, так же бром содержит кровь, почки и гипофиз, мышцы и костная ткань.
Физические и химические свойства брома
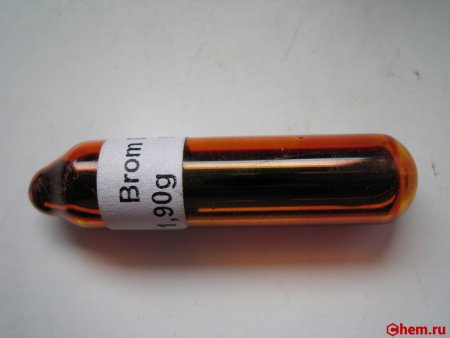
Бром обычно представляет собой едкую тяжёлую жидкость, имеет красно-бурый цвет и резкий, очень неприятный (зловонный) запах. Является единственным из неметаллов, при комнатной температуре находящийся в жидком состоянии.
Бром (а также – пары брома)– токсичное и ядовитое вещество, при работе с ним необходимо применять средства химической защиты, потому что при попадании на кожу и слизистые человека бром образует ожоги.
Состав природного брома – два стабильных изотопа ( 79 Br и 81 Br), молекула брома состоит из двух атомов и имеет химическую формулу Br2.
Суточная потребность организма в броме
Потребность здорового организма в броме – не более 0,8-1 г.
Продукты питания богатые бромом
Наряду с имеющимся в организме, бром человек получает с пищевыми продуктами. Основными поставщиками брома являются орехи (миндаль, фундук, арахис), бобовые (фасоль, горох и чечевица), пшеница и макаронные изделия из твёрдых сортов пшеницы, ячневая крупа, молочные продукты, водоросли и практически все виды морской рыбы.
Опасность и вред брома
Не рекомендуется применять препараты брома людям, в силу специфики работы нуждающимся в стабильной концентрации внимания (водителям, альпинистам, монтажникам-высотникам).
Признаки избытка брома
Переизбыток данного вещества обычно бывает при передозировке препаратов брома, для людей категорически нежелательна, потому что может представлять реальную опасность для здоровья. Основные признаки избытка брома в организме – воспаления и высыпания на коже, сбои в работе пищеварительной системы, общая вялость и подавленность, постоянные бронхиты и риниты, не связанные с простудами и вирусами.
Признаки нехватки брома
Нехватка в организме брома проявляется бессонницей, замедлением роста у детей и подростков, понижением уровня гемоглобина в крови, но, не всегда эти симптому связывают именно с недостаточным количеством брома, поэтому для подтверждения подозрений, нужно посетить доктора и сдать необходимые анализы. Часто из-за нехватки брома повышается риск самопроизвольного прерывания беременности (выкидыш на разных сроках, вплоть до третьего триместра).
Полезные свойства брома и его влияние на организм
Бром (в виде бромидов) применяется при различных заболеваниях, основное его действие – седативное, поэтому препараты брома часто назначаются при нервных расстройствах и нарушениях сна. Соли брома являются эффективным средством для лечения заболеваний, вызывающих судороги (особенно эпилепсии), а также нарушений деятельности сердечно-сосудистой системы и некоторых желудочно-кишечных недугов (язвы желудка и двенадцатиперстной кишки).
Усвояемость брома
Усвояемость брома замедляют хлор, алюминий, йод и фтор, поэтому принимать препараты, содержащие соли брома нужно только после консультации с врачом.
Бром и его влияние на мужскую потенцию
Вопреки ничем не подтверждённым слухам (больше похожим на анекдоты), бром не оказывает угнетающего воздействия на половое влечение и потенцию мужчин. Якобы бром в виде белого порошка добавляют в еду молодым бойцам в армии, а также пациентам мужского пола в псих-диспансерах и заключённым в тюрьмах и колониях. Этому нет ни одного научного подтверждения, а слухи можно объяснить способностью брома (его препаратов) оказывать успокаивающее воздействие.
По некоторым источникам, бром способствует активизации половой функции у мужчин и увеличению как объёма эякулянта, так и количества сперматозоидов, в нём содержащихся.
Применение брома в жизни
Бром применяется не только в медицине (бромид калия и бромид натрия), но и в других областях, например в фотографии, нефтедобыче, в производстве моторного топлива. Бром используется при изготовлении боевых отравляющих веществ, что ещё раз подчёркивает необходимость осторожного обращения с данным элементом.
Бром в честь чего назван
Бром / Bromum (Br), 35
[Ar] 3d 10 4s 2 4p 5
Содержание
История
Бром был открыт в 1826 году молодым преподавателем колледжа города Монпелье А. Ж. Баларом. Открытие Балара сделало его имя известным всему миру. Из одной популярной книги в другую кочует утверждение, что огорчённый тем, что в открытии брома никому неизвестный Антуан Балар опередил самого Юстуса Либиха, Либих воскликнул, что, дескать, не Балар открыл бром, а бром открыл Балара. Однако это неправда, или, точнее, не совсем правда: фраза принадлежала не Ю. Либиху, а Шарлю Жерару, который очень хотел, чтобы кафедру химии в Парижском университете занял Огюст Лоран, а не избранный на должность профессора А. Балар.
Происхождение названия
Нахождение в природе
Кларк брома — 1,6 г/т. Бром широко распространён в природе и в рассеянном состоянии встречается почти повсеместно. Почти все соединения брома растворимы в воде и поэтому легко выщелачиваются из горных пород. Как примесь, он есть в сотнях минералов. Но имеется лишь небольшое количество нерастворимых в воде минералов — галогенидов серебра и меди. Самый известный из них — бромаргирит AgBr. Другие минералы — йодобромит Ag(Br, Cl, I), эмболит Ag(Cl, Br). Собственных минералов брома мало еще и потому, что его ионный радиус очень большой и ион брома не может надежно закрепиться в кристаллической решетке других элементов, вместе с катионами средних размеров. В накоплении брома основную роль играют процессы испарения океанической воды, в результате чего он накапливается как в жидкой, так и в твёрдой фазах. Наибольшие концентрации отмечаются в конечных маточных рассолах. В горных породах бром присутствует главным образом в виде ионов, которые мигрируют вместе с грунтовыми водами. Часть земного брома связана в организмах растений в сложные и большей частью нерастворимые органические соединения. Некоторые растения активно накапливают бром. Это в первую очередь бобовые — горох, фасоль, чечевица, а также морские водоросли. В море сосредоточена большая часть брома. Есть он и в воде соленых озер, и в подземных водоносных пластах, сопутствующих месторождениям горючих ископаемых, а также калийных солей и каменной соли. Есть бром и в атмосфере, причем содержание этого элемента в воздухе приморских районов всегда больше, чем в районах с резко континентальным климатом.
В качестве исходного сырья для производства брома служат:
Получение
Бром получают химическим путём из рассола Br − :
Физические свойства
При обычных условиях бром — красно-бурая жидкость с резким неприятным запахом, ядовит, при соприкосновении с кожей образуются ожоги. Бром — одно из двух простых веществ (и единственное из неметаллов), наряду со ртутью, которое при комнатной температуре является жидким. Плотность при 0 °C — 3,19 г/см³. Температура плавления (затвердевания) брома −7,2 °C, кипения 58,8 °C, при кипении бром превращается из жидкости в буро-коричневые пары, при вдыхании раздражающие дыхательные пути. Стандартный электродный потенциал Br2/Br − в водном растворе равен +1,065 В.
Природный бром состоит из двух стабильных изотопов 79 Br (50,56 %) и 81 Br (49,44 %). Искусственно получены многочисленные радиоактивные изотопы брома.
Химические свойства
В свободном виде существует в виде двухатомных молекул Br2. Заметная диссоциация молекул на атомы наблюдается при температуре 800 °C и быстро возрастает при дальнейшем росте температуры. Диаметр молекулы Br2 равен 0,323 нм, межъядерное расстояние в этой молекуле — 0,228 нм.
Бром немного, но лучше других галогенов растворим в воде (3,58 г в 100 г воды при 20 °C), раствор называют бромной водой. В бромной воде протекает реакция с образованием бромоводородной и неустойчивой бромноватистой кислот:
С большинством органических растворителей бром смешивается во всех отношениях, при этом часто происходит бромирование молекул органических растворителей.
По химической активности бром занимает промежуточное положение между хлором и иодом. При реакции брома с растворами иодидов выделяется свободный иод:
Напротив, при действии хлора на бромиды, находящиеся в водных растворах, выделяется свободный бром:
При реакции брома с серой образуется S2Br2, при реакции брома с фосфором — PBr3 и PBr5. Бром реагирует также с неметаллами селеном и теллуром.
Реакция брома с водородом протекает при нагревании и приводит к образованию бромоводорода HBr. Раствор HBr в воде — это бромоводородная кислота, по силе близкая к соляной кислоте HCl. Соли бромоводородной кислоты — бромиды (NaBr, MgBr2, AlBr3 и др.). Качественная реакция на присутствие бромид-ионов в растворе — образование с ионами Ag + светло-желтого осадка бромида серебра AgBr, практически нерастворимого в воде.
С кислородом и азотом бром непосредственно не реагирует. Бром образует большое число различных соединений с остальными галогенами. Например, со фтором бром образует неустойчивые BrF3 и BrF5, с иодом — IBr. При взаимодействии со многими металлами бром образует бромиды, например, AlBr3, CuBr2, MgBr2 и др. Устойчивы к действию брома тантал и платина, в меньшей степени — серебро, титан и свинец.
Бром — сильный окислитель, он окисляет сульфит-ион до сульфата, нитрит-ион — до нитрата и т. д.
При взаимодействии с органическими соединениями, содержащими двойную связь, бром присоединяется, давая соответствующие дибромпроизводные:
Присоединяется бром и к органическим молекулам, в составе которых есть тройная связь. Обесцвечивание бромной воды при пропускании через нее газа или добавлении к ней жидкости свидетельствует о том, что в газе или в жидкости присутствует непредельное соединение.
При нагревании в присутствии катализатора бром реагирует с бензолом с образованием бромбензола C6H5Br (реакция замещения).
При взаимодействии брома с растворами щелочей и с растворами карбонатов натрия или калия образуются соответствующие бромиды и броматы, например:
Бромсодержащие кислоты
Помимо бескислородной бромоводородной кислоты HBr, бром образует ряд кислородных кислот: бромную HBrO4, бромноватую HBrO3, бромистую HBrO.
Применение
В химии
В технике
В медицине
В производстве оружия
Со времен Первой мировой войны бром используется для производства боевых отравляющих веществ.
Физиологическое действие
Утечкой брома из железнодорожного вагона было вызвано чрезвычайное происшествие в городе Челябинске, вызвавшее отравление сотен жителей. Более 50 человек на следующий день лежали в больницах города с острым отравлением. Большинство — жители Ленинского района.
Особенности работы
При работе с бромом следует пользоваться защитной спецодеждой, противогазом, специальными перчатками. Из-за высокой химической активности и токсичности, как паров брома, так и жидкого брома его следует хранить в стеклянной, плотно укупоренной толстостенной посуде. Сосуды с бромом располагают в ёмкостях с песком, который предохраняет сосуды от разрушения при встряхивании. Из-за высокой плотности брома сосуды с ним ни в коем случае нельзя брать только за горло (горло может оторваться, и тогда бром окажется на полу).
По реакции, указанной ниже, целесообразно посыпать проливы карбонатом натрия:
Однако реакция элементарного брома с содой носит сильно экзотермический характер, что ведёт к увеличению испарения брома, к тому же, выделяющаяся углекислота также способствует испарению, поэтому пользоваться вышеописанными методами не рекомендуется. Лучше всего для дегазации брома подходит водный раствор тиосульфата натрия Na2S2O3. Для локализации больших проливов брома можно использовать раствор тиосульфата натрия с добавками пенообразующих веществ и аэросила. Этот же раствор (3-5 % тиосульфат натрия) используется для смачивания ватно-марлевых повязок, которые помогают защитить органы дыхания от паров брома.
Мифы и легенды
Существует широко распространенная легенда о том, что в армии будто бы добавляют бром в еду для снижения полового влечения. Происхождение этого мифа неизвестно.
Бром в честь чего назван
Содержание
История
Бром был независимо открыт двумя химиками: Карлом Якобом Лёвихом (нем. Carl Jacob Löwig ) в 1825 году, и Антуаном Жеромом Баларом в 1826 году. Открытие Балара, молодого преподавателя колледжа города Монпелье, сделало его имя известным всему миру. Из одной популярной книги в другую кочует утверждение, что, огорчённый тем, что в открытии брома никому не известный Антуан Балар опередил самого Юстуса фон Либиха, последний воскликнул, что, дескать, не Балар открыл бром, а бром открыл Балара. Однако это утверждение неточно: фраза принадлежала не фон Либиху, а Шарлю Жерару, который очень хотел, чтобы кафедру химии в Парижском университете занял Огюст Лоран, а не избранный на должность профессора А. Балар.
Происхождение названия
Название элемента происходит от др.-греч. βρῶμος — «дурной запах, зловоние».
Нахождение в природе
В качестве исходного сырья для производства брома служат:
Получение
Затем элементный бром выделяют из раствора потоком водяного пара или воздуха и конденсируют.
Физические свойства
Изотопы
Природный бром состоит из двух стабильных изотопов 79 Br (50,56 %) и 81 Br (49,44 %). Искусственно получены многочисленные радиоактивные изотопы брома.
Химические свойства
Бром немного, но лучше других галогенов растворим в воде ( 3,58 г на 100 г воды при 20 °C), раствор называют бромной водой. В бромной воде протекает реакция с образованием бромоводородной и неустойчивой бромноватистой кислот:
С большинством органических растворителей бром смешивается во всех отношениях, при этом часто происходит бромирование молекул органических растворителей.
По химической активности бром занимает промежуточное положение между хлором и йодом. При реакции брома с растворами йодидов выделяется свободный йод:
Напротив, при действии хлора на бромиды, находящиеся в водных растворах, выделяется свободный бром:
При реакции брома с серой образуется S2Br2, при реакции брома с фосфором — PBr3 и PBr5. Бром реагирует также с неметаллами селеном и теллуром.
Реакция брома с водородом протекает при нагревании и приводит к образованию бромоводорода HBr. Раствор HBr в воде — это бромоводородная кислота, по силе близкая к соляной кислоте HCl. Соли бромоводородной кислоты — бромиды (NaBr, MgBr2, AlBr3 и др.). Качественная реакция на присутствие бромид-ионов в растворе — образование с ионами Ag + светло-желтого осадка бромида серебра AgBr, практически нерастворимого в воде.
С кислородом и азотом бром непосредственно не реагирует. Бром образует большое число различных соединений с остальными галогенами. Например, со фтором бром образует неустойчивые BrF3 и BrF5, с йодом — IBr. При взаимодействии со многими металлами бром образует бромиды, например, AlBr3, CuBr2, MgBr2 и др. Устойчивы к действию брома тантал и платина, в меньшей степени — серебро, титан и свинец.
Жидкий бром легко взаимодействует с золотом, образуя трибромид золота AuBr3:
Бром — сильный окислитель, он окисляет сульфит-ион до сульфата, нитрит-ион — до нитрата и т. д.
При взаимодействии с органическими соединениями, содержащими двойную связь, бром присоединяется, давая соответствующие дибромпроизводные:
Присоединяется бром и к органическим молекулам, в составе которых есть тройная связь. Обесцвечивание бромной воды при пропускании через неё газа или добавлении к ней жидкости свидетельствует о том, что в газе или в жидкости присутствует непредельное соединение.
При нагревании в присутствии катализатора бром реагирует с бензолом с образованием бромбензола C6H5Br (реакция замещения).
При взаимодействии брома с растворами щелочей и с растворами карбонатов натрия или калия образуются соответствующие бромиды и броматы, например:
Реагирует с родановодородом:
HSCN + Br2 ⟶ BrCN + HBr + S↓
Бромсодержащие кислоты
Помимо бескислородной бромоводородной кислоты HBr, бром образует ряд кислородных кислот: бромную HBrO4, бромноватую HBrO3, бромистую HBrO2, бромноватистую HBrO.
Применение
В химии
Промышленное применение
Значительная часть элементарного брома до начала 1980-х использовалась для производства 1,2-дибромэтана, входившего в состав этиловой жидкости — антидетонирующей добавки в бензины, содержащей тетраэтилсвинец; дибромэтан в этом случае служил источником брома для образования относительно летучего дибромида свинца для предотвращения осаждения твёрдых оксидов свинца на деталях двигателя. Бром также используется в синтезе антипиренов — добавок, придающих пожароустойчивость пластикам, древесине, текстильным материалам.
В медицине
В производстве оружия
Со времен Первой мировой войны бром используется для производства боевых отравляющих веществ.
Физиологическое действие
Биологическое значение
В 2014 году исследование показало, что бром (в форме бромид-иона) является необходимым кофактором в ходе биосинтеза коллагена IV, делая элемент существенным в архитектуре базальной мембраны и развитии тканей у животных. Тем не менее, не было отмечено никаких чётких симптомов или синдромов дефицита при полном удалении брома из пищи. В других биологических функциях бром может не быть необходимым, но всё же приносить пользу, особенно когда он заменяет хлор. Например, в присутствии перекиси водорода H2O2 синтезируемая эозинофилами с ионами хлорида или бромида эозинофильная пероксидаза обеспечивает мощный механизм, с помощью которого эозинофилы убивают многоклеточных паразитов (таких, как, например, нематодные черви, участвующие в филяриозе) и некоторые бактерии, такие как бактерии туберкулёза). Эозинофильная пероксидаза — это галопероксидаза, которая более эффективно использует бром, а не хлор для этой цели, производя гипобромит (бромводородную кислоту), хотя использование хлорид-иона также возможно. Хотя α-галоэфиры, как правило, считаются высокореактивными и, следовательно, токсичными промежуточными продуктами в биоорганическом синтезе, млекопитающие, включая людей, кошек и крыс, по-видимому, биосинтезируют следы α-бромэфира, 2-октил-4-бром-3-оксобутаноата, которые присутствуют в их спинномозговой жидкости и, вероятно, играют пока неясную роль в возникновении быстрого сна.
Морские организмы являются основным источником броморганических соединений, и именно в этих организмах роль брома могла бы быть намного более высокой. Более 1600 таких броморганических соединений были идентифицированы к 1999 году. Наиболее распространённым является метилбромид (CH3Br), около 56 000 тонн которого синтезируется за год морскими водорослями. Эфирное масло гавайской водоросли Asparagopsis taxiformis состоит из 80 % бромоформа. Большинство таких броморганических соединений в море синтезируется водорослями под действием уникального фермента, ванадийбромпероксидазы.
Особенности работы
При работе с бромом следует пользоваться защитной спецодеждой, противогазом, специальными перчатками. Из-за высокой химической активности и токсичности как паров брома, так и жидкого брома его следует хранить в стеклянной, плотно закупоренной толстостенной посуде. Сосуды с бромом располагают в ёмкостях с песком, который предохраняет сосуды от разрушения при встряхивании. Из-за высокой плотности брома сосуды с ним ни в коем случае нельзя брать только за горло (горло может оторваться, и тогда бром окажется на полу).
Проливы брома целесообразно посыпать карбонатом натрия:
либо влажной пищевой содой:
Мифы, легенды, заблуждения и их опровержения
Существует широко распространённая городская легенда, будто бы в армии, местах лишения свободы и психиатрических больницах добавляют соединения брома в еду для снижения полового влечения. Происхождение этого мифа доподлинно неизвестно.
Препараты брома имеют солёный вкус и оказывают седативный (успокаивающий) и снотворный эффект.