Клинико эпидемиологическая характеристика что это
Клинико эпидемиологическая характеристика что это
Важность проблемы заболеваемости паразитозами заключается не только в масштабности данных заболеваний, но и в том, какой ущерб здоровью населения наносят осложнения, провоцируемые ими. Это аллергизация и иммуносупрессия, канцерогенез, анемия, поражения желудочно-кишечного тракта и мочеполовой системы, дисбактериоз. У детей, больных паразитозом, отмечается отставание в нервно-психическом развитии, раздражительность, ослабление памяти. Все эти факты ставят паразитозы в ряд важнейших проблем современного здравоохранения [1, 2].
Гельминтозы человека являются актульной проблемой для медицинской науки и практического здравоохранения. В последние годы отмечается тенденция к росту лямблиоза, так по данным экспертов ВОЗ, в странах Азии, Африки, Латинской Америки ежегодно лямблиозом заражаются около 200 млн человек [3].
Giardia lamblia – простейшее класса жгутиковых, возбудитель лямблиоза. В цикле развития простейшего выделяют две стадии – вегетативной формы и цисты. Цисты, выделяемые с фекалиями, устойчивы к факторам окружающей среды: в воде они остаются жизнеспособными до 3 месяцев, устойчивы к хлору. Это самый распространенный патогенный паразит, причиной, которой является неудовлетворительное состояние систем водоснабжения и очистных сооружений. Основным резервуаром инфекции служит человек, но и млекопитающие (собаки, кошки) могут быть заражены лямблиями и выделять цисты [4, 5].
Лямблиоз распространен повсеместно, цисты лямблий в фекалиях обнаруживаются у 20 % населения земного шара. Неблагополучная эпидемиологическая обстановка по заболеваемости лямблиозом обусловлена, прежде всего, неудовлетворительным обеспечением населения доброкачественной питьевой водой, загрязнением открытых водоемов неочищенными канализационными стоками. Немалый вклад в увеличение заболеваемости лямблиозом вносят различные неблагоприятные состояния: прежде всего несбалансированное питание в виде повышенного потребления легко усвояемых углеводов на фоне значительного дефицита белка, а так же нарушение микрофлоры кишечника после терапии антибиотиками (особенно при многократных курсах) [5, 6].
Клинические проявления лямблиоза регистрируются во всем мире почти у 500 млн. больных в год. Лямблиоз встречается повсеместно, в среднем выявляется у 20 % практически здорового населения. Является наиболее распространенной инвазией кишечника в развитых странах, во всех климатогеографических зонах. Лямблиоз регистрируется во всех возрастных группах. В развитых странах инвазированность среди взрослых составляет 3-5 %, а в развивающихся – свыше 10 %. [7,8].
По данным ВОЗ распространенность лямблиоза в детской популяции составляет 350 случаев на 100000 детского населения. Этот показатель в разных регионах может значительно колебаться в большую или меньшую сторону в зависимости санитарно-бытовых условий, возможности диагностики и настороженности врачей.
Частота манифестного лямблиоза составляет 13–43 %, субклинического – 49 %, бессимптомного – 25–28 % от числа инвазированных лямблий. Особенность возбудителя, состояние реактивности макроорганизма, полиморфизм клинических проявлений, наблюдение и лечение у специалистов разных профилей у терапевтов, гастроэнтерологов, дерматологов привили к росту хронических форм заболевания над острыми с длительной персистенцией лямблий и ухудшением качества жизнь пациента. [7, 8].
Согласно классификации ВОЗ выделяют:
1. лямблионосительство (бессимптомный лямблиоз);
2. лямблиоз (клинически выраженная форма), который проявляется, преимущественно, в виде:
– кишечной формы (дискинезия двенадцатиперстной кишки, дуоденит, энтерит, энтероколит);
– гепатобилиарной формы (дискинезия желчных путей, холецистит);
– лямблиоза как сопутствующего заболевания.
Среди клинических проявлений лямблиоза выделяют две основные формы:
– первичная инвазия или острый лямблиоз, чаще распространенный среди детей раннего возраста;
– затяжное рецидивирующее течение или хронический лямблиоз, регистрируемый у детей более старшего возраста и взрослых.
Цель исследования – современная клинико-эпидемилогическая характеристика лямблиоза.
Материалы и методы исследования
Всего было проанализировано 300 историй болезней (взрослых – 197, детей – 103) с диагнозом: «Лямблиоз кишечная форма, хроническое течение в стадии обострения» в возрасте до 60 лет.
Оценивались объективные и субъективные данные, а также изменения лабораторных показателей. В ходе работы впервые разработана индивидуальная регистрационная форма, куда внесены полученные результаты по объективным и субъективным данным, дополнительных лабораторных исследований до и после традиционного лечения.
Критериями для включения в исследование являлись больные острой и хронической формой лямблиоза, диагноз у которых был подтвержден микроскопическим обнаружением вегетативных форм лямблий и их цист в кале.
Диагноз был верифицирован на основании клинико-анамнестических и лабораторных (копроскопия кала, результат дуоденального зондирования, ПЦР-диагностика). Вегетативные формы лямблий были обнаружены в дуоденальном содержимом и жидких испражнениях, цистированные формы – в нативных фекалиях в течение 2-х часов после сбора анализа. Дополнительно всем больным проводилось ультразвуковое исследование (УЗИ).
На основании полученных дополнительных лабораторных данных была проведена статистическая обработка с использованием критерия Стьюдента, или t-критерий. Проверка осуществляется на основе выборочных данных. Проверяется нулевая и альтернативная гипотезы:
Н(0): две генеральные средние равны, или, другими словами, две сравниваемые выборки принадлежат к одной и той же генеральной совокупности. Проверяемый t-критерий выражается в виде отношения:
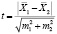
где m1, m2 – стандартные ошибки средних значений сравниваемых выборок.
tкрит находится по таблице для заданного α и числа степеней свободы
Острые инфекционные диарейные заболевания: вопросы терапии
Вопросы фармакологического лечения больных острыми инфекционными диарейными заболеваниями (ОИДЗ) регулярно освещаются практически во всех периодических медицинских изданиях, ориентированных на практических врачей [1—4], что объясняется широким распростра
Вопросы фармакологического лечения больных острыми инфекционными диарейными заболеваниями (ОИДЗ) регулярно освещаются практически во всех периодических медицинских изданиях, ориентированных на практических врачей [1—4], что объясняется широким распространением ОИДЗ во всех без исключения странах мира [5—7]. Главной целью статей такого плана является разработка диагностических и терапевтических алгоритмов, позволяющих врачам использовать дифференцированные и наиболее оптимальные схемы обследования и лечения больных. К сожалению, нередко приходится констатировать, что врачи общей практики из всего комплекса терапевтических мероприятий особое внимание уделяют антимикробной терапии, что не всегда является оправданным и целесообразным.
Несмотря на достижения в лабораторной верификации ОИДЗ, до сих пор от 30 до 50 % всех случаев инфекционных диарейных заболеваний этиологически не расшифрованы, что свидетельствует об их более обширной этиологической структуре, чем мы традиционно привыкли себе представлять. Согласно современным данным, ОИДЗ могут вызываться более чем тридцатью разнообразными микроорганизмами, в том числе бактериями, вирусами и простейшими (табл. 1).
Как показывают многочисленные эпидемиологические исследования, в различных странах мира имеются существенные различия в этиологической структуре ОИДЗ [8, 9], что связано с рядом факторов, в том числе климатических и эколого-биологических. Именно в силу этого этиологическая расшифровка ОИДЗ имеет исключительное практическое значение, поскольку позволяет определить, хотя и относительно, наиболее оптимальную схему этиотропной терапии больных [10]. В то же время на практике нередко приходится сталкиваться с ситуациями, когда используемые в муниципальных бактериологических лабораториях методы исследований позволяют идентифицировать только ограниченный спектр классических возбудителей ОИДЗ.
В силу указанных причин назначаемая врачом стартовая эмпирическая терапия должна основываться прежде всего на анализе особенностей клинического течения заболевания (табл. 2) и данных эпидемиологического анамнеза. Подробно собранный эпидемиологический анамнез уже сам по себе несет столь полезную информацию, что в некоторых случаях является определяющим фактором при подозрении на определенные инфекционные заболевания. Речь идет прежде всего о «завозных» случаях ОИДЗ, которые в медицинской литературе часто обозначают как «диарея путешественников». В нашей стране данный термин не используется широко, поскольку само заболевание не выделено как самостоятельная нозологическая форма. После лабораторной верификации может оказаться, что под маской диареи путешественников скрываются холера, вибрио-инфекция, амебиаз, шигеллез, сальмонеллез и ряд других инфекционных заболеваний, требующих специальных схем лечения. По современным представлениям, путешествия (особенно в развивающиеся страны) являются исключительным фактором риска инфицирования различными возбудителями инфекционных заболеваний, в том числе ОИДЗ. Результаты современных исследований свидетельствуют о том, что диарея у туристов, посещающих развивающиеся страны, регистрируется в 20—50 % случаев [11, 12].
Один из наиболее частых вариантов течения ОИДЗ — гастроэнтерит. Сложность дифференциальной диагностики данного варианта течения заболевания заключается в том, что он нередко развивается при состояниях, даже не связанных с инфекцией (в том числе может регистрироваться в дебюте острого аппендицита).
Из группы ОИДЗ наиболее часто гастроэнтеритический вариант течения встречается при пищевых токсикоинфекциях (ПТИ), бактериальных ОИДЗ с секреторным механизмом развития диарейного синдрома, вирусных гастроэнтеритах, криптоспоридиозе и гиардиозе (лямблиозе). Этиологическая и клинико-эпидемиологическая характеристики ПТИ, вирусных гастроэнтеритов и протозойных диарейных заболеваний представлены в таблицах 3—5.
В установлении первичного диагноза важное место имеет предположительное определение длительности инкубационного периода. Самый короткий инкубационный период из группы ОИДЗ типичен для ПТИ, поскольку при инфицировании в организм человека поступают не только сам возбудитель, но и уже выработанные им энтеротоксины. При ПТИ длительность инкубационного периода, как правило, составляет от 6 до 12 ч с возможными вариантами в сторону укорочения или удлинения, но не более 24 ч. Более длительный инкубационный период (от 16 до 72 ч и более) регистрируется при сальмонеллезах, шигеллезах, кампилобактериозах, иерсиниозах, эшерихиозах, вибрио-инфекции, в том числе холере.
Если подозрение на ПТИ обосновано, целесообразно в ранние сроки заболевания (первые 6—12 ч, но не позднее 24 ч) провести промывание желудка до чистых промывных вод с последующим приемом энтеросорбентов. Поскольку для энтеросорбентов не характерна специфичность действия, могут быть использованы препараты различных классов (Полифепан, Полисорб, Карболонг, Пепидол Пэг и др.). Прием препаратов показан в первые 2—3 дня заболевания. Полифепан назначают по 1 столовой ложке 3 раза в день, размешав в воде. Смекта (помимо энтеросорбции оказывает протекторный эффект на слизистую оболочку кишечника) назначается по 1 пакетику 3—4 раза в день. Длительность приема энтеросорбентов обычно составляет 3—5 дней. В большинстве амбулаторных случаев ПТИ больные не нуждаются в расширенной фармакотерапии.
Пациентам с гастроэнтеритическим вариантом ОИДЗ, как правило, не назначают антибактериальную терапию. Основным направлением в терапии таких больных является регидратация, целью которой является быстрое и адекватное восполнение водно-электролитных потерь. Данное направление является базовым в лечении всех без исключения больных ОИДЗ. Количество необходимых для введения регидратационных растворов определяется в соответствии со степенью развившегося обезвоживания (табл. 6).
В зависимости от степени обезвоживания проводят оральную и парентеральную регидратационную терапию (табл. 7). Для оральной регидратации (при обезвоживании I и II степени) применяются глюкозо-электролитные растворы, ОРС (оральная регидрационная соль), Оралит, Регидрон, Цитроглюкосолан. Простейший солевой раствор для оральной регидратации (в случае отсутствия официнальных), согласно рекомендациям ВОЗ, можно приготовить в домашних условиях. Для этого нужно растворить половину чайной ложки поваренной соли (2,5 г), 6 чайных ложек сахара (30 г) в 1 л питьевой воды. Для парентеральной регидратации используются полиионные растворы (при дегидратации III—IV степени) Трисоль, Ацесоль, Хлосоль, Квартосоль, Лактосоль. У пациентов с гиперкалиемией применяют кристаллоидный раствор дисоль.
Критериями эффективности регидратационной терапии являются улучшение самочувствия больного, стабилизация артериального давления, снижение частоты пульса, прекращение рвоты, восстановление диуреза, а также нормализация показателей удельной плотности плазмы крови и гематокрита. Клиническим ориентиром для перевода пациентов с инфузионной на оральную регидратацию является преобладание объема выделяемой мочи над объемом испражнений за последние 6—12 ч.
Антибактериальная терапия, как правило, назначается пациентам с экссудативными (инвазивными) диареями, а также тяжелыми формами течения ОИДЗ. Кроме этого, антибактериальная терапия показана детям до 3 лет и людям пожилого возраста; лицам, имеющим прямые и косвенные признаки иммуносупрессии (в том числе перенесшим трансплантацию органов и тканей, больным сахарным диабетом, циррозом печени, хронической почечной недостаточностью и т. д.). Выбор препаратов диктуется наиболее вероятным (до момента верификации возбудителя) заболеванием, определяемым в зависимости от наличия эпидемиологических (климато-географический регион, текущая эпидобстановка, путешествия) и клинических (энтероколит, примеси крови и слизи в стуле) признаков. Наиболее часто препаратами выбора служат лекарственные средства из группы фторхинолонов: ципрофлоксацин (Ципролет), офлоксацин, пефлоксацин и др., назначаемые в среднетерапевтических дозировках на 5—7 дней (табл. 8).
В качестве препаратов второго выбора или альтернативных лекарственных средств применяют цефалоспорины III поколения. Для лечения легких форм ОИДЗ в России могут назначаться нитрофураны (фуразолидон). Перспективны для расширения реестра средств лечения некоторых ОИДЗ макролиды (азитромицин) и полусинтетические пенициллины, однако на сегодня требуется проведение дополнительных исследований для уточнения показаний для их применения.
Клиническая эффективность назначаемых антибактериальных препаратов оценивается по основным клиническим проявлениям заболевания в течение 48 ч от момента начала их назначения. В качестве критериев эффективности чаще всего выступают такие признаки, как снижение кратности дефекаций, уменьшение количества патологических примесей в стуле (крови, слизи, гноя), снижение высоты лихорадки, улучшение аппетита и др. Наиболее высокая клиническая эффективность антибактериальных препаратов регистрируется при максимально раннем начале их применения.
Персистирующая диарея протозойной этиологии требует применения этиотропных препаратов иных групп, назначение которых осуществляется только врачом после лабораторного подтверждения диагноза.
Кроме того, больным по показаниям назначают симптоматическую терапию, направленную на «смягчение» клинических проявлений заболевания. К числу таких препаратов относятся спазмолитики (но-шпа), ферментные препараты (мезим форте, фестал, креон, панцитрат и др.), которые используются для улучшения пищеварения в период ранней реконвалесценции в общетерапевтических дозировках в течение 7—10 дней. При наличии у пациентов метеоризма, обусловленного повышенном газообразованием, показан эспумизан по 40 мг (капсулы или эмульсия) после каждого приема пищи.
В периоде реконвалесценции целесообразен прием пробиотиков: Бион 3 по 1 таблетке в сутки (этот препарат, кроме бактериальных культур, содержит сбалансированный комплекс витаминов и микроэлементов), Линекс по 2 капсулы 3 раза в день, Бифидумбактерин форте по 5 доз 3 раза в день и др., курс лечения которыми продолжается в течение 7—10 дней. Не следует принимать пробиотики на фоне выраженного диарейного синдрома и сочетать их прием с антимикробными препаратами.
С целью ускорения санации организма от возбудителей ОИДЗ показан энтерол, содержащий непатогенные дрожжи Saсcharomyces boulardii, антагонистические свойства которых способны подавлять рост широкого спектра условно-патогенной и патогенной флоры в желудочно-кишечном тракте. При нетяжелом течении ОИДЗ энтерол может применяться как альтернатива антимикробным препаратам. Назначается препарат по 2—4 капсулы в сутки в два приема в течение 5—10 дней.
Исключительную осторожность необходимо проявлять при назначении имодиума, который подавляя моторику кишечника, может служить фактором, усугубляющим течение заболеваний, особенно обусловленных инвазивным энтеропатогенными штаммами.
По вопросам литературы обращайтесь в редакцию.
В. А. Малов, доктор медицинских наук, профессор
А. Н. Горобченко, кандидат медицинских наук, доцент
Л. Н. Дмитриева, кандидат медицинских наук, доцент
ММА им. И. М. Сеченова, Москва
Клинико-эпидемиологическая характеристика и основные направления профилактики гепатита А
Определение. Доброкачественное остроциклическое энтеровирусное заболевание, характеризующееся цитопатическим действием вируса на гепатоциты и клинически проявляющееся синдромом интоксикации, гепатоспленомегалией и часто желтухой. Этиология и патогене
Определение. Доброкачественное остроциклическое энтеровирусное заболевание, характеризующееся цитопатическим действием вируса на гепатоциты и клинически проявляющееся синдромом интоксикации, гепатоспленомегалией и часто желтухой.
Эпидемиология. Источником инфекции является человек с любыми проявлениями болезни. Существенная часть заразившихся переносит болезнь в бессимптомной, а потому и нерегистрируемой форме. Величина этой доли составляет у детей 90-95%, а у взрослых — 25-50%. Больной человек опасен для окружающих начиная со второй недели инкубационного периода болезни с пиком в течение первой недели болезни. Вероятность заражения с появлением желтухи значительно уменьшается: в первую неделю желтушного периода частота положительных находок составляет 30-50%, во вторую — 15-25%, позже выделение вируса наблюдается лишь у единичных больных. Хроническое носительство вируса не установлено.
Механизм передачи — фекально-оральный. Вирус выделяется с фекальными массами. Заражение людей происходит при употреблении воды и пищи, инфицированной вирусом ГА, иногда контактно-бытовым путем. Передача возбудителя через медицинский инструментарий существенного значения не имеет. Роль каждого пути передачи неодинакова в разных условиях. Водный путь, как правило, приводит к вспышкам заболевания среди лиц, пользовавшихся инфицированной водой. Пищевые вспышки чаще всего связаны с контаминацией продуктов на пищевых предприятиях персоналом с легкой формой болезни. Возможно также заражение овощей и ягод при использовании в качестве удобрения фекалий человека. Бытовой путь передачи, как правило, имеет место в условиях организованных дошкольных детских учреждений.
Проявления эпидемического процесса. Болезнь характеризуется рядом особенностей: повсеместным распространением, неравномерной интенсивностью на отдельных территориях, цикличностью в многолетней динамике, выраженной осенне-зимней сезонностью, преимущественным поражением детей дошкольного возраста, подростков и лиц молодого возраста.
Вирусный гепатит А относится к числу наиболее широко распространенных в мире кишечных инфекций. ВОЗ сообщает о приблизительно 1,4 млн. случаев гепатита А, регистрируемых ежегодно.
Наибольшая восприимчивость к ГА характерна для детей от 2 до 14 лет. Определяет уровень детской заболеваемости возрастная группа 3-6 лет, в 1998 году он составил 82,7 в 1999 году — 77,0 на 100 тыс. населения. Заболеваемость среди городского и сельского населения практически сравнялась, показатели составляют соответственно 30,0 и 32,6. В 1999 году зарегистрирована 91 крупная вспышка ВГА с числом пострадавших 1422 человека. Из них детей — 1040 человек.
В 1999 году проведено исследование на антиген вируса гепатита А 14 152 объектов внешней среды. Из них положительных 474 (3,4%); причем наибольшее число положительных результатов получено из воды источников децентрализованного водоснабжения — 9,6%, фекально-бытовых сточных вод — 6,4%, что свидетельствует о широкой циркуляции возбудителя во внешней среде [2].
Вследствие этого повышенная заболеваемость наблюдается в регионах с неудовлетворительным состоянием санитарно-коммунального благосостояния, где отмечаются эпидемические вспышки, в основном водного происхождения. В многолетней динамике характерны периодические (через 4-6 лет) подъемы заболеваемости. Последние годы характеризуются очередным подъемом заболеваемости (см. рисунок).
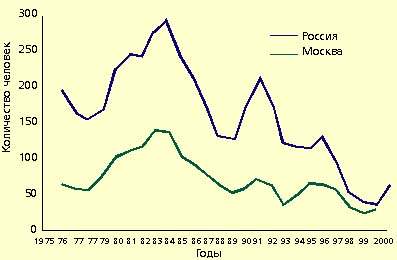 |
Подъем заболеваемости отмечен во всех возрастных группах населения, но наиболее выражен среди детей (рост — в 2,5 раза). Особенностью этого процесса в 2000 году в Москве явилось возникновение эпидемических вспышек с пищевым путем передачи. Восприимчивость к инфекции высокая, после перенесенной болезни вырабатывается стойкий напряженный иммунитет.
Клиника. Инкубационный период продолжается 3-4 недели. Начальный период заболевания (продромальный, дожелтушный) характеризуется достаточно большим разнообразием симптомов. Наиболее часто встречается лихорадочное (гриппоподобное) состояние. Одновременно больные отмечают явления дискомфорта в эпигастрии, снижение аппетита, тошноту, иногда рвоту, возникающую чаще после приема пищи. Возможны и другие проявления, в том числе по астеновегетативному варианту. В ряде случаев уже в этом периоде можно обнаружить увеличенную в размере печень и повышение показателей аминотрансфераз. Продолжительность начального периода в среднем около недели. Наблюдается плавный переход от дожелтушного к желтушному периоду. К этому моменту нормализуется температурная реакция, исчезают катаральные явления, однако диспепсические симптомы сохраняются или даже возрастают по интенсивности. Первым признаком наступления желтушного периода является потемнение мочи. Вскоре развивается желтуха, которую прежде всего можно заметить на слизистой ротовой полости (под уздечкой языка) и на склерах, а затем на кожных покровах. Язык обложен, стул может обесцвечиваться. Печень увеличена в размерах, достаточно плотной консистенции, слегка болезненная при пальпации. В половине случаев можно обнаружить спленомегалию. На фоне желтухи помимо диспепсических явлений больные отмечают адинамию, головокружение, иногда расстройства сна. Проявляется брадикардия, АД склонно к снижению.
Течение гепатита А обычно легкое или среднетяжелое, но не исключены и тяжелые варианты, и обострения. В некоторых случаях заболевание может приобрести затяжной характер. Фулминантная (злокачественная) форма гепатита встречается не более чем у 0,5% заболевших [1].
Дифференциальная диагностика. В продромальном периоде необходимо проводить дифференциальную диагностику с острыми респираторными и кишечными инфекциями, гриппом. В желтушном периоде заболевание дифференцируют с обтурационными и гемолитическими желтухами, мононуклеозом, иерсиниозом, лептоспирозом.
Лабораторная диагностика. Для установления этиологии гепатита и оценки его тяжести особое значение имеют лабораторные исследования. Возможно выделение вируса гепатита А из фекалий, но в широкой медицинской практике вирусологические исследования не применяются. Для верификации диагноза используют серологические реакции — ИФА, РИА, при проведении которых обнаруживается нарастание титров IgM-anti-HAV в желтушном периоде и нарастание титров IgG-anti-HAV к периоду реконвалесценции. Антитела класса М сохраняются в крови больного не дольше 6-8 месяцев и их наличие однозначно свидетельствует о текущей (или недавно перенесенной) гепатитной инфекции. При анализе крови необходимо учитывать наличие лейкопении, относительного лимфоцитоза и замедление СОЭ. Интенсивность желтухи устанавливается путем определения уровня билирубина в крови (особенно его связанной фракции). Активность аминотрансфераз (АлАТ, АсАТ) увеличивается в несколько раз, и степень их повышения говорит об интенсивности цитолиза гепатоцитов. Нарушение белково-синтетической функции печени отражает изменения показателей коллоидных проб (снижение сулемовой и повышение тимоловой проб), снижение уровня альбуминов в крови, а также уменьшение показателей протромбинового индекса.
Осложнения при вирусном гепатите А нечасты, однако могут манифестироваться воспалительные процессы в желчных путях (холециститы, холангиты, дискинезии), а также другие вторичные инфекции — пневмонии и т. д. Летальность, по данным мировой литературы, невысокая и составляет 0,1-0,4%, имеет место главным образом среди лиц с сопутствующими патологическими состояниями.
Лечение. При установлении этиологического фактора (ВГА) лечение больного можно проводить в амбулаторных условиях путем назначения постельного режима на период выраженного интоксикационного синдрома, обеспечения полноценного питания с исключением тугоплавких жиров и дополнительного введения в пищевые продукты витаминов групп С и В. Для снятия интоксикации в зависимости от ее степени назначаются обильное питье или инфузионные растворы. Для ежедневного очищения кишечника и подавления анаэробной флоры рекомендуется принимать препараты — производные лактулозы, вызывающие осмотическую диарею. С целью купирования холестатического компонента применяют спазмолитики (но-шпа, эуфиллин) и производные урсодезоксихолевой кислоты.
Профилактика и меры борьбы. Основными профилактическими мерами являются обеспечение населения доброкачественной водой и создание условий, гарантирующих выполнение санитарных правил, предъявляемых к заготовке, хранению, приготовлению и реализации продуктов питания. Важное значение имеет обеспечение надлежащего противоэпидемического режима в организованных детских коллективах. В период предсезонного повышения заболеваемости эффективна иммуноглобулинопрофилактика, обеспечивающая защиту в течение 3-4 месяцев. Вакцинация 50-60% детей дошкольных учреждений и 70-80% школьников обеспечивает снижение заболеваемости среди этих категорий населения. Детям дошкольного возраста вводят иммуноглобулин в дозе 0,75 мл, школьникам начальных классов — в дозе 1,5 мл (не более четырех раз в течение жизни с интервалом не менее одного года).
Заболевшие гепатитом подлежат госпитализации по клиническим и эпидемиологическим показаниям. Выписку реконвалесцентов и допуск их на работу (в том числе работников пищевых предприятий и лиц к ним приравненных) или детей в детские учреждения осуществляют в зависимости от состояния здоровья. В очаге инфекции устанавливают 35-дневное медицинское наблюдение за лицами, находившимися в контакте с больным. В дошкольных коллективах в течение этого периода запрещается перевод детей и персонала в другие группы, прием новых детей осуществляется только с разрешения эпидемиолога. Детям, которые общались с больными, и беременным вводят иммуноглобулин в дозе 1 мл — до 10 лет и 1,5 мл — лицам старше 10 лет. В очаге с использованием химических дезсредств проводится текущая и заключительная дезинфекция.
В настоящее время в качестве специфической профилактики предложена вакцина против гепатита А. Введение иммуноглобулинов обеспечивает быструю, но кратковременную защиту. Вакцинопрофилактика формирует активный иммунитет, сопровождающийся продолжительной циркуляцией собственных антител. В настоящее время выпускаются эффективные и безвредные вакцины против гепатита А для детей и взрослого населения, обеспечивающие иммунитет до 10 лет [3]. Учитывая высокую поражаемость детей и тот факт, что они являются основным источником инфекции для взрослых, перспективным направлением является вакцинопрофилактика гепатита А среди детей младшего возраста и школьников, которая уже широко используется в США и ряде стран Европы (Израиль, Испания, Италия).
В России зарегистрированы следующие вакцины:
Все вакцины представляют собой инактивированные формалином вирионы гепатита А, адсорбированные на гидроокиси алюминия, вводятся внутримышечно [3]. ГЕП-А-ин-ВАК назначается детям с 3 лет и взрослым. Взрослым вакцину вводят в дозе 0,5 мл в дельтовидную мышцу. Курс — три прививки по схеме 0-1 и 6 месяцев. Детям вводят 0,25 мл в дельтовидную мышцу дважды с интервалом в 1 месяц.
Аваксим рекомендован детям с 2 лет и взрослым однократно внутримышечно, ревакцинация проводится через 6-18 месяцев однократно, последующие ревакцинации — каждые 10 лет.
ВАКТА вводится с 2 лет как однократная первичная доза (детям 25 антигенных ед. — 0,5 мл, взрослым 50 антигенных ед. — 1,0 мл) с повторной дозой через 6-18 месяцев.
Хаврикс применяется как у детей начиная с одного года, так и у взрослых. Выпускается в ампулах по 0,5 мл (720 ед.) для детей и по 1,0 мл (1440 ИФА ед.) для взрослых.
Вакцинация стимулирует развитие иммунитета через 21-28 суток. Титры антител, хотя и ниже, чем после заболевания, обеспечивают надежную защиту от инфекции.
В ряду упомянутых зарегистрированных вакцин против гепатита А вакцина ВАКТА обладает рядом исключительных характеристик, а именно:
1. ВАКТА — единственная вакцина, обеспечивающая 100%-ную защиту после введения первой дозы [4, 5].
Протективная эффективность, иммуногенность и безопасность вакцины были оценены в рамках рандомизированного двойного слепого плацебо-контролируемого исследования, в котором приняли участие 1037 восприимчивых здоровых детей и подростков в возрасте от 2 до 16 лет в одном из американских населенных пунктов с повторяющимися вспышками гепатита А (исследование эффективности вакцины «Монро»). Население г. Монро (штат Нью-Йорк) религиозно и там наблюдался редкий для США эндемический уровень вирусного гепатита А, более 3000 случаев заболевания на 100 тыс. населения — в 60 с лишним раз выше, чем в среднем по США в то время [4].
Проспективные конечные точки исследования были установлены в 50 и 30 дней. Случаев гепатита А не наблюдалось ни в один из указанных временных промежутков, что говорит о 100%-ной защитной эффективности вакцины. Учитывая, что инкубационный период гепатита А составляет 20-30 (а у детей, возможно, и более) дней, был сделан вывод о том, что любой участник исследования, имевший контакт с вирусом уже через 10 дней после иммунизации вакциной ВАКТА, был защищен. Следует отметить, что в действительности клинически подтвержденных случаев заболевания гепатитом А не наблюдалось не только после первой конечной точки исследования (30 дней), но уже на 14-й день после иммунизации, по сравнению с 34 случаями в группе плацебо.
2. ВАКТА — высокоочищенная вакцина, не содержащая консервантов (см. таблицу).
В целях усиления борьбы с вирусным гепатитом А в Москве осенью 2000 года была проведена работа по селективной вакцинации школьников в очагах этой инфекции и показана высокая эффективность данного мероприятия. Учитывая полученные результаты, а также продолжающийся рост заболеваемости, издано Постановление главного государственного врача по г. Москве, предусматривающее вакцинацию против гепатита А работников пищевых предприятий, коммунального хозяйства и транспорта. Организация и проведение целенаправленных профилактических мероприятий во многом зависят от финансовой поддержки правительства Москвы.
